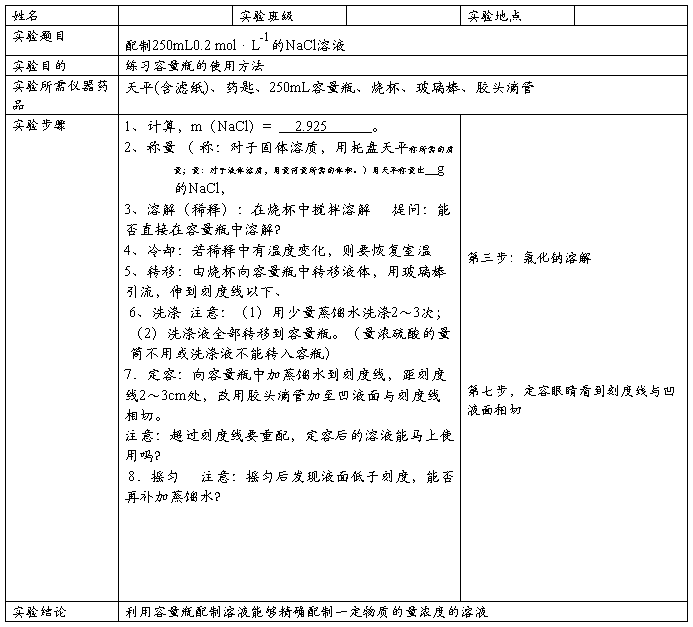
篇二 :配制一定物质的量浓度的溶液实验报告
配制一定物质的量浓度的溶液实验报告
实验目的
1、练习配制一定物质的量浓度的溶液。
2、加深对物质的量浓度概念的理解。
3、练习容量瓶、胶头滴管的使用方法。
实验原理
n=C V,配制标准浓度的溶液
实验用品
烧杯、容量瓶(100mL)、胶头滴管、量筒、玻璃棒、药匙、滤纸、托盘天平、NaCl(s)、蒸馏水。
实验步骤
(1)计算所需溶质的量
(2)称量:固体用托盘天平,液体用量筒(或滴定管/移液管)移取。
(3)溶解或稀释(用玻璃棒搅拌)
(4)移液:把烧杯液体引流入容量瓶(用玻璃棒引流)。
(5)洗涤:洗涤烧杯和玻璃棒2~3次,洗涤液一并移入容量瓶,振荡摇匀。
(6)定容:向容量瓶中注入蒸馏水至距离刻度线2~3 cm处改用胶头滴管滴蒸馏水至溶液凹液面与刻度线正好相切。(要求平视)
(7)盖好瓶塞,反复上下颠倒,摇匀。
实验结果
计算出溶质的质量
实验结论
(1)配制一定物质的量浓度的溶液是将一定质量或体积的溶质按所配溶液的体积在选定的容量瓶中定容,因而不需要计算水的用量。
(2)不能配制任意体积的一定物质的量浓度的溶液。这是因为在配制的过程中是用容量瓶来定容的,而容量瓶的规格又是有限的,常用的有50 mL、100 mL、250 mL、500 mL、和1000 mL等。所以只能配制体积与容量瓶容积相同的一定物质的量浓度的溶液。
备注
重点注意事项:
(1)容量瓶使用之前一定要检查瓶塞是否漏水;
(2)配制一定体积的溶液时,容量瓶的规格必须与要配制的溶液的体积相同;
(3)不能把溶质直接放入容量瓶中溶解或稀释;
(4)溶解时放热的必须冷却至室温后才能移液;
(5)定容后,经反复颠倒,摇匀后会出现容量瓶中的液面低于容量瓶刻度线的情况,这时不能再向容量瓶中加入蒸馏水。因为定容后液体的体积刚好为容量瓶标定容积。上述情况的出现主要是部分溶液在润湿容量瓶磨口时有所损失;
…… …… 余下全文
篇三 :一定物质量浓度溶液的配制实验报告
配制一定物质的量浓度的溶液
考试内容:配制100ml0.1mol/LNa2CO3溶液
实验名称:配制100ml0.1mol/LNa2CO3溶液
实验目的:练习配制一定物质的量浓度的溶液;加深对物质的量浓度概念的理解;练习容量瓶的使用方法。
实验原理:溶液稀释前后溶质的物质的量不变。
实验用品:托盘天平、小烧杯、药匙、容量瓶(100ml)、胶头滴管、玻璃棒、量筒、蒸馏水、Na2CO3固体粉末
实验步骤与装置图:
1.计算 所需 Na2CO3固体粉末的质量为:
m(Na2CO3)=100×10-3×0.1mol/L×106g·mol-1=1.06g 因为托盘天平的精确度只能达到0.1,所以应称量1.1g 。
2.称量 称量固体一般应在托盘天平两端各垫一张大小相同的纸。
3.溶解 先将固体置于烧杯中,加入约所配溶液体积一半的水溶解,搅拌并冷却到室温。
4.转移液体 将冷却后的溶液沿玻璃棒转移到容量瓶中。
5.洗涤 用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
6.定容 向容量瓶中加水至离刻度1~2cm处,改用胶头滴管加水至刻度线。定容时,溶液凹液面恰好与刻度线相切。
7.摇匀
①计算;②称量;③溶解;④冷却转移;⑤振荡;⑥定容;⑦摇匀;⑧倒瓶贴签。

实验现象及误差分析:
1.在溶解过程中用玻璃棒搅拌过于剧烈,不慎溅出几滴溶液,会时配成的溶液浓度比标准值偏低。解释:因溅出几滴溶液会使溶液中溶质的物质的量减少,而溶液的体积不变,所以浓度偏低。
2.定容后的溶液从容量瓶导入试剂瓶时,不慎倒在外面少许,不会造成误差。解释:往试剂瓶倒入时不慎倒出少许,影响的仅是所配之溶液的体积,对所配溶液的物质的量浓度无任何影响。
3.定容时不慎滴加液体超过刻度线,则改实验失败,应倒掉重新配制。解释,容量瓶只能配制固定体积的溶液,定容超过刻度线,就意味着实验失败。
…… …… 余下全文
篇四 :配制一定浓度的溶液实验报告
实验题目:配制一定浓度的溶液
班级 姓名 同组人
实验目的:
掌握配制某A%溶液的方法
实验器材:
天平、药匙、烧杯、量筒(50ml)、细口瓶、食盐
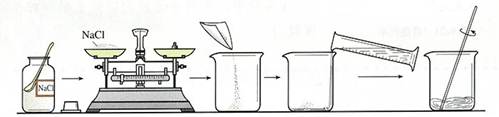
实验步骤:
1、计算:算出配制50g,6%的NaCl深液中NaCl和H2O的质量。
m(NaCl)= g
m(水)= g
V(水)= ml
2、称量,溶解:用天平称出所需NaCl倒入烧杯中。用量筒量取所需的水,倒入盛有NaCl的烧杯中,搅拌。
3、装瓶:把溶液装入细口瓶中,盖上瓶塞,贴上标签。
标签应包括药品名称和溶液中溶质的质量分数。
…… …… 余下全文
篇五 :实验一 溶液的配制
实验一 溶液的配制
一、实验目的
1.常用仪器的认知。
2.掌握一般溶液的配制方法和基本操作。
3.熟悉粗配溶液和精确配制溶液的仪器,练习吸量管、容量瓶正确使用方法。
4.巩固电子天平称量操作,练习减量法称量并配制标准NaOH溶液。
二、实验用品
仪器:台式天平、电子天平、烧杯、量筒、容量瓶、吸量管、洗耳球、称量瓶、试剂瓶、胶头滴管、玻璃棒等;
药品:固体药品-NaOH BaCl2(分析纯)
液体药品- HCl(浓)
三、基本操作
称量仪器(量筒、移液管和吸量管、容量瓶)的使用;固体、液体试剂的取用;一定浓度溶液的准确配制。
四、实验步骤
(一)电子天平的使用
1. 称量瓶的准备
称量瓶依次用洗液、自来水、蒸馏水洗干净后,置于洁净的400mL烧杯中将称量瓶盖在斜放在称量瓶口上,盖上表面皿,置于烘箱中。升温至378K,并保持30min。取出烧杯,稍冷片刻后,将称量瓶放入干燥器中,冷至室温后即可使用。
2. 减量法称量(适用于:易吸水、易氧化、易与CO2反应的物质的称量)
①调整并记录天平零点
②分别称出称量瓶、称量瓶盖的质量(m瓶,m盖),再把称量瓶盖盖在称量瓶上,称出总质量,称出总质量(m总),将分别称量的结果相加后(m瓶+m盖)与总质量(m总)进行核对。
③往称量瓶中加入约1g试样,盖上瓶盖,准确称量并记录其质量m1,估计瓶内试样的体积后,从称量瓶内转移0.13~0.15g试样(约原体积的1/7)于烧杯中,称出并记录质量m2。再转移0.13~0.15g试样于烧杯中,称出剩余质量m3,连续两次质量之差,即为该份试样的质量。
3.增量法称量(不吸潮、在空气中稳定存在的粉末或小颗粒)
取洁净小烧杯,准确称量后,将要称量的试样加到小烧杯中。
说明:电子天平使用注意事项
…… …… 余下全文
篇六 :配制一定物质的量浓度的溶液实验报告
配制一定物质的量浓度的溶液实验报告
实验目的
1、练习配制一定物质的量浓度的溶液。
2、加深对物质的量浓度概念的理解。
3、练习容量瓶、胶头滴管的使用方法。
实验重点
1、配制一定物质的量浓度的溶液的操作过程和方法。
2、容量瓶、胶头滴管、托盘天平等的使用方法。
实验用品
烧杯、容量瓶(100mL)、胶头滴管、量筒、玻璃棒、药匙、滤纸、托盘天平、NaCl(s)、蒸馏水。
实验过程
物质的量是化学上的重要物理量,是把宏观物质与微观粒子数联系起来的桥梁。学习配制一定物质的量浓度的溶液,对于学习化学和今后的工作,都有非常重要的意义。
1、 计算 2、称量 3、溶解(稀释) 4、移液 5、洗涤 6、定容 7、摇匀
即:
(1)计算所需溶质的量
(2)称量:固体用托盘天平,液体用量筒(或滴定管/移液管)移取。
(3)溶解或稀释(用玻璃棒搅拌)
(4)移液:把烧杯液体引流入容量瓶(用玻璃棒引流)。
(5)洗涤:洗涤烧杯和玻璃棒2~3次,洗涤液一并移入容量瓶,振荡摇匀。
(6)定容:向容量瓶中注入蒸馏水至距离刻度线2~3 cm处改用胶头滴管滴蒸馏水至溶液凹液面与刻度线正好相切。(要求平视)
(7)盖好瓶塞,反复上下颠倒,摇匀。
容量瓶的使用
1、容量瓶的体积固定,有不同规格(100 mL、250 mL、500 mL、1000 mL等)。
2、使用前须检验容量瓶是否漏水。
3、溶液温度与容量瓶上标定温度一致时,所取液体的体积最标准。
4、溶液液面接近刻度线1 cm~2 cm时,须用胶头滴管加水至刻度线。
配制一定物质的量浓度的溶液时应注意的问题
(1)配制一定物质的量浓度的溶液是将一定质量或体积的溶质按所配溶液的体积在选定的容量瓶中定容,因而不需要计算水的用量。
(2)不能配制任意体积的一定物质的量浓度的溶液。这是因为在配制的过程中是用容量瓶来定容的,而容量瓶的规格又是有限的,常用的有50 mL、100 mL、250 mL、500 mL、和1000 mL等。所以只能配制体积与容量瓶容积相同的一定物质的量浓度的溶液。
…… …… 余下全文
篇七 :配制一定物质的量浓度的溶液实验报告设计
实验报告
【实验一】配制一定物质的量浓度的溶液
一、 实验目的:1、掌握配制一定物质的量浓度的溶液的操作过程和方法。
2、加深对物质的量浓度概念的理解。
3、学会容量瓶、胶头滴管、托盘天平等的使用方法。
4、培养严谨、求实的科学作风。
二、实验准备:1、若某溶液的体积为V,溶质A的物质的量为nA,则该溶液的物质的量浓度CA =
2、在实验室,配制一定物质的量浓度的溶液,可以用固体直接配制,也可以将浓溶液稀释成稀溶液。将浓溶液配制成稀溶液时,常用下面的关系式计算有关的量:
3、用固体直接配制的步骤可简单概括为五步:
…… …… 余下全文

推荐阅读
猜你喜欢
