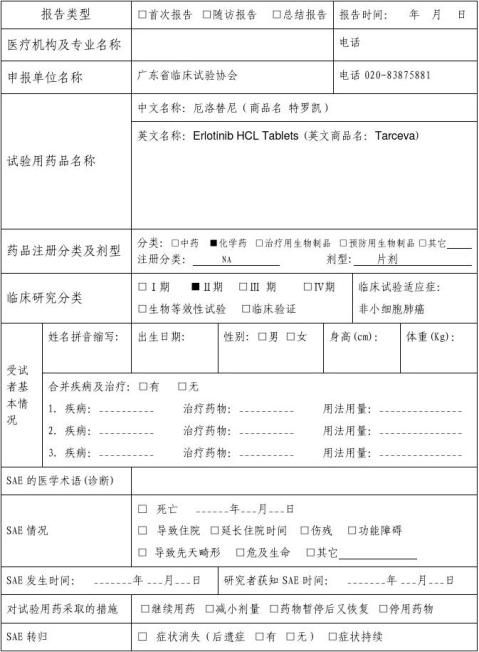
严重不良事件报告表(SAE)
新药临床研究批准文号:NA 编号:
gcp_for001832 ( version 2.0 ) Page 1 of 2
报告单位名称: 报告人职务/职称: 报告人签名: gcp_for001832 ( version 2.0 ) Page 2 of 2

…… …… 余下全文
严重不良事件报告表(SAE)
新药临床研究批准文号:NA 编号:

gcp_for001832 ( version 2.0 ) Page 1 of 2
报告单位名称: 报告人职务/职称: 报告人签名: gcp_for001832 ( version 2.0 ) Page 2 of 2

…… …… 余下全文
药品不良反应/事件报告表
首次报告□ 跟踪报告□ 编码:
报告类型:新的□ 严重□ 一般□
报告单位类别:医疗机构□ 经营企业□ 生产企业□ 个人□ 其他□

严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
…… …… 余下全文
严重不良事件分析报告
新药临床研究批准文号:(请填写临床试验批件号) 编号:(由SAE专员填写)


报告单位名称:(单位名称) 报告人职务/职称:(如实填写) 报告人签名:(首次报告必须由主要研究者签署,如PI不在,必须电话告知,并在报告中说明。)
…… …… 余下全文
