GSP认证内部审核报告
公司经理室:
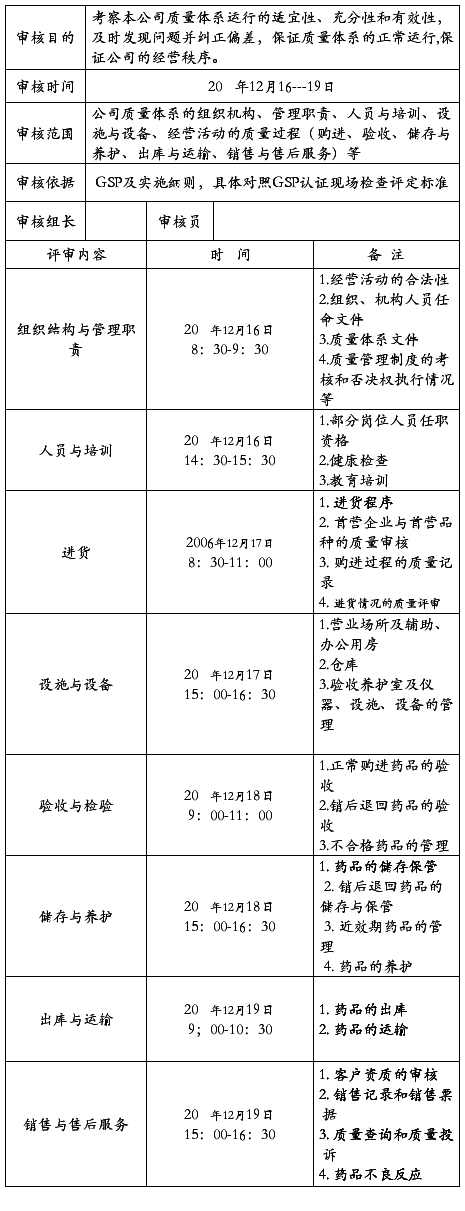
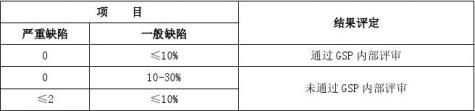
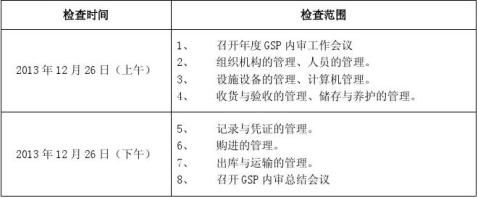
公司内部审核小组在高云飞总经理的领导下,于11月4~6日,对公司业务部、质量管理部、人力资源部、储运部、财务部门进行内部审核。审核依据:药品批发企业GSP认证检查评定标准(试行)。按GSP评定标准132项。无关款项12款,为2210、2301、2601、2602、2804、3302、3507、3512、4108、4203、4402、5101。其余120款,逐款审核。但因我公司未有直调药品,故关于此的4801、5401未检查。共检查118款。
验收养护室已对监视和测量装置中的计量器具等进行了强检。并按要求,做了强检记录。
公司对所有库房都进行了粉刷,修理了5P空调。使阴凉库温度夏季也能控制在20℃以下。达到规定要求。
营业部对生产厂填写不全一项做了严格要求,未填全的,全部补全。
这次检查普遍存在的问题是药品质量档案不够全面。究其原因是仓库对储存超过3个月药品进行了养护检查,并有记录,建立了养护档案,再建质量档案,有些重复。所以各部门建的不多,只是主要销售品种建立了质量档案。不良反应报告检查时因从未接到不良反应报告,因此表格空缺,但我公司半年做过不良反应调查,在审核时未将此部分资料整理附上。已要求各相关部门将该部分资料整理、分析、汇总,达到要求。
审核结论:按药品批发企业GSP认证评定标准审核,我公司符合认证标准要求。
内部审核小组 20xx年11月8日
…… …… 余下全文