7-21 元素周期表和元素周期律
知识点
一、元素周期表
㈠元素周期表的结构:
⒈原子序数与原子结构的关系:_________=_________=___________=___________
⒉排列规则:同族:__________相同,同周期:_____________相同
⒊结构:七主七副七周期,零族Ⅷ族镧錒系 要求能够自己画出元素周期表
注意几点:没有ⅧA或B族,Ⅷ族共有三个族
几种特殊元素的位置:碱金属元素,卤族元素,碱金属元素,过渡元素
序数差问题,各周期的元素数目
㈡元素的性质与原子结构
⒈碱金属元素
注意几点:①相似性:碱金属元素的最外层是一个电子,化合物中的化合价都是正一
和氧气反应(注意产物):LiO2-Na2O2-KO2-RbO2-CsO2
和水反应:2R+2H2O=2ROH+H2(气体符号)
②递变性:从上到下,和水氧气反应越来越剧烈
原因:随着核电荷数的增加,碱金属元素的原子电子层数逐渐增加,原子半径逐渐增大,原子核对最外层电子的吸引力逐渐减弱。
③物理性质的比较:密度?熔沸点?
⒉卤族元素
注意几点: ①物理性质比较:颜色?状态?密度?熔沸点?
②化学性质:
与氢气反应:反应条件的变化?反应程度及生成物的稳定性?H2+X2=2HX
与水反应:H2O+X2 =HX+HXO 注意F2
与氢氧化钠反应(歧化反应):
卤素单质间的置换:
实验1-1 注意现象
3比较金属性:1、与酸和水的反应剧烈程度
2、最高价氧化物的水化物的碱性
3、置换反应
比较非金属性:1、与氢气反应的难易程度
2、生成氢化物的稳定性
3、最高价含氧酸的酸性强弱
4、置换反应
㈢核素
⒈质量数(A)=质子数(Z)+中子数(N)
2、元素、核素、同位素的概念
3、氢元素的同位素:氕H氘D氚T
4、同位素的化学性质相同,物理性质不同
二、元素周期律
(一)原子核的核外电子排布
注意几点:1、电子层数与能量高低
2、表示方法
3、排布规律:(1)能量由低到高,分层排布(2)每个电子层最多容纳的电子数?(3)最外层几个?次外层?倒数第三外层?
(二)原子结构与元素化合价 观察P15表格
1、主族元素的最高正化合价等于它所处的族序数
2、非金属元素的最高正化合价与负化合价的绝对值之和为8
(三)原子半径的比较
1、原子半径的变化规律(惰性元素除外)
2、比较半径:先看电子层数,再看核电荷数
3、同周期阴离子和阳离子?为什么?阴离子之间?阳离子之间?同主 族?
4、Xn+、Y(n+1)+、Z n-、R(n-1)- 有相同电子层结构,比较半径
(四)同周期单质元素比较
Na、Mg、Al 与水反应
与酸反应
碱性
Si、P、S、Cl最高价含氧酸酸性:
与氢气反应的条件:高温,蒸汽加热,加热,光照\点燃
HX稳定性
整个周期比较:电子、氧化还原、最高价氧化物的水化物、与氢气,水,酸反应,半径
三、元素周期表的应用
找农药——非金属 如磷,氮,氯
半导体——锗,硅,硒
催化剂——过渡元素
耐高温,耐高压——ⅢB到ⅥB
【化学基础知识总结3】推断题技巧(1)
含量与物理性质
1、O是地壳中质量分数最大的元素,Si次之,Al是地壳中质量分数最大的金属元素。
2、H是最轻的非金属元素;Li是最轻的金属元素。
3、Na是焰色反应为黄色的元素;K是焰色反应为紫色(透过蓝色的钴玻璃观察)的元素。
4、Si是人工制得纯度最高的元素;C是天然物质中硬度最大的元素。
5、N是气态氢化物最易溶于水的元素;O是氢化物沸点最高的非金属元素。
6、常温下,F、Cl是单质具有有色气体的元素。
7、C是形成化合物种类最多的、最高价氧化物的含量增加会导致“温室效应”的元素。
8、Cl是单质最易液化的气体、最高价氧化物的水化物酸性最强的元素。
化学性质与用途
1、F是单质与水反应最剧烈的非金属元素。
2、S是气态氢化物与其低价氧化物能反应生成该元素的元素。
3、P是在空气中能自燃的元素。
4、F是气态氢化物的水溶液可以雕刻玻璃的元素。
5、Mg是既能在CO2中燃烧,又能在N2中燃烧的金属单质。
6、Li、Na、F的单质在常温下与水反应放出气体的短周期元素。
10电子微粒组
1、原子Ne
2、分子CH4、NH3、H2O、HF
3、阳离子Na+、Mg2+、Al3+、 、H3O+
、H3O+
4、阴离子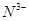 、
、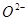 、
、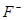 、
、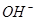
18电子微粒组
1、原子Ar
2、分子SiH4、PH3、H2S、HCl、F2、H2O
3、阳离子K+、Ca2+、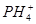
4、阴离子P3—、S2—、HS—、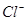 、
、
5、特殊情况:F2、H2O2、C2H6、CH3OH、CH3F
同族的上下周期元素原子序数之间的关系
1、二、三周期的同族元素原子序数之差为8。
2、三、四周期的同族元素原子序数之差为8或18,ⅠA、ⅡA为8,其他族为18。
3、四、五周期的同族元素原子序数之差为18。
4、五、六周期的同族元素原子序数之差为18或32。
5、六、七周期的同族元素原子序数之差为32。
特征现象
1.焰色反应:Na+(黄色)、K+(紫色)
2.浅黄色固体:S或Na2O2或AgBr或FeS2
3.使品红溶液褪色的气体:SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)
4.有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、 (紫色)
(紫色)
有色固体:红色(Cu、Cu2O、Fe2O3)、红褐色[Fe(OH)3]
蓝色[Cu(OH)2] 黑色(CuO、FeO、FeS、CuS、Ag2S、PbS)
黄色(AgI、Ag3PO4) 白色[Fe(0H)2、CaCO3、BaSO4、AgCl、BaSO3]
有色气体:Cl2(黄绿色)、NO2(红棕色)
5.特征反应现象: Fe(OH)2------>Fe(OH)3,白色到灰绿到红褐色
第二篇:高一化学必修2《元素周期表》知识点总结
知识回顾: 1、 原子的结构:
? ? ?
原子是由原子核和电子组成;原子核由质子和中子组成
原子的质量集中在原子核上,电子的质量很小,几乎可以忽略不计
一个质子带一个单位的正电荷,一个电子带一个单位的负电荷,中子不带电,所以
原子对外显中性 2、 元素的定义:
具有相同核电荷数(质子数)的一类原子的总称
一、元素周期表的结构 1、原子序数
原子序数=核电荷数=质子数=核外电子数 2、周期
? 按原子序数递增的顺序,把电子层数相同的元素自左向右排成横行,每行叫做一个
周期。
? 元素周期表共有七个周期,从上到下依次命名为第一周期、第二周期等
3、族
? 按电子层数递增的顺序,把不同横行中最外层电子数相同的元素由上而下排成纵行,
每一个纵行称为一个族.共18行
? 元素周期表共有十八个纵行,除8、9、10三个纵行叫第Ⅷ族外,其余每个纵行各为
一个族,它们又被划分为十六个族。
? 族分为主族和副族,主族用罗马数字加“A”表示,如ⅠA族;副族用罗马数字加”B”
来表示,如ⅡB。0族和Ⅷ族则不加“A”或“B”
各族内的信息如下表
注意:① 1,2行对应为ⅠA,ⅡA;13---17行对应为ⅢA---ⅦA ② 3---7行对应为ⅢB ---ⅦB;11,12行对应为ⅠB,ⅡB。
③ 8,9,10对应为Ⅷ
④ 18行对应0族 二、元素的性质与原子结构 1、碱金属元素
知识回顾:Na的物理性质和化学性质
? 从上到下原子的电子层数在增加,原子半径逐渐增大,所以失电子的能力逐渐增强 ? 从上到下金属性逐渐增强(金属性包括 ? 碱金属元素的化学性质
R+2H2O====2ROH+H2 4Li+O2====2Li2O
4Na+O2====2Na2O(缓慢氧化) Na+O2==△===Na2O2
碱金属的主要物理性质
2、卤族元素
卤族元素的主要物理性质
? 从上到下电子层数依次增加,原子半径依次增加,所以得电子的能力也依次减弱,
即非金属性依次减弱(非金属性包括
? 单质溴是唯一在常温常压下呈液态的非金属单质 ? 卤素的化学性质
X+Ag======AgX↓(AgCl为白色沉淀,AgBr为淡黄色沉淀,AgI为黄色沉淀) X2+H2O=====HX+HXO F2+H2O=====HF+O2 Fe+Cl2=====2FeCl3 Fe+I2=====FeI2
三、核素 1、质量数
将原子核内所有质子和中子的相对质量取近似整数值相加,所得到的数值叫质量数 质量数(A)=质子数(Z)+中子数(N) 2、核素
具有一定数目质子和一定数目中子的一种原子叫做核素
如下表所示
-+
3、同位素
? 质子数相同而中子数不同的同一元素的不同原子互为同位素
? 当某种元素具有两种或两种以上天然、稳定的同位素时,无论是在单质还是在化
合物里,任意一种同位素在该元素内所占的原子数目百分比都不变
4、同素异形体
指同种元素形成的不同单质,它们之间互称为同素异性体。
