《第四章 第四节金属的电化学腐蚀与防护》教学反思
海南华侨中学高二化学组 李冰心 一、课题名称:第四节金属的电化学腐蚀与防护
二、时 间:2012-11-26
地 点:高二(16)班
参加人员:高二备课组全体人员
本节课通过情境导学法,实验探究法,利用多媒体辅助教学等方式,让学生了解金属腐蚀的原理和危害。通过学习明确金属腐蚀的本质及电化学腐蚀的原理,培养学生节约资源,爱护环境的意识;加深学生对化学与生活密切关系的认识,激发学生的学习兴趣,促进学生科学素养的全面提高。
《金属的电化学腐蚀与防护》选自人教版高中化学选修4《化学反应原理》
第四章第四节。此节内容分《金属的电化学腐蚀》和《金属的电化学防护》两个课时进行,本教学设计针对第一课时《金属的电化学腐蚀》设计。
金属的腐蚀是生活中比较常见的现象,同时也是一个世界性的异常棘手的科技难题。通过让学生提前上网、进图书馆查阅资料图片,培养学生化学信息的收集、整理、分析运用能力。同时,金属的电化学腐蚀可用实验探究法进行教学,形成直观印象,更有利于学生理解知识。在教学难点“析氢腐蚀与吸氧腐蚀”上,充分利用多媒体的优势,用动画演示突破难点。
本节课符合新课标理念,让学生自主探究,解决金属腐蚀的相关问题,独立思考与小组讨论相结合,培养学生的思维能力和合作意识。以实验探究法和多媒体演示法为主线,更能体现以学生为主体的新课标思想。让学生对金属的化学腐蚀和电化学腐蚀有了直观的认识。学生总体反应都不错,但是,本课知识点相对集中,学生基础差的学习有一定困难;同时上课的内容可能多了点,难免上起来有些地方稍微赶了点,体现在练习时间赶了点,以致只能匆匆结尾。以后课件设计时要多考虑学生的总体情况,尽量做到合理而不匆忙。
第二篇:选修四新学案:第四章第四节 金属的电化学腐蚀与防护
第四节 金属的电化学腐蚀与防护
【学习目标】
1、会解释金属发生电化学腐蚀的原因,认识金属腐蚀的危害,知道防护金属腐蚀的方法。
2、通过学习增强保护环境的意识,节约意识。
【自学导引】
一、金属腐蚀
1、金属腐蚀:____________________________________________
2、金属腐蚀的本质:_________________________________________
3、金属腐蚀的类型:


1、牺牲阳极的阴极保护法
原理:形成原电池反应时,让被保护金属做____极,不反应,起到保护作用;而活泼金属反应受到腐蚀。
2、外加电流法
原理:将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为_____极,在外加直流电的作用下使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。
3、金属防护的几种重要方法
①在金属表面覆盖保护层。
②改变金属内部的组织结构,制成____________。
③电化学保护法,即将金属作为原电池的_____极或电解池的_______极而受到保护。
【典例剖析】
1
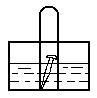
例1:如图, 水槽中试管内有一枚铁钉,放置数天观察:
(1)若液面上升,则溶液呈_____性,发生_____腐蚀,电极反应式为:
负极:__________________________,正极:
_________________________________
总反应_____________________________________
(2)若液面下降,则溶液呈______性,发生_____腐蚀,电极反应式为:负极:____________________________________,正极:___________________________________ 。 解析:本题考查了吸氧腐蚀和析氢腐蚀。由腐蚀的现象不难判断,(1)液面上升说明气体减少,为吸氧腐蚀。(2)液面下降说明气体增加,为析氢腐蚀。答案(1)酸性很弱或中性、吸氧 负极(Fe):2Fe—4e—=2Fe2+ 正极(C):O2+2H2O+4e—=4OH—
总反应:2Fe+ O2+2H2O=2Fe(OH)2
(2)酸性,析氢 负极(Fe):Fe—2e—=Fe2+ 正极(C):2H++2e—=H2↑
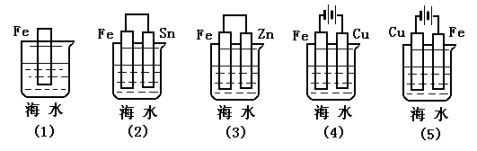
例2:下列各情况,在其中Fe片腐蚀由快到慢的顺序是
解析:本题考查了原电池原理和电解池原理。铁片作电解池的阳极腐蚀最快,其次是原电池的负极,然后是自然腐蚀,原电池的正极受保护,电解池的阴极受保护,但是电的作用下保护更强。答案:⑸⑵⑴⑶⑷
【针对练习】
1、20xx年5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首,普通铜器时间稍久容易出现铜绿,其主要成分是
[Cu2(OH)2CO3]这三件1760年铜铸的国宝在240 年后看上去仍然熠熠生辉不生锈,下列对起原因的分析,最可能的是( )
A、它们的表面都电镀上了一层耐腐蚀的黄金;
B、环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去;
C、铜的金属活动性比氢小,因此不宜被氧化;
D、它们是含一定比例金、银、锡、锌的合金;
2、 如图所示,烧杯中都盛有稀硫酸。
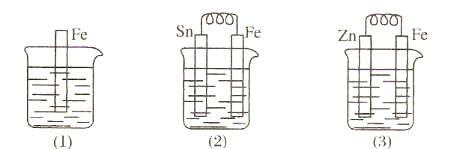
(1)中反应的离子方程式为_____________________。
(2)中反应的电极反应:Fe:_____________________,Sn:_____________________,Sn极附近溶液的pH___________(填“增大”、“减小”或“不变”)。
2
(3)中被腐蚀的金属是___________,其电极反应式为_____________________。比较图(1)
(2)(3)中纯铁被腐蚀的速率由快到慢的顺序是_____________________。
【当堂达标】
1. 下列叙述不正确的是( )
A. 金属的电化腐蚀比化学腐蚀普遍 B. 钢铁在干燥空气里不易腐蚀
C. 用铝质铆钉接铁板,铁板易被腐蚀 D. 原电池电路中电子由负极流入正极
2. 以下现象与电化学腐蚀无关的是( )
A. 黄铜(铜锌合金)制作的锣不易产生铜绿
B. 生铁比纯铁容易生锈
C. 铁质配件附有铜质配件,在接触处易生铁锈
D. 银质物品久置表面变暗
3. 下列不能用于金属防腐处理的是( )
A. 涂油漆 B. 改变金属内部结构
C. 镀上一层耐腐蚀的金属 D. 在海轮的船体上镶铜块
4. 下列防腐措施中,利用原电池反应使主要金属得到保护的是( )
A. 用氧化剂使金属表面生成致密稳定的氧化物保护膜
B. 在金属中加入一些铬或镍制成合金
C. 在轮船的壳体水线以下部分装上锌锭
D. 金属表面喷漆
5. 为了防止轮船体的腐蚀,应在船壳水线以下位置嵌上一定数量的( )
A. 铜块 B. 铅块 C. 锌块 D. 钠块
6.下列有关金属腐蚀与防护的说法正确的是( )
A. 纯银器表面在空气中因化学腐蚀渐渐变暗
B. 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D. 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
7. 钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 == 2Fe2++4OH-。以下说法正确的是( )
A. 负极发生的反应为:Fe-2e- === Fe2+
B. 正极发生的反应为:2H2O+O2+2e- === 4OH
C. 原电池是将电能转变为化学能的装置
D. 钢柱在水下部分比在空气与水交界处更容易腐蚀
8.下列叙述正确的是( )
A. 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B. 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C. 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH
D. 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
9. 分别放置在下图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是( ) -
3

10. 将金属A和金属B分别放入稀H2SO4中有氢气生成。若将金属A和金属B相连后投入稀H2SO4中发现A被腐蚀,B未被腐蚀。关于A、B的叙述正确的是( )
A. 金属活动性A>B B. 还原性 B>A
C. 在后者装置中金属A发生还原反应,金属B发生氧化反应
D. 金属A表面有明显气泡产生,金属B表面无明显现象
11. 切过咸菜的钢刀未及时清洗,第二天刀上便出现锈斑,试用有关电极反应式、化学方程式表示Fe(OH)3的生成过程。
(1)负极______________________;正极______________________。
(2)化学方程式______________________、______________________。
参考答案
针对练习1、D 2、(1)Fe+2H+==Fe2++H2↑
(2)Fe-2e- === Fe2+ 2H++2e-==H2↑ 增大
(3) (2)>(1)>(3)
当堂达标:1. C 2. D 3. D 4. C 5. C 6. AC 7 A 8 C 9 D10. A
11 .(1)2Fe – 4e - == 2Fe2+ O2 +2H2O + 4 e - ==4OH-
(2)2Fe+2H2O+ O2 ==2 Fe(OH)2 4Fe(OH)2 + O2 +2H2O== 4 Fe(OH)3
4
