选修4 第四章 第一节《原电池》教学反思
本节课是人们教育出版社普通高中课程标准实验教科书选修4《化学反应原理》第四章第一节的内容,主要研究化学能与电能之间的一种转换装置——原电池。学习本节课知识,让体验化学能与电能相互转化的探究过程;使学生进一步了解原电池的工作原理和构成原电池的条件;能够写出电极反应式和电池反应方程式。通过分组实验培养学生观察能力与分析思维能力。通过实验引导学生以问题为中心的学习方法。学会发现问题、解决问题的方法。加深理解实践→认识→再实践→再认识的辨证唯物主义的思维方法。通过现实分析激发学生的学习兴趣与投身科学追求真理的积极情感。体验科学探究的艰辛与愉悦,增强为人类的文明进步学习化学的责任感和使命感。
本节课的教学设计,在好的方面,我认为有以下四个特点:
一、目标定位,全面、合理、科学。
依据课程标准要求和原电池在化学选修4中的地位及作用,我本着全面、全员、全程的育人宗旨,力求实现通过化学教学,促使学生学会“从知识与技能、过程与方法、情感态度与价值观”三个维度确定本节课教学目标,即通过本节课的教学使学生了解原电池的组成及工作原理,能写出电极反应和电池反应方程式,在原有知识的基础上进一步改进原电池。
通过探究实验培养学生观察能力与分析问题的能力,并体会化学能与电能的相互转化过程,通过反应物之间电子的转移的回顾,理解原电池的形成是氧化还原反应的本质的拓展和运用;通过探究实验活
动,培养学生自主探索创新精神和同学间的交流合作学习的协作精神,并通过实验不断体现出由实践→认识→再实践→再认识的认知过程,通过原电池的探究实验,体验科学探究的艰辛与愉悦,增强为人类的文明进步学习化学的责任感和使命感,同时激发学生的学习兴趣与投身科学追求真理的积极情感。
二、教学策略 引导学生探究式学习
原电池在高一化学必修2已经初步学习过,本节课是其知识的延续和加深,所以重点在于如何改进原电池。在课前的微视频中,我用很少的时间去帮助学生回忆原电池的知识,然后开展探究性实验将学生分成四组,通过提供材料,让学生设计实验,本节课以实验事实设疑,又以实验事实释疑,让学生从直观、生动的实验中发现问题,找到学生的知识生长点,进一步引导学生进行推理和分析,再通过实验验证分析的结果,从而展开教学,学生在活动中主动建构知识结构,丰富对电化学的认识。
三、教学资源
发挥媒体辅助功能,本课时多媒体课件制作精美,给人以美的享受,借助现代媒体生动直观地展开原电池原理,并利用多媒体的微观动画演示了双液原电池中盐桥的作用,有利于学生突破原电池原理这一教学难点。
四、教学流程的安排
为了更有效地突出重点,突破难点,遵循“教师为主导、学生为主体、问题为主线、思维为核心、能力为根本”的五为主原则,我将
教学过程设计为按一定梯次递进的活动序列,力求最大限度地体现:设计问题化,过程活动化,活动练习化,练习要点化,要点目标化,目标课标化的课程要求。从学生感兴趣的生活中的实例入手,以活动为载体,以问题为主线,引导学生在实践中观察,在观察中思考,在思考中探索,在探索中发现,在发现中收获,在收获中创新,在创新中升华。
本节课按照设计思想基本达成目标,但教学过程中还存在以下困惑:
1、整节课节奏较快,时间把握不适度,仔细回想课堂时间是有限的,一些没有必要的环节可以删去。比如说,课件上有的文字不必在黑板上板书。
2、学生在进行探究实验后,应该把学生的实验报告收上来给予点评,肯定学生的学习成果。
3、本节课由于是分组实验,有一个小组实验现象不明显,电流表指针不偏转,究其原因是盐桥制作不合格。在以后的实验课之前应做好充分的准备。
4、类似于这种探究实验课,将学生分组讨论、探究固然能激发学生的学习兴趣,但是课堂秩序较难维持,时间较难把握,应该在课前做好缜密的计划。
以上是我上完这节课的所思所想,不到之处请各位同仁指正,共同探讨符合新课程的教学方法,理解新课程的教学理念。互相学习,共同进步。
第二篇:第四章_第一节原电池选修4
第四章 第一节原电池 第二节化学电源同步练习题
第四章 电化学基础
第一节原电池(1)
1.下列关于原电池的叙述中,正确的是 ( )
A. 原电池中,正极就是阳极,负极就是阴极
B. 形成原电池时,在负极上发生氧化反应
C. 原电池工作时,溶液中的阳离子向负极移动
D. 电子从负极流向正极
2.下列关于原电池的叙述正确的是 ( )
A. 构成原电池的正极和负极必须是两种不同的金属
B. 原电池是化学能转变为电能的装置
C. 在原电池中,电子流出的一极是负极,该电极被还原
D. 原电池放电时,电流的方向是从负极到正极
3.在用Zn、Cu片和稀H2SO4组成的原电池装置中,经过一段时间工作后,下列说法
中正确的是 ( )
A.
B.
C.
D. 锌片是正极,铜片上有气泡产生 电流方向是从锌片流向铜片 溶液中H2SO4 的物质的量减少
电解液的PH保持不变
4.一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是 ( )
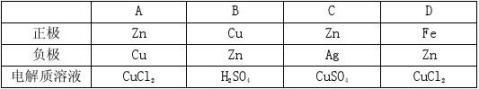
5.以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是 ( )
A. Mg片作负极,电极反应:Mg-2e-=Mg2+
B. Al片作负极,电极反应:Al+4OH--3e-=AlO2-+2H2O
C. 电子从Mg电极沿导线流向Al电极
D. Mg片上有气泡产生
6.下列事实能说明Al的金属活动性比Cu强的是 ( )
A. 常温下将铝和铜用导线连接组成原电池放入到氢氧化钠溶液中
B. 常温下将铝和铜用导线连接组成原电池放入到稀盐酸溶液中
C. 与氯气反应时,铝失去3个电子,而铜失去2个电子
D. 常温下,铝在浓硝酸中钝化而铜不发生钝化
1
7.有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为( )
A、A﹥B﹥E﹥D B、A﹥B﹥D﹥E
C、D﹥E﹥A﹥B D、D﹥A﹥B﹥E
8.原电池的正负极的判断:
①由组成原电池的两极材料判断。一般是 的金属为负极,活泼性 的金属或能 的非金属为正极。
②根据电流方向或电子流动方向判断。电流是由 流向 ;电子流动方向是由 极流向 极。
③根据原电池里电解质溶液内离子的定向流动方向。在原电池的电解质溶液内,阳离子移向的极是 极,阴离子移向的极为 极。
④根据原电池两极发生的变化来判断。原电池的负极总是 电子发生氧化反应,其正极总是 电子发生 反应。
9.从能量转化角度看,原电池是一种由______的装置.例如由银锌组成的原电池,银为______极,发生______反应,电子从______极流向______极.
10.近年我国首创以Al──空气──海水为能源的新型电池,以海水为电解液.靠空气中的氧使铝不断氧化而产生电流.其工作时电极总反应式为:4Al + 3O2 + 6H2O = 4Al(OH)3;请判断:
(1)原电池的负极是______;
(2)工作时原电池的两极反应:A.负极______ ;B.正极______ ;
(3)工作时原电池正极附近pH______(增大,减小,不变).
11.下列事实不能用电化学理论解释的是______
①轮船水线以下的船壳上镶嵌有一定量的锌块
②镀锌的铁制品比镀锡的铁制品耐用
③铝片不用特殊方法保存
④常温下铝跟稀硫酸快速反应,跟浓硫酸几乎不反应
12.如下图所示,烧杯中都盛有稀硫酸。
(1)中反应的离子方程式为 ,
(2)中的电极反应:Fe: 、Sn:
Sn极附近溶液的pH(填增大、减小或不变)
(3)中被腐蚀的金属是 、其电极反应式为 ,
。 比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是
2
第一节原电池(2)
1、有A、B、C、D四种金属。将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀。将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈。将铜浸入B的盐溶液中,无明显变化。如果把铜浸入C的盐溶液中,有金属C析出。据此判断它们的活动性由强到弱的顺序是 ( )
A. DCAB B. DABC C. DBAC D.BADC
2、将锌片和铜片用导线连接置于同一稀硫酸溶液中,下列各叙述正确的是
( )
A. 正极附近SO4的浓度逐渐增大 B.负极附近SO4的浓度逐渐减小
C.负极附近SO42- 的浓度逐渐增大 D.正负极附近SO42-的浓度基本不变
3、某原电池总反应的离子方程式为:2Fe3++Fe=3Fe2+,不能实现该反应的原电池是 ( )
A. 正极为Cu,负极为Fe,电解质为FeCl3溶液
B. 正极为C,负极为Fe,电解质为Fe(NO3)3溶液
C. 正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液
D. 正极为Ag,负极为Fe,电解质为CuSO4 溶液
4、银锌电池广泛用做各种电子仪器的电源,它的电池反应是:Zn+Ag2O+H2O=2Ag
+Zn(OH)2,则负极上发生反应的物质是 ( )
A. Ag B. Zn(OH)2 C. Ag2O D. Zn
5、将等质量的两份锌粉a和b,分别加入两个盛过量的稀硫酸的烧杯中,并向加入a的烧杯中再加入少量CuO粉末。下列各图表示氢气体积V(H2)与反应时间t的关
系,其中正确的是
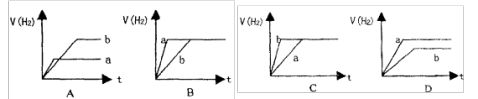
( ) 2-2-
6、对于锌-铜-稀H2SO4组成的原电池装置中,当导线中有1mol电子通过时,理论
上的电极变化 ( )
3
①锌片溶解了32.5g ②锌片增重32.5g ③铜片上析出了1g H2 ④铜片上析出
1molH2
A. ①③ B. ①④ C ②③ D. ②④
7、根据下列事实,判断离子的氧化性顺序为①A+B2+===A2++B②D+2H2O===D(OH)2+H2↑ ③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+ ( )
A.D>A>B>E B.D>E>A>B
C.E2+>B2+>A2+>D2+ D.A2+>B2+>D2+>E2+
8、市场上出售的“热敷袋”,其主要成分是铁屑、碳粉、木屑与少量氯化钠、水等。它在使用之前需用塑料袋与空气隔绝。使用时启开塑料袋上的气孔,轻轻揉搓就会放出热量来。当使用完后还会发现有铁锈生成。依上述现象回答:
(1) “热敷袋”放出的热量的利用是利用铁发生 反应放出的热量。
(2) 碳粉的主要作用是
(3) 加入氯化钠的作用是
(4)试写出上述变化过程中的电极反应式方程式:
负极: 。
正极: 。
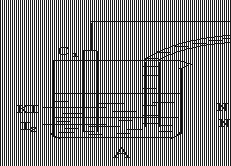
9、已知可逆反应:
AsO43-+2I-+2H+AsO33-+I2+H2O
据此设计出如右图所示的实验装置(装置
中盐桥的作用是使整个装置形成一个闭合
回路).进行如下操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现
微安表指针偏转;
(Ⅱ)若改向(B)烧杯中滴加40% NaOH溶液,
发现微安表指针向前述相反方向偏转.
试回答下列问题:
(1)两次操作过程中微安表指针为什么会
发生偏转?
(2)两次操作过程中指针偏转方向为什么相反?
(3)(Ⅰ)操作过程中,C1棒发生的反应为_______________.
(4)(Ⅱ)操作过程中,C2棒发生的反应为_______________.
10、利用反应Zn +2FeCl3=ZnCl2+2FeCl2,设计一个原电池,在下面画出实验装
置图:
4 2+2+2+2+ 2+2+2+2+
并指出正极为 ,电极反应式 ; 负极为 电极反应式为 。
第二节 化学电源(1)
1.日常所用的干电池的电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2氧化吸收H2), 电极反应可简化为:Zn-2e-==Zn2+;2NH4++2e- =NH3+H2,根据上述叙述判断下列说法正确的是 ( ) A. 干电池中锌为正极,碳为负极
B. 干电池工作时,电子由锌极经外电路流向碳极
C. 干电池长时间连续工作时,内装糊状物可能流出腐蚀用电器
D. 干电池可实现化学能向电能的转化和电能向化学能的转化 2.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是 ( ) A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品 D.回收其中石墨电极
3.据报到,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量大,而且没有铅污染。其电池反应为:2Zn+O2=2ZnO原料为锌粒,电解液和空气。下列叙述正确的是 ( ) A. 锌为正极,空气进入负极反应 B. 负极反应为Zn-2e-=Zn2+ C. 正极发生氧化反应
D. 电解液肯定不是强酸
4.碱性电池具有容量大、放电电流大的特点,因此得到广泛应用。锌锰电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2 MnO2(s)+H2O(l)=Zn(OH)2+Mn2O3 (s)。下列说法错误的是 ( ) A. 电池工作时,锌失去电子
B. 电池负极的电极反应式为Zn-2e-+2 OH-=Zn(OH)2 C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g 5.锰锌干电池在放电时总反应方程式可以表示为:
Zn(s)+2MnO2+2NH4+=Zn2++Mn2O3(s)+2NH3+H2O
在此电池放电时正极(碳棒)上发生反应的物质是 ( ) A. Zn B. 碳 C. MnO2和NH4
+
D. Zn和NH3
5
6.锌银电池广泛用作各种电子仪器的电源,它的充放电过程可以表示为:
充电
2Ag+Zn(OH)2======Ag2O+Zn+H2O
放电
此电池放电时,被氧化的物质是 ( ) A. Ag B. Zn(OH)2 C. Ag2O D. Zn 7.微型锂碘电池可用植入某些心脏病人体内的心脏起搏器所用的电源。这种电池中的电解质是固体电解质LiI,其中的导电离子是I-。下列有关说法正确的是( ) A.正极反应:2Li-2e==2Li+ B.负极反应:I2+2e-=2I- C.总反应是:2Li+I2=2LiI D.金属锂作正极
8.锌银电池:负极是 ,正极是 ,电解质是 ,其电极反应如下:
负极: , 正极: ,
总反应:
9.锂电池是用金属 作负极, 作正极,电解质溶液由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中组成。
负极: 正极:3 SOCl2+8e-=SO32-+2S+6Cl-
电池的总反应式:8Li+3 SOCl2=6 Li Cl+Li2 SO3+2S 10.锌锰干电池是用锌制圆筒形外壳作 极。位于中央的顶端盖有铜帽的石墨作 极,在石墨周围填充 作电解质,还填有MnO2和炭黑。其电极反应为: 负极: 正极: +2e-+2 MnO2=Mn2O3+2NH3↑+H2O
电池总反应式为:Zn+2NH4++2 MnO2=Mn2O3+2NH3↑+Zn2++H2O 该电池用久了,其外壳就会变软,主要原因是
正极反应中,前后经历下列反应:2NH4++2e-=2NH3+H2;2MnO2+H2=Mn2O3+H2O,如果没有MnO2参与,干电池将难于持续稳定工作。
试说明理由:_________________________________________________。
许多国家都规定要对废旧的锌锰干电池进行回收,从保护环境和节约材料方面解释为什么要回收这种废旧电池。
11.银器皿日久表逐渐变成黑色,这是由于生成了Ag2S,有人设计了用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中与容器接触,放置一段时间,黑色就会褪去而不会损失。
试回答:在此原电池反应中,负极发生的反应为:__________________,正极反应为:____________________,反应过程中产生臭鸡蛋气味的气体,则原电池总反应
6
方程式为:_____________________________________。
第二节 化学电源(2)
1.下列说法不正确的是 ( )
A.原电池中,负极上发生的反应是氧化反应
B.原电池中,电流从负极流向正极
C. 铜锌原电池中放电时,溶液中的阴离子向负极移动,阳离子向正极移动
D.碱性锰锌电池是一次电池,铅蓄电池是二次电池
2.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢
镍电池的总反应式是
根据此反应式判断,下列叙述中正确的是 ( )
A、放电时,电池负极周围溶液的pH不断增大 B、电池放电时,镍元素被氧化
C、电池充电时,氢元素被还原
3.铅蓄电池放电时发生下列反应
2--D、电池放电时,H2是负极 负极:Pb+SO4-2e=PbSO4
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
使用该电池电解CuSO4溶液,当有纯铜1.6g析出时,铅蓄电池内消耗硫酸物质的
量为 ( )
A. 0.05mol B. 0.025mol C. 0.25mol D. 0.1mol
4.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时的反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,下列结论正确的是( )
A.Pb为正极被氧化 B.溶液的pH不断减小
C.SO2?
4只向PbO2处移动 D.电解质溶液pH不断增大
Zn2++2Br-。下列各反5.锌、溴蓄电池的充、放电的电池总反应为Zn+Br2

应①Zn-2e-====Zn2+ ②Br2+2e-====2Br- ③2Br--2e-====Br2 ④Zn2++2e-
====Zn,其中充电时的阳极和放电时负极的反应分别是 ( )
A.①② B.③① C.④② D.③②
6.目前人们正研究开发一种高能电池一—钠硫电池,它是以熔融的钠、硫为两极,
,以Na+ 导电的β,——Al2O3陶瓷作固体电解质,反应如下:2Na+xS Na2Sx,
以下说法,正确的是 ( )
A.放电时,钠作正极,硫作负极
B.放电时,钠极发生还原反应
C.充电时,钠极与外电源正极相连,硫极与外电源的负极相连

7
D.充电时,阳极发生的反应是Sx -2e= Sx
7.铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。
放电时该电池总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O
根据上述情况判断:
(1)蓄电池的负极材料是
(2)放电时,正极反应为
(3)放电时电解质溶液的PH (填“增大”“减小”或“不变”)
(4)放电时,电解质溶液中阴离子移向 极
(5)放电时电流方向从 极流向 极
(6)铅蓄电池充电时电极反应:
阳极: +2 H2O-2e-=PbO2+4H++SO42-( )
阴极:PbSO4+2e-=Pb+SO42-( )
充电时总反应:2 PbSO4+2 H2O=
可把上述反应写成一个可逆反应方程式:
放电
Pb+PbO2+2 H2SO4====2 PbSO4+2 H2O 充电
8.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉电(Ni-Cd)电池,其电池总反应可以表示为:
充电 Cd+2NiO(OH)+2 HO======2Ni(OH)+Cd(OH) 2222--
放电
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是( )
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A. ①③ B. ②④ C. ①④ D. ②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使
一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重,这是因为
(3)下图是废弃镍镉电池中的重金属渗入水体后,进入人体的一条途径:
生物体D中重金属浓度 (“大于”“等于”“小于”)生物体A中重金属浓度,
这是通过食物链 作用所引起的。除上述途径外,被污染水体中的重金属还可
以直接通过 (途径)进入人体。
第二节 化学电源(3)
1.燃料电池是一种新型电池,它主要是利用燃料在燃烧过程中把化学能直接转化为
电能.氢氧燃料电池的基本反应是:
8
X极:
12
O2(g)+H2O(l)+2e==2OH
-
-
--
Y极:H2(g)+2OH==2H2O(l)+2e
下列判断正确的是 ( ) A.X是正极 B.Y是正极
C.Y极发生还原反应 D.Y极发生氧化反应
2.阿波罗号宇宙飞船上使用的氢氧燃料电池,其电池反应为:2H2+O2=2H2O ,电 解质溶液为KOH溶液,反应保持在较高温度,使H2O蒸发,则下列叙述中正确的是( ) A.此电池能发生蓝色火焰 B.H2为正极,O2为负极 C.工作时,电解质溶液的PH不断减小
D.电极反应为负极:2H2+4 OH――4e-=4 H2O;正极:O2+2 H2O+4e-=4 OH- 3.物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成型的生物原电池,下列有关判断正确的是 ( )
--
A.正极的电极反应可能是O2+ 4e+ 2H2O→4OH B.负极的电极反应可能是O2+ 4e-+ 2H2O→4OH-
-
C.负极的反应主要是C6H12O6(葡萄糖)生成CO2或HCO3 D.正极的反应主要是C6H12O6(葡萄糖)生成CO2或HCO3-
4.设想通过原电池反应以H2和Cl2为原料生产盐酸。关于这种原电池的设想正确的是 ( )
A.正极反应为H2-2e-=2H+ B.在电池工作时,H+移向负极 C.电池正极发生氧化反应
D.以盐酸作为电解质,并不断补充蒸馏水,以维持溶液一定的pH
5.一种新型燃料电池,一极通入空气,另一极通入丁烷气体,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料的说法正确的是 ( ) A. 在熔融电解质中,O由负极移向正极
B. 电池的总反应是:2C4H10+13O2→8CO2+10H2O
C. 通入空气的一极是正极,电极反应为:O2+4e-=2O2-
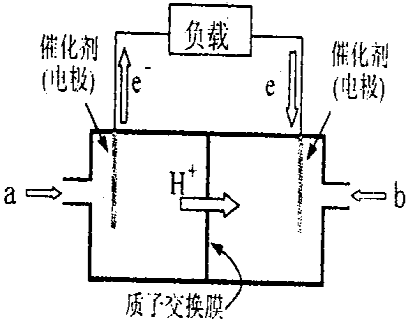
D. 通入丁烷的一极是正极,电极反应为:C4H10 +26 e-+13 O2-=4 CO2 ↑+5 H2O 6.右图是20xx年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH30H+302→2C02+4H20。下列说法正确的是( )
A.左电极为电池的负极,a处通入的物质是甲醇
B.右电极为电池的负极,b处通入的物质是空气
C.负极反应式为:CH30H+H20-6e-→CO2+6H+ D.正极反应式为:02+2H20+4e-→40H—
9
2-
7.氢氧燃料电池是一种高效、低污染的新型电池,主要用于航天领域。它的电极材
料一般为活性电极,具有很强的催化活性,如铂电极、活性炭电极等。该电池 为燃料, 为氧化剂,可用 性电解质(如稀H2SO4),也可用 性
电解质(如 )。当用酸性电解质时,电极反应为:负极:
正极:
总反应式:
当用碱性电解质时,电极反应式为:
负极:
正极:
电池总反应式:2H2+O2=2 H2O
8.甲烷-氧气燃料电池,该电池用金属铂片插入KOH溶液中作电极,在两极上分别
通甲烷和氧气。
负极:
正极:
电池总反应式:
9.据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电
解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1
个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
(1)该电池反应的总离子方程式为____________________________
(2)甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____(填
降低或上升、不变);
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极
通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2
(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)
代表汽油。
①电池的正极反应式为__________________________________。
②放电时固体电解质里的O2-离子的移动方向是向____________极移动(填正或负)。
10
[参考答案] http://www.DearEDU.com
第一节原电池(1)
1BD 2B 3C 4D 5BD 6B 7D
8.(1)活泼,较弱,导电(2)正极,负极;负极,正极
9.化学能转变为电能;正;还原;锌,银.
10.(1)Al,
(2)Al-3e=Al3+;O2+2H2O+4e=4OH-
(3)增大
11.③④
12.(1)Fe + 2H+ = Fe2+ + H2↑
(2)Fe + 2e- = Fe2+ 2H+ + 2e- = H2↑ 增大
(3) Zn,Zn + 2e- = Zn2+ 2 1 3
第一节原电池(2)
1B 2C 3CD 4D 5A 7C
8(1)氧化(2)与铁、氯化钠溶液构成原电池,炭作电池的正极,从而加速铁的氧化
(3)氯化钠溶于水形成电解质溶液
(4)负极:Fe + 2e- = Fe2+ 正极:O2+2H2O+4e=4OH-
9、(1)两次操作均发生原电池反应,所以微安表指针会发生偏转.
(2)两次操作,电极相反,电子流向相反,因而指针偏转方向相反.
(3)2I--2e-=I2
(4)AsO33-+H2O-2e-=AsO43-+2H+
(或AsO33-+2OH--2e-=AsO43-+H2O)
10、装置(略)Pt,2Fe + 2e = 2Fe ;Zn,Zn + 2e = Zn
第二节 化学电源(1)
1.BC 2 B 3 BD 4 C 5 C 6 D 7 C
8. Zn ,Ag2O和电解质溶液为KOH溶液负极:Zn+2OH--2e- =ZnO +H2O 正极:Ag2O+H2O+2e- =2Ag+2OH-
总反应式为: Ag2O +Zn=ZnO +2Ag 9、8Li-8e-= 8Li +
10. 负;正极;氯化铵和淀粉糊
负极:Zn-2e-=Zn2+ 3+-2+-2+
11
正极:2NH4+2MnO2+2e=2NH3+Mn2O3+H2O
+- 电池放电过程中有水产生、锌筒变薄造成干电池变软;
正极反应的中间产物H2附着于石墨,增加电池内阻;
废电池中的物质会导致地下水和土壤污染,威胁人类的健康;另一方面,废电池中的有色金属是宝贵的自然资源。
11.2Al-6e-=2Al3+ 3 Ag2S+6 e-=6Ag+3S2-
2Al+3 Ag2S +6H2O=Al(OH)3+6 Ag+3H2S↑
第二节 化学电源(2)
1B 2CD 3A 4D 5B 6D
7、(1)Pb (2)PbO2 + 4H+ + SO42- + 2e - === PbSO4 + 2H2O(3)增大 (4)负 (5)正,负
(6)PbSO4 氧化反应,还原反应
充电总反应:2PbSO4 + 2H2O ====== Pb + PbO2 + 2H2SO48、(1)B (2)Ni(OH) 2 和Cd(OH) 2均溶于酸形成有毒的离子(3)大于;富集;被污染的饮用水
第二节 化学电源(3)
1AD 2D 3AC 4D 5BC 6AC
7. H2 ; O2 ;酸,碱,KOH
负极2H2 - 4e- = 4H+ 正极O2 + 4H+ + 4e-= 2H2O总反应2H2 +O2 = 2H2O 负极2H2 +4OH-- 4e- = 4H2O 正极O2 + 2H2O + 4e-= 4OH-
8.负极:CH4+10 OH--8e-=CO32-+7H2O
正极:2O2+4H2O+8e-=8 OH-
电池总反应式:CH4+2O2+2KOH= K2CO3+3H2O
-2-9.(1)、2CH3OH+3O2+4OH=2CO3+6H2O
(2)、负 下降
(3)、① O2+4e=2O
② 负 -2-
12
