无菌实验室操作规程
一 日常管理
1 准备工作
实验前,准备齐当天所用物品(包括废液缸),并置2%新洁尔灭溶液(3000ml)及空盆于无菌间,开操作台和无菌室紫外灯30min。放臭氧15分钟后,再进无菌间操作。
2 无菌间操作
进无菌间后换拖鞋、穿工作服、戴口罩、帽子、手套,然后用新洁尔灭洗手;
将所用的试剂用新洁尔灭或75%酒精擦拭后放入操作台,撕封口膜,用酒精棉球擦拭瓶口,再在酒精灯火焰上烤,之后用止血钳夹住瓶塞取下;
在操作台内,瓶口尽量不应直立向上,在盖塞前烤塞子与瓶口(除酒精棉球瓶外),再盖严加封口膜取出;
做完实验,清理操作台,用新洁尔灭擦拭台面及操作台上的物品。
3 无菌间清扫
无菌室每周要彻底打扫一次,用新洁尔灭擦墙、门、仪器及桌面等;75%酒精擦窗、玻璃等;过氧乙酸擦操作台、出问题或准备要用的培养箱。
4 无菌服
冬天时一周一洗;夏天时一天一洗。按实验室值日生顺序轮流洗涤,并由上一人及时通知下一人。洗涤晾干,高压灭菌后放入无菌间紫外杀菌。
5 臭氧发生器
每晚最后离开实验室的,关电器、门窗等,并打开臭氧发生器定时一小时。
二 实验室物品处理
1新塞子的处理
新胶塞对细胞有一定的毒害作用,其处理方法为:
新胶塞 →洗衣粉洗→洗涤灵洗→晾干→20g/1000ml的NaOH煮30min→水冲洗→去离子水浸泡过夜→双蒸水冲洗→晾干→备用
有水沸腾时算起,煮30min。
2 接触细胞的用品的处理
用品→过氧乙酸浸泡过夜[20ml/10000ml过氧乙酸]→取出→洗涤灵擦洗→水冲→晾干→泡酸[洗液]→自来水浸泡过夜→去离子水冲洗→双蒸水冲洗→晾干→备用
3 未接触细胞的用品的处理
用品→自来水冲洗[可适当用洗衣粉或洗涤灵洗]→去离子水冲洗2~3次→双蒸水冲洗2~3次→晾干→包口→备用
滤器、瓶→自来水冲洗30min→去离子水冲洗→双蒸水冲洗→晾干→备用
三 细胞污染时培养瓶及培养箱的处理
1 细胞污染
细菌污染时培养基多出现浑浊,在镜下观察时多出现黑色跳动小点。
真菌多为霉菌污染时,初期为镜下可见圆形漂浮或贴辅的空心圆泡,后期可见明显霉斑,镜下可见菌丝为树枝状。
2 处理
细菌多用新洁尔灭(20ml/1000ml水)可适当加大浓度,浸泡24h以上。
真菌多用过氧乙酸(20ml/10000ml水)可适当加大浓度,浸泡24h以上。
3 培养箱处理
培养箱应拆下内部组件,彻底清洗,用过氧乙酸擦拭后再用新洁尔灭擦拭,然后用酒精擦拭,紫外照射30min,最后用75%的酒精(40℃,CO2为零)培养箱内部熏蒸3~4h;污染严重时要将其放入烘箱内100~200℃烘3~4h安装后再照紫外。
注:
Ⅰ 每次操作时要将培养箱彻底擦拭;
Ⅱ 每月对培养箱做一次AUTOSUART(具体操作见说明书)
4 培养间处理
要彻底打扫,擦拭,先用0.5%过氧乙酸擦一遍,大约10分钟后,用0.5%新洁尔灭再擦一遍,最后用过氧乙酸熏蒸消毒。方法为:向熏蒸槽内加入适量酒精,放上石棉网,取一个烧杯,加入100ml过氧乙酸和等量的蒸馏水,把烧杯放在石棉网,一起端进无菌室,并打开室内所有厨子和抽屉,点燃酒精开始熏蒸,中途可以检查酒精燃烧情况,如燃完可以视过氧乙酸剩余多少,再加入适量酒精,切忌烧干过氧乙酸。
注意事项
1 进出无菌间,无论什么事,都必须带一次性手套开门;
2 血清、双抗等不能照紫外的试剂,只接带进无菌间后用酒精棉球擦拭三遍;
3 无菌间内装消毒液的桶、盆必须专用;
4 所用抹布,在做完实验后要洗涤、高压灭菌,烘干后照紫外,从传递柜带进无菌间,所有能灭菌的均以此方式处理;
5 -70℃冰箱及液氮室钥匙由专人负责,除特殊情况,任何人不得随意拿用;平时也要先跟负责人请示;
6 实验操作分组时,各组使用各组的仪器设备,能分开用的要彻底分开;
7 为提高实验操作人员的关注程度,试验的每个步骤都要有相关纪录;
8 无论实验室有无污染,均要定期熏蒸,夏天一天一次,每次不必太长时间;
9 实验中遇到问题先查书、再找专家,切记勿盲目轻信;
10 私人衣物可以在实验室洗,但除无菌服外,禁止在实验室晾;
11 实验室内的试剂、相关工具等均有相应摆放位置及电子图示,勿乱放、并做好定期更新; 12 实验室内禁止带入任何食品;
13 在包滤器、滤瓶时,要包口,外面再包一层牛皮纸之后外面再包一层布,在高压灭菌后则不会进入水蒸气;
14 在配制试剂时所用的水为去离子、三重蒸馏水,现用现烧。
第二篇:无菌检查操作规程

1. 目的:
建立无菌检查的标准操作规程,确保检验结果的准确性。
2. 范围:
适用于本厂质监科化验室对本厂生产的注射剂进行无菌检查。
3. 责任:
化验员有责任按本操作规程操作,并对检验结果负责。
4. 定义:
无菌检查法系指检查药品是否无菌的一种方法。
5.内容:
5. 1无菌操作设备:
无菌操作室或超净工作台,无菌衣、口罩、帽子、消毒鞋、酒精灯等。
5.1.1无菌室分无菌操作室和缓冲间。在缓冲间内应有洗手盆、干手器、无菌
衣放置架及挂钩、拖鞋等。无菌操作室应具有空气除菌过滤的层流装置,局
部洁净度100级超净工作台。缓冲间及操作室内均设置能达到空气消毒的紫外
光灯和照明灯,操作室或工作台应保持空气正压。
5.1.2无菌室应每周和每次操作前用0.1%新洁尔灭或2%甲酚液擦拭操作台及
可能污染的死角,开动无菌空气过滤器及紫外光灯杀菌1小时。在每次操作完
毕,同样用2%甲酚或0.1%新洁尔灭溶液擦拭工作台面,用紫外光灯杀菌半小
 时。
时。
5.1.3无菌室的无菌程度检查:无菌室在消毒处理后,无菌试验前及操作过程
中需检查空气中菌落数。取直径90mm双碟,在接种室内点燃酒精灯,在酒精灯
旁,以无菌操作,将双碟半开注入溶化的营养琼脂培养基约20ml,制成平板:
在35-37℃预培养48小时,证明无菌后将3个平板以无菌方式带入无菌操作间
的洁净区域左、中、右各放1个;打开碟盖扣置,平板在空气中暴露30分钟后
将盖盖好,置35-37℃培养48小时,取出检查,3个平板上生长的菌落数相加
总数不得超过10个。
无菌操作台面或超净工作台应定期请有关部门检测其洁净度,应达到100
级(一般用尘埃粒子计数仪),检测尘埃粒径≤5μm的粒数不得超过3.5个/
升;空气流量应控制在0.75-1.0m3/s;细菌菌落数平均<1个,可根据无菌状况
定期置换过滤器。
5.1.4无菌室内应准备好盛有消毒用5%甲酚的玻璃缸、酒精灯、火柴、镊子、
75%酒精棉及拖鞋等。
5.2仪器、用具:
5.2.1真空泵、恒温培养箱、生物显微镜、托盘天平(精度0.1g)、抽滤瓶(500ml)、 三角瓶(100、500 ml)、移液管(1、10ml)、注射器(要求规格)、试管、双碟(9cm)、注射针、镊子、剪刀、白金耳、橡皮管、纱布、棉花(原棉)、不锈钢吸管筒、接种环、微孔滤膜(直径约5cm),孔径应在0.45±0.02μm )载玻片、洒精灯、取样勺、吸耳球、喷雾瓶。
5.2.2用具的包扎:
5.2.2.1移液管
在移液管上端管内,松松地塞进少许原棉,然后放入不锈钢灭菌筒内。
5.2.2.2试管
在管口塞上纱布棉塞。
5.2.2.3无菌衣、裤、帽、口罩
将洗净的衣裤、帽子、口罩配套后装入布袋,扎紧袋口,再用牛皮纸包好。
5.2.2.4注射器
洗涤干净的注射器及注射针头装配好后,放入垫有纱布的带盖容器内(饭
第3页/共7页
 盒)一层层放好,上面盖上纱布,然后盖上容器的盖子,用牛皮纸包好。
盒)一层层放好,上面盖上纱布,然后盖上容器的盖子,用牛皮纸包好。
5.2.2.5滤器
将检验合格后微孔滤膜先有水中浸泡湿润,取出后固定在细菌过滤器的滤板上,滤板下、滤膜上均用耐高温垫圈垫好,上好滤器。在灭菌前滤器的螺勿
拧太紧,滤器上口用8层纱布及牛皮纸包扎,装妥后放入容器内,再将盛滤器的容器盖好盖子,用牛皮纸包扎。
5.2.3用具的灭菌:
将包扎好的用具,在121±0.5℃蒸汽灭菌柜中灭菌30分钟,物品取出时切勿立即置冷处,以免急速冷却灭菌物品内蒸汽冷凝造成负压,易致染菌,应置温箱或或加温烘干。
5.3培养基、试剂:
5.3.1一般采用商品干燥培养基,临用时按照使用说明书进行配制,需注意培养基的pH值应符合规定,否则必须校正后,灭菌使用。
使用前,按要求分装灭菌好的细菌培养基须经30-35℃培养48小时,真菌培养基须经20-25℃培养72小时,证明无菌生长后方可使用。
制备的需气菌、厌气菌培养基应半个月内用完,在供试品接种前,培养基指示剂氧化层的颜色不得超过培养基深度约1/5,否则须经水浴煮沸加热,只限加热一次。
5.3.2革兰氏碘液:
先用3-5ml蒸馏水溶解2.0g碘化钾,再加入1.0g碘片,搅拌溶解后,加蒸馏水稀释至300ml,摇匀。置密闭棕色瓶中备用。
5.3.3结晶紫染色液:
将结紫1.0g溶解于20ml95%乙醇中后,与80ml1%草酸铵溶液相混合,静置48小时使用。此液稳定,置密闭的棕色瓶中可储存数月。
5.3.4沙黄染色液:
将0.2g沙黄溶解于10ml95%乙醇中,待完全溶解后再加蒸馏水至100ml。
5.3.5生理盐水:
称取9g氯化钠,加水1000ml溶解,分装后于121±0.5℃湿热灭菌30分钟。供作稀释剂用。
第4页/共7页
 5.3.6 75%乙醇
5.3.6 75%乙醇
量取无水乙醇75ml,加水稀释至100ml,摇匀,即得。
5.3.7 0.1%新洁尔灭:
量取5%新洁尔灭20ml,加水稀释至约1000ml,摇匀,即得。
5.4培养基灵敏度检查:
5.4.1新购的干燥培养基或采用不同牌号原材料的新鲜培养基,其质量均应符
合灵敏度检查要求。
(1)取藤黄微球菌[Micrococcus luteus CMCC(B) 28001]的营养琼脂斜面和白色念珠菌[Candida albicans CMCC(F)98001]的真菌培养基琼脂斜面的新鲜培养物,分别用0.9%无菌氯化钠溶液制成均匀的菌悬液;取生孢梭菌[Clostridium sporogenes CMCC(B)64941]不含琼脂的需气、厌气培养基新鲜培养物,用灭菌毛细管将其吸至灭菌离心管内,离心,弃去上清液,沉淀菌体用0.9%无菌氯化钠溶液制成均匀菌悬液。然后以10倍系列稀释后,制成1ml中含10-100个菌并计数。
(2)取藤黄微球菌、生孢梭菌的需气、厌气培养基新鲜培养物,白色念珠菌
的真菌培养基琼脂斜面的新鲜培养物,取接种至霉菌培养基内,20-25℃用0.9%
无菌氯化钠溶液作10倍稀释,制成1ml中含10-100个菌并计数。
将藤黄微球菌的上述(1)或(2)的稀释液各1ml,分别接种至每管装量为9ml的需气、厌气菌培养基3管,生孢梭菌的上述(1)或(2)的稀释液各1ml,分别接种至每管装量为12ml的需气、厌气菌培养基3管,白色念珠菌的上述(1)或(2)的稀释液各1ml,接种至每管装量为9ml的真菌培养基3管,以未接种的培养基作对照,按规定的温度培养5天并逐日记录结果。
结果判定:以每株菌接种后的培养基不得少于2管呈现生长,即该培养基的灵
敏度检查符合要求。
5.4.2配制的培养基应在凉暗处保存,一般不得超过2周,临用前细菌和霉菌
培养基分别经30-35℃和20-25℃培养不少于48小时和72小时,证明无菌生长
后方可使用。
5.4.3需气菌、厌气菌培养基在试管中装量高度不得少于7Cm,其指示剂氧化层
不得超过培养基深度的1/5,否则须经水浴煮沸10分钟,但只限加热一次。
第5页/共7页
 无菌试验培养时间结束时,指示剂氧化层应不超过培养基深度的1/2。
无菌试验培养时间结束时,指示剂氧化层应不超过培养基深度的1/2。
5.5对照用菌液的制备:
5.5.1试验用菌种、菌种的复苏、菌种的接种与保存等均应按照“抗生素微生物检定法”标准操作规程项下操作。
5.5.2金黄色葡萄球菌菌液用接种环取金黄色葡萄球菌[Staphy-lococcus aureus CMCC(B)26003]的营养琼脂斜面新鲜培养物少许,接种至营养肉汤培养基内,在30-35℃培养16-18小时后,用灭菌生理盐水稀释成1:106
5.5.3生孢梭菌菌液用接种环取生孢梭菌[CMCC(B)64941]的需气菌、厌气菌培养基新鲜培养物1白金耳,接种至相同培养基内,在30-35℃培养18-24小时后,用灭菌生理盐水稀释成1:106。
5.5.4白色念珠菌菌液用接种环取白色念珠菌[CMCC(F)98001]的真菌琼脂培养基斜面新鲜培养物1白金耳,接种至真菌培养基内,在20-25℃培养24小时后,用灭菌生理盐水稀释成1:105。
5.5.5上述制备的菌液,一般当日使用。
5.6进入无菌室的操作要点:
5.6.1根据试验程序,将用具物品搬入缓冲间,打开紫外光灯和空气过滤装置并使其工作1小时以上。
5.6.2操作人员用肥皂水刷洗双手,关闭缓冲间紫外光灯,进入缓冲间内,关闭第一层门,用2%来苏尔或0.1%新洁尔灭溶液洗双手,用消毒毛巾擦干,换上无菌衣、帽、口罩及消毒鞋。
5.6.3关闭无菌室内紫外光灯,进入第二层门并将用具搬至无菌室内,关闭无菌室门。
5.6.4凡进入无菌室后不应再外出取物品,因此,在每次试验中所用物品必须计划好,并准备好备用物品。从进入第一层门直至无菌室内,随操作人员的进入应喷雾2%来苏尔或0.1 %新洁尔灭溶液。
5.7检查法:
5.7.1无菌检查法包括:直接接种法和薄膜过滤法。前者适用于非抗菌作用的供试品;后者适用于有抗菌作用的或大容量的供试品。
5.7.2操作时,应先用0.1%新洁尔灭浸泡或擦拭容器表面后,以无菌的方法取
第6页/共7页
 内容物。
内容物。
5.7.3凡无菌检查中,均应取相应溶剂和稀释剂同法操作,作阴性对照。
5.7.4供试品制备:
用灭菌镊取出注射器,在火焰旁将针芯插入针管并安上针头,盖为橡皮塞
时,用注射器在已消毒好的橡皮塞中心位置刺入吸取药液。按规定须稀释或灭
活的供试品,可直接或将瓶内供试液抽出至灭菌玻璃容器内进行灭活处理并稀
释至规定的体积和浓度;抽取瓶中内容液体时,应将供试品倒置并使针头在液
面下。
5.7.5直接接种法:
按规定量取供试品,以无菌操作将该供试品分别接种于需气菌、厌气菌培养基6管,其中1管接种金黄色葡萄球菌液1ml,作阳性对照,另接种于真菌培养基5管。轻轻摇动,使供试品与培养基混合。需气菌、厌气菌培养基管置30-35℃、真菌培养基管置20-25℃培养7日。在培养期间应逐日观察并记录是否有菌生长。阳性对照管在24小时内应有菌生长,如在加入供试品后,培养基出现浑浊,培养7天后,不能从外观上判断有无微生物生长,可取该培养液适量转种至同种新鲜培养基中或斜面培养基上继续培养,细菌培养2日,真菌培养3日,观察是否再出现浑浊或斜面有无菌生长,或用接种环取培养液涂片,染色,用显微镜观察是否有菌。
5.7.6薄膜过滤法:
将微孔滤膜过滤装置、抽滤瓶、排气管与真空泵相连,真空泵可置无菌室外。
取规定量供试品,按规定的方法处理后,加入0.9%无菌氯化钠溶液100ml中,混合后,通过装有孔径不大于0.45μm 的薄膜过滤器,减压抽干后,用0.9%无菌氯化钠溶液冲洗滤膜3次,每次至少100ml,取出滤膜分成3等份,分别加入上述二种培养基中,按规定温度和时间培养。阳性对照管应根据供试品特性加入相应对照菌液1ml(抗细菌药物,以金黄色葡萄球菌为对照菌;抗厌氧
菌药物,以生孢梭菌为对照菌;抗真菌药物,以白色念珠菌为对照菌)。阳性对照管细菌应在培养24-48小时,真菌应在培养24-72小时有菌生长。
5.8结果判断:
第7页/共7页
 当阳性对照管显浑浊并确有菌生长,阴性对照管呈阴性时,可根据观察所得的结果判定:如需气菌、厌气菌及真菌培养基管均为澄清或虽浑浊但经证明并非有菌生长,均应判为供试品合格;如需气菌、厌气菌及真菌培养基管中任何1管显浑浊并确证有菌生长,应重新取2倍量供试品,分别依法复试,除阳性对照管外,其他各管均不得有菌生长,否则应判为供试品不合格。
当阳性对照管显浑浊并确有菌生长,阴性对照管呈阴性时,可根据观察所得的结果判定:如需气菌、厌气菌及真菌培养基管均为澄清或虽浑浊但经证明并非有菌生长,均应判为供试品合格;如需气菌、厌气菌及真菌培养基管中任何1管显浑浊并确证有菌生长,应重新取2倍量供试品,分别依法复试,除阳性对照管外,其他各管均不得有菌生长,否则应判为供试品不合格。
6 培训
6.1 培训对象:化验员。
6.2 培训时间:二小时。
7 记录
记录名称 保存部门 保存时间
无菌检验记录 质监科 药品有效期后一年
QF-01-007-00
无菌检验记录
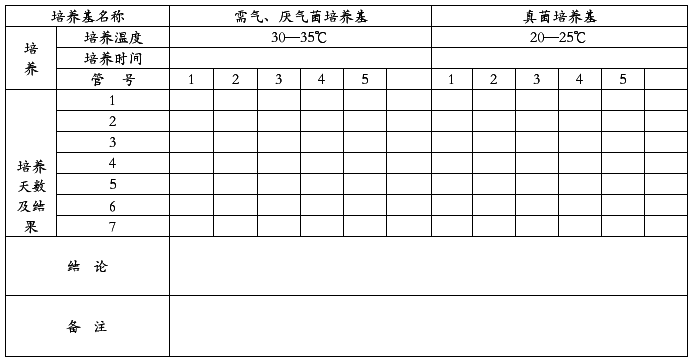
品 名: 批 号:
规 格: 检验日期: 年 月 日
复核人: 检验人:
