食醋中总酸量的测定
陈全民 化学2班 41007055
一、实验目标
1、初步学会用传感器技术测定食醋中的总酸量;
2、会组织中学生用传感器技术测定食醋中的总酸量教学过程。
二、实验原理
待测的食醋中醋酸及其他有机酸可换算为醋酸总量,都可以被标准的强碱NaOH溶液标定:C待测V待测=C标准V标准。当溶液中的电解质含量恒定时,电导率亦恒定,当生成难电离物质时,电导率下降,pH传感器就是把电信号转化为化学信息来测定其中的总酸度的。
三、仪器与药品
pH传感器,数据采集器,自动计数器,50mL酸式滴定管,电磁搅拌器,铁架台,250mL烧杯,量筒;有色食醋原液,经标定的0.1mol/L NaOH溶液,去CO2的蒸馏水。
四、实验操作过程
1.实验过程
把pH传感器连接到数据采集器的系列端口上。
数据采集器速率设定为1/s。
采集数据的总数:5000。
往酸式滴定管中注入有色食醋溶液。
再往烧杯中注入标定过的50mL NaOH溶液,把烧杯放于磁力搅拌器上。如图:

在数据采集器的键盘上按下“执行”键,启动数据采集。稍等片刻,直到传感器的数据稳定下来。
开动磁力搅拌器,搅拌烧杯中的NaOH溶液。
打开光电门计数器,然后轻轻旋开酸式滴定管旋钮,使待测的食醋溶液一滴一滴地滴入烧杯中。
跟踪pH传感器测量数据的变化。
当pH传感器的数据刚开始变化,立即终止滴入食醋,并记录已消耗的食醋的体积。
再次滴入食醋,注意跟踪pH的变化,当数值接近滴定终点时滴入的食醋尽可能地慢。当波峰曲线出现平台时,停止滴加食醋溶液。

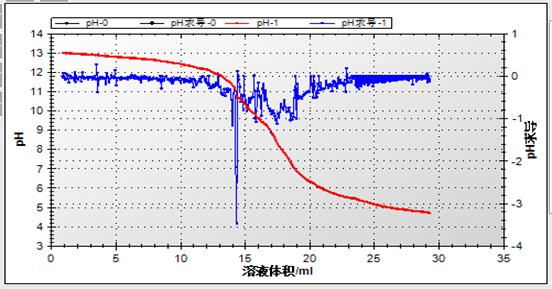
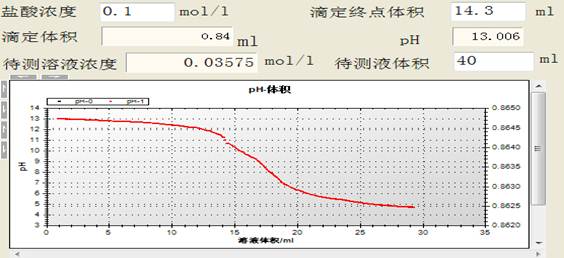 2.数据处理
2.数据处理
五、实验注意事项
1.传感器简介
传感器是一系列根据一定的物理化学原理制成的物理化学量的感应器具,它能把外界环境中的某个物理化学量的变化以电信号的方式输出,再经数据模拟装置转化成数据或图表的形式在数据采集器上显示并储存起来。中学化学教学中进行科学探究常用到的传感器有温度传感器、pH传感器、溶解氧传感器、电导率传感器、光传感器、压力传感器、色度传感器等。
传感器技术的特点:便携,实时,准确,综合,直观。
2.实验背景
食醋的质量高低取决于其中所含醋酸量的多少。市场上销售的食醋中,既有无色的(白醋、兑制醋),又有有色的(香醋、陈醋、熏醋),它们的标牌上所标出的醋酸总含量各不相同,有的大于9g/100mL,有的大于6g/100mL,还有的标着大于等于4.5 g/100mL、4.2 g/100mL、3.5 g/100mL等等。
(1)食醋中的主要成分是醋酸,此外还含有少量的乳酸等有机酸,醋酸是弱酸,用pH试纸或酸度计测定食醋中的总酸量,总是要比实际浓度低,何因?
(2)如果用中和滴定的方法来测定食醋中的总酸量,那么如何选择指示剂?
(3)用中和滴定来测定白醋和兑制醋很好,但是测定米醋、果醋、熏醋等有色食醋的含酸量时,因其颜色比较深,能遮盖住指示剂的颜色,这样就无法看见指示剂的颜色变化,能否用蒸馏水冲稀食醋以减轻颜色的干扰,或者能否用活性炭对这类食醋作脱色处理以后滴定?加入活性炭对溶液的酸度是否有影响?
(4)克服上述不足,可以用一种称作pH传感器测定的方法来实现,该方法不怕待测物中的颜色干扰,测定既快又不用加指示剂。
3.实验的关键
滴定速度的控制:在接近终点时,要注意放慢速度,以便观察到终点。
酸碱的浓度差别不要太大,否则,实验将较难控制,结果误差较大。
4.实验安全须知
注意食醋和强碱对皮肤的腐蚀与刺激,实验时应佩戴护目镜和防护手套。
参考文献
[1]郑长龙主编.化学实验课程与教学论[M].北京:高等教育出版社,2009
[2]肖常磊,钱扬义主编.中学化学实验教学论[M].北京:化学工业出版社,2008
[3]钱扬义编著.手持技术在立刻试验中的应用研究[M].北京:高等教育出版社,2003
[4]钱扬义.手持技术在研究性学习中的应用及其心理学基础[M].北京:科学出版社,龙门书局,2006
[5]白涛等编著. 化学为什么是这样基于手持技术的数字化实验探索[M].北京:化学工业出版社,2011





第二篇:食醋中总酸和不挥发酸的测定
实验四 食醋中总酸和不挥发酸的测定
教学目的要求:
基本知识点
1、滴定、溶液转移和配制标准溶液等基本操作。
2、滴定法测定总酸的原理及操作要点。
3、不挥酸测定方法和操作技能。
4、pH计的维护和使用方法。
重点:
1、酸度计的工作原理和正确使用与保养;
难点:
1、滴定、溶液转移和配制标准溶液等基本操作。
2、酸度计的工作原理和正确使用与保养。
复习与提问
1、检查实验准备情况
(1)实验内容;
(2)实验仪器与试剂有哪些?
(3)酸度计测定PH的工作原理和使用方法。
(4)总酸度测定当样品颜色深时,如何确定终点?
(5)挥发酸测定仪器的连接方式,如何检查气密性?
(6)分析天平的正确操作方法。
2、挥发酸测定的原理和注意事项,为什么要加入磷酸?
实验四 食醋中总酸和不挥发酸的测定
目前我国GB规定食醋分为酿造食醋和配制食醋两类,商品在销售中必须注明类型。
酿造食醋 Fermented vinegar 单独或混合使用各种含有淀粉、糖的物料或酒精,经微生物发酵酿制而成的液体调味品。按发酵工艺分为两类。
固态发酵食醋 以粮食及其副产品为原料,采用固态醋醅发酵酿制而成。
液态发酵食醋 以粮食、糖类、果类或酒精为原料,采用液态醋醪发酵酿制而成。
配制食醋 Blended vinegar 以酿造食醋为主体,与冰乙酸、食品添加剂等混合配制而成的调味食醋

一、目的要求
1、进一步熟悉及规范滴定、溶液转移和配制标准溶液等基本操作。
2、通过本实验领会碱滴定法测定总酸的原理及操作要点。
3、掌握不挥酸测定方法和操作技能。
4、掌握pH计的维护和使用方法。
二、实验原理
(一)总酸测定
食醋中主要成分是醋酸,含有少量有机酸。用氢氧化钠标准溶液滴定,以酸度计测定,pH8.2终点,结果以醋酸表示。
(二)不挥发酸测定原理
样品经蒸馏排除挥发酸,用氢氧化钠标准溶液滴定,以酸度计测定, pH8.2终点,结果以乳酸表示。
三、仪器
(一)总酸测定

(二)不挥发酸测定
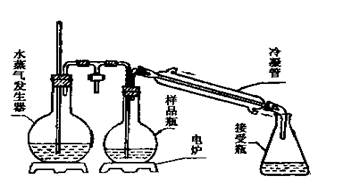
1、酸度计:精度±0.1pH;2、水蒸气蒸馏装置; 3、碱式滴定管。
三、试剂
(一) 1%酚酞指示液:称取1g酚酞,溶于100mL 95%乙醇中。
(二) 0.05mol/LNaOH标准溶液的配制:
首先,在250mL烧杯中加入200mL左右蒸馏水,用电炉加热煮沸后,冷却至室温,备用。
1、配制:用小烧杯在扭力天平上称取分析纯固体NaOH 1g,加水约25mL,溶解后于500mL容量瓶中定容。
 2、标定:准确称取约0.2~0.3g 在105~110℃干燥至恒量的基准邻苯二甲酸氢钾,于250mL的锥形瓶中,加50 mL新煮沸过的冷水,使之尽量溶解,加2滴酚酞指示液,用本溶液滴定至溶液呈粉红色,30s不褪色,重复标定三次。同时做空白试验。
2、标定:准确称取约0.2~0.3g 在105~110℃干燥至恒量的基准邻苯二甲酸氢钾,于250mL的锥形瓶中,加50 mL新煮沸过的冷水,使之尽量溶解,加2滴酚酞指示液,用本溶液滴定至溶液呈粉红色,30s不褪色,重复标定三次。同时做空白试验。
按下式计算NaOH标准溶液的浓度:
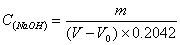
式中:
c(NaOH)— NaOH标准溶液的浓度,(mol/L);
m—邻苯二甲酸氢钾的质量,(g);
V—滴定时消耗NaOH溶液的量,(mL);
V0----空白实验消耗NaOH溶液的量,(mL);
0.20##------与1.00 mL NaOH标准溶液[c=0.1000(mol/L)]相当的以g为表示的邻苯二甲酸氢钾的质量。
(三)磷酸溶液 (100g/L) 称取10.0g磷酸,用无CO2蒸馏水溶解并稀释至100mL。
四、样品测定
(一)总酸测定
1、测定:吸取10.0mL样品于100mL容量瓶中,加水至刻度,混匀。吸取20.0mL,置于200mL烧杯中,加60mL水, 开动磁力搅拌器,用0.05 mol/L氢NaOH标准溶液滴定至酸度计指示 pH8.2。同时做试剂空白试验。
2、计算
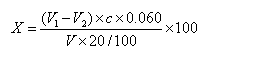
式中:
X1──试样中总酸的含量(以乙酸计),g/100mL;
V1─—测定用试样稀释液消耗NaOH标准液的体积,mL;
V2──试剂空白消耗NaOH标准溶液的体积,mL;
C—NaOH标准溶液的浓度,mol/L;
0.060—与1.0 mL NaOH标准溶液[c(NaOH)= 1.000 mol/L ]相当乙酸的质量, g ;
V—试样体积, mL 。
结果的表述:报告算术平均值的三位有效数。在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%;
(二)不挥发酸的测定
1、样品处理:样品摇匀(上下颠倒3次);
 2、准确吸取5.00mL样品移入水蒸气蒸馏装置中间园底烧瓶中,加入25mL无CO2蒸馏水和10g/L的磷酸溶液1mL,连接水蒸气蒸馏装置,加热蒸馏,至馏出液达200mL 为止。
2、准确吸取5.00mL样品移入水蒸气蒸馏装置中间园底烧瓶中,加入25mL无CO2蒸馏水和10g/L的磷酸溶液1mL,连接水蒸气蒸馏装置,加热蒸馏,至馏出液达200mL 为止。
3、将残余液倒入250mL烧杯中,用水反复冲洗中间园底烧瓶,洗液并入烧杯,再补加水至烧杯中溶液总量约为120mL。 将盛有120mL残留液的烧杯置于酸度计的托盘上,开动磁力搅拌器,用 0.05mol/LNaOH标准滴定溶液滴至pH8.2,记录消耗的毫升数(V)。
同时做空白试验。
4、计算
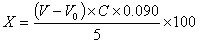
式中:
X—样品中不挥发酸的含量(以乳酸计),g/100mL;
V—滴定样品时消耗0.05mol/LNaOH标准滴定溶液的体积,mL;
V0—空白试验消耗0.05mol/LNaOH标准滴定溶液的体积,mL;
C—NaOH标准滴定溶液的浓度,mol/L;
0.090—1.00mLNaOH标准滴定溶液[C(NaOH)=1.000mol/L]相当于乳酸的质量,g。
允许差 同一样品平行试验的测定差不得超过0.04g/100mL。
5、说明:蒸汽发生器内的水在蒸馏前须预先煮沸。
思考题
1、称取NaOH及邻苯二甲酸氢钾各用什么天平?为什么?
2、为什么称取邻苯二甲酸氢钾基准物要在0.4g~0.6g范围内?能否少于0.4g或多于0.6g?为什么?
3、以标定的NaOH标准溶液在保存时吸收了空气中的CO2,以它测定溶液HCl的浓度,若用酚酞为指示剂,对测定结果产生何种影响?改用甲基橙,结果又如何?
附:电位滴定法
电位值突跃。不使用指示剂,电位变化最大的一点就是滴定终点。主要用于被测溶液颜色深,不易观察滴定过程中指示剂颜色变化,或无适合的指示剂的滴定分析中。
(一) 电位法测定pH的原理
以玻璃电极为指示电极,饱和甘汞电极为参比电极,插入待测溶液中组成原电池,该电池电动势大小与溶液pH值呈线性关系:
E = Eo - 0.0591pH (25℃)
即在25℃时,每相差一个pH单位,就产生59.1mv的电池电动势,通过酸度计测定电动势并直接以pH 表示,即可以从酸度计表头上读出样品溶液的pH 值。
1、电极电位:将一金属作为电极,插入该金属离子的溶液中,在金属电极与溶液的界面间,将产生一个电位差,即称电极电位。电极电位的大小与金属的性质、溶液中相应离子的浓度等有关,它符合能斯特方程:
 式中:
式中:
E—电极电位;
E0 —电极的标准电压;
[Mn+] —金属离子的活度;
[Ox] —氧化态的活度;
[Red] —还原态的活度;
n —得失电子数;
2、指示电极:电极电位随着溶液中相应离子活度的不同而不同,电极的电极电势与待测成分的浓度符合能斯特方程。这种电极电位随着相应离子活度而变化的电极,称为指示电极,如常用的玻璃电极,其电极电位随着溶液[H+]而变化。
3、参比电极:单一的电极电位实际上是无法直接测定的,只有将它与一个已知电极电位恒定的电极组成电池,通过测定该电池的电动势求出欲测电极的电位。这个电极电位已知并恒定的电极称为参比电极,它的电极电位,不受待测成分组成变化的影响。
将指示电极与参比电极插入被测溶液中,构成电池,则电池电动势即能反映出溶液中相应离子的活度。
4、复合电极:把作为指示电极的玻璃电极和作为参比电极的银—氯化银电极分装在两个同心玻璃管中,好象是一个电极。
(二) 测定pH 的仪器—酸度计
酸度计也称pH计,是测定溶液pH值最常用的仪器之一。它主要利用指示电极和参比电极在不同pH值溶液中能产生不同的电动势,通过电压表将电动势直接用pH值表示出来,以达到测定溶液pH的目的。酸度计一般既可测溶液的pH值,又可测电动势。
1、构造原理 酸度计由电极和电计两部分组成。仪器所使用的电极为复合电极。复合电极是将玻璃电极(指示电极)和银-氯化银电极(参比电极)装在两个同心的玻璃管中,构成一体化的电极系统。
2、pH S-25型酸度计的使用方法
(1)仪器安装与开启
把电极上端的胶帽装在电极夹内,把电极插头插入电极插口内,并用插口上的小螺丝紧固之。
(2)电计检查
①“范围”开关置 中间位置,打开电源,此时电源指示灯亮,表针位置处于末打开机状态。
②将“选择”开关置“pH”档,“范围”开关置“0~7”,调 “定位”电表示(pH)值能小于6,“范围”开关置“7~14”调“定位”电表示值(pH)能大于8。
若符合以上要求则电表正常。
(3)仪器的pH标定
①置“功能选择开关”于“pH”位置。“温度补偿器”指示溶液之温度。
②置“选择”开关于所测pH标准缓冲溶液的范围内。4.00;6.86;9.18。
③选择适当pH的标准缓冲溶液(其pH已知,应与被测样液的pH相接近)。用标准缓冲溶液洗涤2次烧杯和电极,然后将标准缓冲溶液注入烧杯内,电极浸入溶液中,小心缓慢摇动烧杯。
③调节“定位”旋钮,使电表指示该缓冲溶液的准确pH。注意:标定所选用标准缓冲溶液应同被测定样品的pH最好接近,以减少误差。
经校正后,“定位”旋钮在整个测定过程中不得再改变,一般24h内仪器不再标定。
(4)pH测量
①调“温度”电位器使之指示溶液温度。 ②置“选择”开关于“pH”。 ③置“范围”开关于被测溶液可能的pH范围。
④把电极插入待测溶液内,稍摇动烧杯,使之缩短电极的响应时间。此时仪器所指示值即为被测溶液的“pH”。
测量完毕后,将电极和烧杯清洗干净,并妥善保管。
 3
、注意事项
3
、注意事项
(1)电极的安装
为确保电极测量结果真实,应避免电极室间
因有气泡或死水而造成数据失准,请严格按右图
安装:电极应深入到活动水体。
(2)复合电极的维护与保养
①pH电极使用前必须浸泡,因为pH球泡是一种特殊的玻璃膜,在玻璃膜表面有一层很薄的水合凝胶层,它只有在充分浸泡后才能在膜表面形成稳定的H+层,才能与溶液中的H+具有稳定的良好响应。若浸泡不充分,则测量时响应值会不稳定、漂移。浸泡时间一般为24h以上即可。
②新购入的电极或长期不用(指干燥保存)的电极,在使用必须活化24h,以使其不对称电位趋于稳定。
如急用,无法进行上述处理时,可把pH电极浸泡在0.1mol/L HCL中1小时,再用蒸馏水冲洗干净,即可使用。
③复合电极不用时,可充分浸泡3M氯化钾溶液中。切忌用洗涤液或其他吸水性试剂浸洗。
④使用前,检查玻璃电极前端的球泡。正常情况下,电极应该透明而无裂纹;球泡内要充满溶液,不能有气泡存在。
⑤测量浓度较大的溶液时,尽量缩短测量时间,用后仔细清洗,防止被测液粘附在电极上而污染电极。
清洗电极后,不要用滤纸擦拭玻璃膜,而应用滤纸吸干, 避免损坏玻璃薄膜、防止交叉污染,影响测量精度。
⑥电极不能用于强酸、强碱或其他腐蚀性溶液。
⑦严禁在脱水性介质如无水乙醇、重铬酸钾等中使用。
⑧电极的使用寿命跟使用介质有很大关系,不同介质使用寿命完全不一样。在很多恶劣的场合,可能仅使用2个月。而有些较好的介质,则使用达一年左右甚至更长。因此,我们建议用户尽量购买厂家最近时间生产电极!存放时间越短,则使用效果越好!
