选修6 第三单元课题二 —— 物质含量的测定
学习要求:了解中学常见测定物质含量的几个实验。
熟练掌握教材中中和滴定等定量实验的基本方法
重点掌握硫酸铜晶体结晶水含量测定的实验操作原理和方案
学习重点:硫酸铜晶体结晶水含量测定的实验和数据处理
【预复习】
托盘天平的使用:调节天平平衡,左物右码。
称量操作至什么时候停止:连续两次称量的质量差不超过0.1g为止
一、物质含量的测定:
(一)重量分析法
重量分析法是根据称量确定被测组分含量的分析方法。
应用重量分析法测定时,必须先用适当的方法将被测组分从样品中分离出来,然后才能进行称量。因此,重量分析包括 和 两大步骤。根据分离方法的不同,重量分析一般可分为 、 和
等。如测定硫酸铜晶体结晶水的含量就是采用此法。
(二)滴定分析法
滴定分析是将已知准确浓度的标准溶液滴加到被测物质的溶液中直至所加溶液物质的量按化学计量关系恰好反应完全,然后根据所加标准溶液的浓度和所消耗的体积,计算出被测物质含量的分析方法。
常见的滴定方法有: 、 和沉淀滴定等
注意事项:①滴定分析的关键;一是 ,二是 。
②常用作酸碱滴定的指示剂是: (pH变色范围 ~ ); (pH变色范围 ~ )。
(三)比色法(选修六P52)
(四)其他与量的测定有关的实验
1、中和热的测定:某化学兴趣小组要完成中和热的测定。(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol? L-1 盐酸、0.55mol? L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是
。
(3)他们记录的实验数据如下:

已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ?℃-1? Kg-1,各物质的密度均为1g?cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
2、溶解度的测定:以测定硝酸钾溶解度为例:
测定原理:在一定量的水中加入足量的硝酸钾固体,恒温下经充分搅拌,多余的溶质固体较长时间(5min)不再溶解,则所得溶液即饱和溶液。通过加热蒸发、称量,得其中溶质的质量,计算该温度下的溶解度。
硝酸钾的溶解度S=溶质质量(g)/溶剂(水)质量(g)× 100g
此外还有测密度、相对分子质量、物质的量浓度等。
【练习】
1、准确量取25.00mL KMnO4溶液可以选用的仪器是( )
A、50mL量筒 B、10mL量筒 C、50mL酸式滴定管 D、50mL碱式滴定管
2、用盐酸作标准液滴定待测浓度的碱溶液,若用甲基橙作指示剂,当滴定达终点时,溶液颜色变化是( )
A、由红色变橙色 B、由黄色变红色 C、由黄色变橙色 D、由橙色变黄色
3、实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH+6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤 Ⅰ 称取样品1.500 g。
步骤 Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤 Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤 Ⅲ 填空:①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察________(填序号)。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由________色变成________色,且半分钟内不褪色。
(2)滴定结果如下表所示:

若NaOH标准溶液的浓度为0.1010 mol·L-1则该样品中氮的质量分数为________。
二、硫酸铜结晶水含量的测定
1、测定的原理和需要测定的数据
(1)测定的原理:设硫酸铜晶体的化学式为CuSO4·xH2O ,x的计算式:
(2)测定的数据:要确定n(H2O)和n(CuSO4),必须先测出m(H2O)和m(CuSO4)。所以要完成本实验,必须获得H2O和CuSO4的质量数据。
根据反应:
只要测定两个数据:①加热前晶体的质量m(CuSO4·xH2O);②加热后(完全反应)CuSO4的质量m( CuSO4),两者之差为结晶水的质量。
2、实验仪器:
3、操作步骤和注意事项
(1)操作步骤
①研磨:在 中研碎硫酸铜晶体。
②称量:称量坩埚质量m,称 的总质量m1。(即获得第—个数据)
③加热:使 色 完全转化为 色 。
④冷却:将坩埚放在 里冷却。
⑤称量:称量 的总质量m2。(即获得第二个数据)
重复③④⑤操作。若第二次称量的坩埚和无水硫酸铜的总质量与第一次的差小于0.1g,则实验成功;若大于0.1g,必须再重复③④⑤操作,直至两次的差小于0.1g为止。取平均值。
(2)计算结果
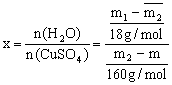
(3)注意事项
①加热硫酸铜晶体用玻璃棒轻轻搅拌的目的是受热均匀,防止受热不均匀而引起固体飞溅,溅出坩埚。
②生成的无水硫酸铜要在干燥器中冷却,而不能在空气中冷却,是防止无水硫酸铜吸收空气中的 。
③两次第五步的操作,质量差要小于 g,是为了保证实验的准确性和减小误差。
4、分析实验误差
在x的计算式中:凡能引起分子项增大或分母项减小的因素,会使x的值 ,例如:加热不均匀,有固体溅出坩埚,引起m2 ,则x值 。
凡能引起分子项减小或分母项增大的因素,会使x的值 ,例如:在空气冷却无水硫酸铜,无水硫酸铜 引起m2 ,导致x值 。
注意事项:
①晶体加热后先放在石棉网上稍冷却,之后一定要放在干燥器内冷却,以保证无水硫酸铜不会从空气中吸收水分而引起测得值偏 。
②晶体要在坩埚底上摊开加热,有利于失去全部结晶水,以免引起测得值偏 。
③加热时间不充分、加热温度过低(未全变白),都会使测得值偏 。
④加热过程中,应慢慢加热(可改垫石棉网),以防因局部过热而造成晶体溅失,引起测量值偏 。
⑤加热温度过高或时间过长,会导致硫酸铜少量分解,使测得值偏 。
[课后练习]
1、下列仪器中:(1)不能在酒精灯灯焰上直接受热的是( ) (2)能承受高温的是( )
A.坩埚 B.试管 C.蒸发皿 D.烧杯
2、某学生称量CuSO4·5H2O时,左盘放砝码4 g,游码在0.5刻度处,天平平衡。右盘CuSO4·5H2O晶体的质量是 ( )
A.4.5 g B.4 g C.3.5 g D.3 g
3、下列实验操作会引起测定结果偏高的是( )
A.测定胆矾晶体结晶水含量时,强热迅速蒸干,在干燥器中冷却后称量
B.中和滴定时,锥形瓶里有少量水
C.用量筒量取液体时,仰视读数
D.加热胆矾晶体测其结晶水含量时,加热过程中坩埚没有盖盖
4、以下是某同学测定硫酸铜晶体(CuSO4·xH2O)中结晶水含量的实验方案。
实验用品:硫酸铜晶体、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:① 准确称量一个干净、干燥的坩埚;② 在坩埚中加入一定量的硫酸铜晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;⑤ 将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至连续两次称量的质量差不超过0.1g为止;⑥ 计算硫酸铜晶体化学式中x的实验值。
分析该方案并回答下面问题:(1)完成本实验还需要的实验用品是___________ ;(2) 指出实验步骤②中存在的错误并改正:______________ _ ;(3)硫酸铜不能放置在空气中冷却的原因是 _________ ______;(4)步骤⑤的目的是________________ ;(5)若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后称量坩埚与无水硫酸铜的质量为m2,则晶体CuSO4·xH2O中,x =______________ (写表达式);(6)下面的情况有可能造成测试结果偏高的是 ____________(填序号)。
A.试样中含有加热不挥发的杂质 B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水 D.实验前坩埚未完全干燥
E.晶体加热脱水不完全 F.加热时有晶体溅出
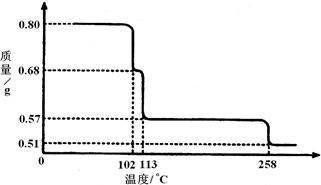
5、0.80gCuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200℃时固体物质的化学式______________(要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为______________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为_________,其存在的最高温度是_____________;
(3)上述氧化性气体与、水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为___________ _____;
选修6 第三单元课题二 —— 物质含量的测定参考答案
一、物质含量的测定:
(一)重量分析法
分离;称量,挥发法、萃取法和沉淀法
(二)滴定分析法
酸碱中和滴定 、 氧化还原滴定 ;①一是准确判断滴定的终点,二是:准确读数 。
②甲基橙(pH变色范围 3.1~4.4);酚酞(pH变色范围8.0 ~10.0)。
(四)其他与量的测定有关的实验
1、(1)量筒、温度计(2)否;金属易导热,热量散失导致误差大。
(3)①-56.8(或-56.85)KJ/mol ②NaOH (aq) + HCl(aq) = NaCl(aq) + H2O(l) △H=-56.8KJ/mol(用离子方程式表达也可) (4)无;有
【练习】
1、C、2、C、
3、 (1)①偏高 ②无影响 ③B ④无 粉红(或浅红)(2)18.85%
二、硫酸铜结晶水含量的测定
2:坩埚、坩埚钳、酒精灯、三脚架、泥三角、玻璃棒、药匙、研钵、托盘天平、干燥器
3(1)①研钵。②坩埚和晶体③蓝色硫酸铜晶体(CuSO4·xH2O);白色无水硫酸铜(CuSO4)。
④干燥器。⑤坩埚和无水硫酸铜
(3)②水分。③0.1 g。
4、偏大,减小 ,偏大 。偏小, 吸水 ;增大 ,偏小。
注意事项:
①小。 ②小。 ③小。 ④ 大。 ⑤ 大。
[课后练习]
1、(1)D(2)A 2、C. 3、A.
4、(1)泥三角、坩埚钳、酒精灯(可以不答“火柴”)
(2)应先将试样研细,后放入坩埚称重
(3)因硫酸铜放置在空气中冷却时,会吸收空气中的水分
(4)保证试样脱水完全
(5)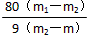
(6)B、D、F
5、 (1) CuSO4×5H2O D CuSO4× (5-n)H2O+n H2O
250 18n
0.80 0.80g-0.57g=0.23g n=4
200°C该固体物质的化学式为CuSO4× H2O
(2) CuSO4 570°C CuO+SO3 ; CuSO4·5H2O ;102°C
(3)2H2SO4(浓)+Cu D CuSO4+SO2 +2 H2O
第二篇:沪科版化学高二上10.2《结晶水合物中结晶水含量的测定》 试题
结晶水合物中结晶水含量的测定
1、以下关于瓷坩埚使用的说法中,错误的是( )
(A)加热时,应把瓷坩埚放在泥三角上
(B)取放、移动瓷坩埚时,应使用坩埚钳
(C)瓷坩埚加热时,要盖住坩埚盖不留空隙
(D)热的瓷坩埚不能直接放在桌面上,应垫有石棉网
2、以下胆矾中结晶水含量的测定操作中,正确的是( )。
(A)加热胆矾晶体,开始用小火,然后逐渐加大,用大火加热
(B)加热、冷却、称量重复两次即是恒重操作
(C)瓷坩埚加热后的冷却必须放在于燥器中
(D)加热时发现晶体爆溅出瓷坩埚,则应再加一些
3、在胆矾中结晶水含量测定的实验中,不必使用的仪器是( )
(A)瓷坩埚 (B)天平 (C)干燥器 (D)量筒
4、 下列关于硫酸铜晶体中结晶水含量测定的操作中,错误的是( )
(A)加热硫酸铜晶体时,不能太剧烈
(B)加热后,放在空气中冷却再称量
(C)用电子天平称量读至0.001g
(D)第一次加热、冷却,称量后,再要加热、冷却、称量
5、下列测定硫酸铜晶体中结晶水含量的实验操作中,正确的是( )。
(A)加热后,放在空气中冷却再称量
(B)加热时,晶体溅出
(C)晶体加热后,未完全变白
(D)慢慢给晶体加热
6、测定胆矾晶体中结晶水含量的实验中,下列操作中使测定结果偏大的是( )
(A)加热前称量时,容器未完全干燥
(B)加热后的质量相差较大(大于0.001g)
(C)加热后,容器未放入干燥器中冷却
(D)加热过程中晶体有少量溅失
7、下列数据不合理的是( )。
(A) 用电子天平称量硫酸铜晶体的质量2.102g
(B)液体量瓶中液体的体积为125.50mL
(C)在镁带与稀硫酸反应测定1mol氢气的体积时,取用硫酸的体积为10.0mL
(D) 用10mL量筒量取液体的体积7.23mL。
8、下列化学实验操作中,不正确的是( )。
(A)用灯帽盖灭酒精灯火焰
(B)将浓硫酸慢慢注入水中,并用玻璃棒不断搅拌的方法稀释浓硫酸
(C) 加热后的硫酸铜未经冷却就在电子天平上称量
(D) 给试管里的固体加热,试管口应略向下倾斜
9、下列结晶水合物各1g,含结晶水的质量最多的是( )。
(A) ZnSO4·7H2O (B) MgSO4·7H2O
(C) FeSO4·7H2O (D) CuSO4·5H2O
10、测定硫酸铜晶体中结晶水含量的实验时,下列不会造成结果误差的是( )。
(A)坩埚用水洗涤后没有把水烘干直接实验
(B)坩埚内壁附有受热不分解的杂质
(C)把加热得到的白色粉末放在空气中冷却
(D)坩埚底部有少量黑色固体
11、下列关于结晶水合物的描述,正确的是( )
(A)晶体中都含有结晶水
(B)结晶水合物属于混合物
(C)结晶水合物受热后会失去部分或全部结晶水
(D)结晶水合物受热失水的过程叫做风化
12、用瓷坩埚加热CuS04·xH2O的方法测定x的数值,当测定过程中出现下列情况, 使得的x值偏低的是( )。
(A)硫酸铜晶体尚带淡蓝色便停止加热 -
(B)晶体加热至恒温时,立即放入干燥器内,冷却后称量
(c)硫酸铜晶体中含有受热分解的杂质
(D)硫酸铜晶体未研磨成细粉就进行实验
13分析下列情况对实验结果的影响:
1.加热前称量时容器未完全干燥 2.最后两次加热后的质量相差较大
3.加热后容器未放入干燥器中冷却 4.加热过程中有少量溅失
5.加热前晶体表面有水 6.晶体不纯,含不挥发性的物质
7.坩埚内含有不挥发性的物质 8.晶体未研成粉末,加热后还有少量颗粒
9.晶体未完全变白,就停止加热 10.加热时间太长,部分变黑
14、下列操作分别对硫酸铜晶体的结晶水测定结果有何影响(填“偏高”、“偏低”或“无影响”)?
(1)使用未经干燥的坩埚盛放硫酸铜晶体___________。
(2)硫酸铜晶体未经研碎,加热时晶体发生爆溅__________。
(3)加热时水蒸气未完全逸出___________。
(4)加热时温度过高,部分晶体变成黑色固体___________。
(5)加热后盛无水硫酸铜的瓷坩埚放在空气中冷却___________。
(6)使用的坩埚内壁附有受热不分解的难熔杂质_____________。
(7)加热前后均未称量玻璃棒,而加热后玻璃棒上沾有少量粉末_________。
15、测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨;②称量空坩埚和装有试样的坩埚质量;③加热;④冷却;⑤称量;⑥重复③~⑤的操作,直到连续两次称量的质量差不超过0.001g为止;⑦根据实验数据计算硫酸铜晶体中结晶水的含量。
请回答下列问题:
(1)现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是______________________。
(2)该实验中,需要使用干燥器的是步骤_____________,使用干燥器的目的是________________________。
(3)实验步骤⑥的目的是_________________________________。
(4)完成一次实验至少应进行称量_____________次。
(5)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有(填入选
项的编号)____________。
A.被测样品中含有加热不挥发的杂质
B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水
D.加热前所用的坩埚未完全干燥
