实验三氧化还原反应
实验要点提示:
· 物质的氧化还原能力的强弱与物质的本性有关, 氧化还原能力通常根据电对的电极电势的高低来判定。
· 氧化还原反应进行的方向、次序、程度, 可以根据氧化剂和还原剂所对应的电对电极电势的相对大小来判定。
?E = E氧化剂电对电势 - E还原剂电对电势 > 0 反应能自发进行
?E = E氧化剂电对电势 - E还原剂电对电势 = 0 反应处于平衡状态
?E = E氧化剂电对电势 - E还原剂电对电势 < 0 反应不能自发进行
· 氧化还原反应总是优先在电极电势差值最大的两个电对所对应的氧化剂和还原剂之间进行。
· 电极电势差值较小的两个电对所对应的氧化剂和还原剂之间能否进行氧化还原反应,应考虑浓度的影响。
· 氧化态或还原态物质与其它的试剂发生化学反应,生成沉淀或形成络合物,从而大大改变了氧化态或还原态物质的浓度,此时,电对的电极电势有较大的变化,应通过奈斯特方程式计算或查表确定其电极电势,再判定氧化还原的反应进行的方向。
· 对于有H+, 或OH-参加电极反应的电对,介质的pH值将对反应有显著的影响。
· 氧化还原反应进行的程度的大小和反应进行的快慢并不一定一致。氧化还原反应进行的程度是对该化学反应一个热力学上的量度, 而氧化还原反应进行的快慢是对该化学反应一个动力学上的量度。氧化还原反应进行的快慢要受到很多其他因素的影响。例如:固液反应时的接触面积。因此, 常加入催化剂加快反应速度。
实验提示:
实验2 (2):
在Na3AsO4与 I- 的氧化还原反应方程式中, 有 H+, 与OH- 参加,因此介质的 pH值将对反应有显著的影响。

由于AsO43- / AsO2- 与 I2 / I- 的氧化还原电对的值相近, 因此, 可以通过改变溶液的酸碱性改变氧化还原反应进行的方向。反应可在同一试管中进行, 先在酸性中观察Na3AsO4与 KI的反应(为了便于观察碘单质的生成与, 常加入CCl4萃取碘),观察碘单质的生成,然后再加入碱溶液使反应液呈碱性,观察碘单质的消失。试验中,酸的加入量应控制在使反应进行即可, 应避免加入过量的酸。 由于含砷的化合物有较高的毒性,反应的废液应回收到指定的回收瓶中,统一处理。如果不慎试液滴在皮肤上,应立即冲洗。
思考题参考答案:
1) H2O2 在遇到更强的氧化剂(E > EH2O2/O2)时, 可以作为还原剂而被氧化; 当遇到更强的还原剂时(EH2O2/O2 > E), 可以作为氧化剂而被还原。具有中间价态的化合物才能既可作氧化剂又可作还原剂。
2) 实验4 的结果可知, 氧化还原进行的程度大小与反应速度的快慢不一定一致氧化还原反应进行的程度是对该化学反应一个热力学上的量度, 而氧化还原反应进行的快慢是对该化学反应一个动力学上的量度。氧化还原反应进行的快慢要受到很多其他因素的影响。例如:固液反应时的接触面积。因此, 常加入催化剂加快反应速度。
3) 介质的酸碱性对于有H+, 或OH-参加电极反应的电对进行氧化还原反应时有显著的影响。具体地说, 在酸性介质中,将增大有氢离子参加的氧化还原电对;在碱性介质中,将增大有氢氧根离子参加的氧化还原电对。KClO3, K2Cr2O7必须在酸性介质中才表现出强氧化性。
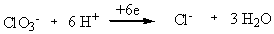
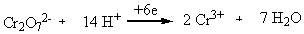
这是由于在KClO3, K2Cr2O7 的氧化还原电对(E KClO3/Cl- EK2Cr2O7/Cr3+)中都有氢离子存在, 因此只有在酸性介质中, 这些氧化电对才表现出强氧化性 。可将KClO3,或 K2Cr2O7 与KI溶液在中性或碱性介质中混合,不能观察到碘单质的生成; 将混合液酸化至酸性, 可观察到碘单质的生成。


第二篇:实验14氧化还原反应

