高一化学学案
粗盐的提纯
课时:1 编写人:卢镇芳 审核人: 编号:02
【学习目标】
1、体验化学检验的基本类型——离子的检验。
2、感受化学方法在物质提纯中常见应用及实践实验中的具体操作。
【问题导学】
情境思考:经过溶解,过滤及蒸发后的食盐能否食用?为什么?
1、经过溶解,过滤及蒸发后的盐是否纯净?如果不纯净的话,杂质是什么?(书第7页第一段)
2、如何检验杂质的存在?并写出操作过程。(第6页实验1—2及初中学过的离子检验)
3.除去杂质,如何选择除杂试剂?依据是什么?
4.对于含多种杂质的混合物而言,如何加入除杂试剂?
【实战演练】1-5必做题,6选做题。
1.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为 ( )
A.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C. 加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D. 加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
2.下列除杂或分离方法不正确的是 ( )
A.用稀硫酸洗掉钢铁表面的铁锈
B.在混有少量铁粉的铜粉中加入足量稀盐酸,充分反应后过滤
C.在KCl和MnO2(不溶于水)的混合物中,加入足量水溶解后过滤
D.在混有少量CuCl2的FeCl2晶体中,加入足量水溶解后过滤
3.某溶液中含有较大量的Cl-.CO32-,OH-三种阴离子,如果只取一次该溶液就能够将三种阴离子依次沉淀出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③ C.①②③②④ D.④②③②①
4.某中学学习小组在帮助老师整理实验室中的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如图)请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验验证。
 1.猜想:这种试剂可能是___________.
1.猜想:这种试剂可能是___________.
2.实验验证:________________.
5.海水通过晾晒可得粗盐,粗盐中除NaCl外,还含有MgCl2,CaCl2 ,Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下
沉淀
 粗盐
粗盐
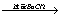
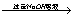
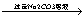


滤液
 精盐
精盐
(1) 在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是_______________
(2) 第②步操作的目的是除去粗盐中的_____________(填化学式,下同),第⑥步操作的目的是除去滤液中的_____________________
(3) 第⑤步“过滤”操作中得到沉淀的成分有:泥沙,BaSO4 Mg(OH)2 ________
(4) 在第③步操作中,选择的除杂试剂NaOH不能用KOH代替。理由是__________
6、有一包白色固体,可能含有NaCl.Na2SO4..BaCl2.和Na2CO3中的一种或几种。为探究其成分,某同学做了如下实验:
(1) 将此白色固体取样,溶解于水,有白色沉淀生成;
(2) 过滤出沉淀并将沉淀移入试管中,加入稀盐酸,沉淀完全溶解并有气体生成:
(3) 向上述滤液中加入硝酸银溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解。
通过上述实验现象分析:该白色固体一定含有的物质是_________________;一定不含有的物质是_____________;不能确定的物质是_____________________.
【你还有什么问题】
第二篇:高一化学学案
氧化还原反应学案
徐智军
一、重难点聚焦
(一)、元素的化合价的判定
(二)、氧化还原反应的特征与本质
(三)、氧化还原反应中的有关概念及相互关系
(四)、氧化还原反应中电子转移的表示方法
(五)、氧化性和还原性及其强弱的判断方法
二、知识整理
(一)、元素的化合价的判定 {复习与归纳}
化合价 。 判定规则:1、单质中元素的化合价为0;
2、在化合物中金属元素的化合价全为正值,非金属元素的化合价一般既有负值又有正值;
3、在化合物中,各元素的正、负化合价的代数和为0
4、离子化合物中,元素的化合价与在生成它们的反应中原子得、失电子数目及离子的电荷数在数值上相等;
共价化合物中,元素的化合价与在生成它们的反应中共用电子对的偏向、偏离的对数在数值上相等。如HCl
判定类型:化合物、复杂阴阳离子、原子团等。如: -NO3、SO42-、SO32-、HSO3-(亚硫酸氢根)、CO32-、HCO3-、ClO3-(氯酸根)、NH4+(铵根)、
MnO4-(高锰酸根)、PO43-(磷酸根)。
(二)、氧化还原反应的特征与本质
以H2还原CuO为例

1



2、降总数相等,得到电子和失去电子总数相等。
3

、特征(或判断依据):元素的化合价是否发生变化。
4、本质:有电子转移(得失或偏移)
5、氧化还原反应与四种基本类型反应的关系为:
置换反应全部属于氧化还原反应,复分解反应全部属于非氧化还原反应, 有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反
应。
(三)、氧化还原反应中的有关概念 ?氧化剂:得电子(或电子对偏向)的反应物。??还原剂:失电子(或电子对偏离)的反应物。
?氧化性:指得电子的能力或性质,氧化剂有氧化性。 ??还原性:
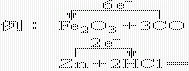
指失电子的能力或性质,还原剂有还原性。
?氧化产物:还原剂发生氧化反应所得到的生成物。??还原产物:氧化剂发生还原反应所得的生成物。联系:
氧化剂(具有氧化性)→所含元素化合价降低→得电子→被还原剂还原→发生还原反应→得还原产物。
还原剂(具有还原性)→所含元素化合价升高→失电子→被氧化剂氧化→发生氧化反应→得氧化产物。
(四)、氧化还原反应中电子转移的表示方法
●双线桥法
1、双箭号从反应物指向生成物,箭号起止所指的均为同一种元素。
2、线上标出得失电子的情况及价的升降、被氧化或被还原等内容。
氧化剂为Fe2O3,还原剂为CO,氧化产物为CO2,还原产物为Fe。
1、箭号由还原剂中失电子的元素指向氧化剂中得电子的元素;
2、线上只标出转移电子的总数。
(五)、氧化性和还原性及其强弱的判断方法
[Ⅰ].氧化性和还原性
氧化性是指物质中某元素的原子具有得电子的能力. 还原性是指物质中某元素的原子具有失电子的能力。 常见的氧化剂:KMnO4,浓H2SO4,浓、稀HNO3,Cl2 常见的还原剂:H2、CO、C、大多数金属。 [Ⅱ].氧化性、还原性强弱的判断方法 1、氧化剂的氧化性>氧化产物的氧化性
还原剂的还原性>还原产物的还原性
例如:
H2
还原剂
+CuO
氧化剂
Cu
还原产物氧化产物
+H2O
则:还原性:H2>Cu 2、(1)随着金属活动顺序表中金属活动性的减弱,金属的还原性越来越弱,
3+
其对应离子的氧化性越来越强.(除Fe外)
??????????????????????
还原性逐渐减弱
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag
????????????????????????
K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe2+、H+、Cu2+、Fe3+、Ag+
氧化性逐渐增强
(2)对于非金属单质
22222??????????????氧化性逐渐减弱
F、Cl、Br、I、S、P、C、Si、H
??????????还原性逐渐增强
F?、Cl?、Br?、I?、S2?
3、从反应条件来比较。一般来讲,一组反应中,反应条件越简单,对应反应
物的氧化性或还原性越强.
(浓MnO2+4HClMnCl2+Cl2↑+2H2O
(浓2KCl+2MnCl2+5Cl↑2KMnO4+16HCl2+8H2O
从反应条件可以看出氧化剂的氧化能力:KMnO4>MnO2>O2
450℃
4HCl+O2
CuCl2
2Cl2+2H2O
三.思考与训练
(一).题例
1、已知反应:AgF+Cl2+H2O→AgCl+AgClO3+HF+O2(未配平),不必配平
此方程式判断:
(1)若Cl2的系数为a,则AgF的系数为_____,判断的依据是________。 (2)若AgClO3的系数为b,O2的系数为c,则AgCl的系数为_______,判
断的依据是________。
(3)在水溶液中NH2H5+离子作Fe3+还原成Fe2+,发生如下反应:
?N2H5?4Fe3??4Fe2??Y??,作为N2H5的氧化产物Y可能是(填写
+
化学式)________。 提示:(1)从产物观察AgCl和AgClO3中, 每个Ag对应一个Cl,而Cl2的
系数为a,Cl原子数为2a,所以AgF的系数为2a.
(2)利用得失电子数相等.
AgF?Cl2?H2O?xAgCl?bAgClO3?HF?cO2
?x
?5b
?4c
-2
-1
?5
x=5b+4c
?
?4Fe3??4Fe2??Y??,若两个-2价的N同时升高到x价,(3)N2H5
-2
则化合价升高了2(x+2),化合价降低了4,2(x+2)=4. 故x=0,产物为N2。
答案:(1)2a;质量守恒
(2)5b+4c;得失电子数相等 (3)N2
2、三聚氰酸C3N3(OH)3可用于消除汽车尾气中的氮氧化物(如NO2)。当加热
至一定温度时,它发生如下分解:C3N3(OH)3=3HNCO,HNCO(异氰酸,其结构是H—N=C=0)能和NO2反应生成N2、CO2和H2O。写出HNCO和NO2反应的化学方程式。分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目。
提示:判断HNCO中各元素价态,H为+1价,O为-2价,N为-3价,C为+4价,HNCO中的氮由-3价上升到0价被氧化。
-答案:
+8CO2+4H2O
HNCO中氮元素被氧化,NO2中的氮元素被还原。
(二)感觉自我:
1、下列反应一定属于氧化还原反应的是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应 2、下列变化中,需要加入氧化剂的是( )
A.SO2→SO3 B.HCl→H2 C.FeCl2→FeCl3 D.Fe2O3→Fe
3、按金属活动性顺序由前到后考虑,下列说法中正确的是( )
A.单质的还原性逐渐减弱 B.原子的失电子能力逐渐增强 C.对应离子的氧化性逐渐增强 D.对应离子的得电子能力逐渐减弱 4、下列反应中,盐酸只作氧化剂的是( )
A.Zn+2HCl=ZnCl2
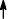
+H2↑
B.MnO2+4


得×MnCl2+Cl+2H2O
C.Cl2+H2O=HCl+HClO
D.CaCO3+2HCl=CaCl2+H2O+CO2 5、下列叙述中,正确的是( )
A.同一反应中,氧化剂的氧化性比氧化产物的氧化性强 B.同一反应中,还原剂的还原性比还原产物的还原性弱 C.由X原子变成X2+的反应是氧化反应 D.由X原子变成X2+,需加入还原剂
6、在3Cl2+8NH3=6NH4Cl+N2反应中,还原性最强的物质是( )
A.Cl2 B.NH3 C.NH4Cl D.N2 7、下列关于氧化还原反应的叙述中正确的是( )
A.金属单质在反应中只作为还原剂 B.非金属单质在反应中只作为氧化剂 C.金属原子失电子越多,还原性越强
D.Cu2+比Fe2+氧化性强,Fe比Cu还原性强
8、一个A原子转移两个电子给两个B原子,下列说法中正确的是( )
A.形成化合物AB2,A是氧化剂 B.形成化合物A2B,A被还原 C.形成化合物AB2,B被还原 D.形成化合物AB2,B有氧化性 9、某反应的化学方程式为:aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O,
若b=1,d=3,则X的化学式为( )
A.N2 B.NO C.NO2 D.NH4Cl
10、有反应BrO3
:
?
5Cl2?I2?6H2O?2HIO3?10HCl;
?
ClO3?5Cl??6H??3Cl2?3H2O。
?
?Cl2?Br2?2ClO3;
依据上述方程式,下列微粒氧化能力排列顺序正确的是( )
??????
A.ClO3 ?BrO3?IO3?Cl2 B.BrO3?Cl2?ClO3?IO3??????C.BrO3 D.Cl2?BrO3 ?ClO3?Cl2?IO3?ClO3?IO3
(二)超越自我
11、在8NH3+3Cl2=N2+6NH4Cl反应中,若有21.3g Cl2参加反应,则被氧化
的NH3的质量为( )
A.13.6g B.10.2g C.6.8g D.3.4g
n?n?
12、R2O8离子在一定条件下可把Mn2+氧化成MnO?4,若反应后R2O8变成
?n?
RO24,又知反应中氧化剂与还原剂的离子个数比为5:2,则R2O8中R
元素的化合价为( )
A.+3 B.+5 C.+6 D.+7
13、一定条件下硝酸铵受热分解的未配平化学方程式为:NH4NO3——HNO3+N2
+H2O,在反应中被氧化与被还原的氮原子之比为( )
A.1:1 B.5:4 C.5:3 D.3:5 14、下列叙述中,正确的是( )
A.含氧酸能起氧化作用,无氧酸则不能 B.阳离子只有氧化性,阴离子只有还原性
C.失电子难的原子获得电子的能力一定强
D.由X变为X2+的化学反应是氧化反应
15、下列对盐酸的有关性质叙述正确的是( )
A.有酸性,没有氧化性和还原性
B.有酸性和氧化性,没有还原性
C.有酸性和还原性,没有氧化性
D.有氧化性和还原性,还有酸性
参考答案
1、C 2、AC 3、AC 4、A 5、AC 6、B 7、AD 8、CD
9、B 10、C 11、D 12、D 13、C 14、D 15、D
四.拓展与探究——————氧化还原反应的类型
请自己分析与归纳:(下面分类仅供参考)
1、不同物质间的氧化还原反应
(1)全部氧化还原反应(变价元素的所有原子的价态发生变化)
(2)部分氧化还原反应(变价元素的原子只有部分价态发生变化)
2、同一物质内不同元素间的氧化还原反应
3、两种以上元素间的氧化还原反应
4、同种元素间的氧化还原反应
