第八单元 海水中的化学
重点:
1、海水制镁的过程及原理,相应的方程式。
2、海水淡化的方法,了解蒸馏的原理,工业常用多级闪急蒸馏法。理解饱和溶液和不饱和溶液的概念、组成特点及相互转化的条件。知道结晶的概念。
3、海水晒盐的原理和过程。
4、粗盐提纯(除去食盐中可溶性杂质及不溶性杂质)的方法和应用及相应的方程式。食盐的精制
5、 “溶解度”的概念(定量),溶解度曲线图的运用;选择蒸发结晶或降温结晶等方法进行物质的提纯。
6、氨碱法制取纯碱的反应原理和过程(方程式),侯氏制碱法。
7、碳酸钠、碳酸氢钠等物质的俗名和性质
8、常见酸根离子的检验。
9、复分解反应的实质。
第一节 海洋化学资源
一、海水中的物质:(1)物质种类:水(96.5%)和可溶性盐(3.5%)
(2)离子种类:Cl- 、Na+ 、SO42 -、Mg2+、Ca2+、K+
二、海底矿物:
1、化石燃料:煤、石油、天然气
2、新型矿产资源:天然气水合物(可燃冰)―未来能源、21世纪能源。
甲烷燃烧的方程式:CH4+2O2=点燃==CO2+2H2O
3、多种金属矿物:多金属结核(锰结核:猛、铁、铜、钴、钛等20多种金属元素)
三、海洋资源:
(1)分类:化学资源、矿产资源、动力资源、生物资源。
(2)保护措施:海洋环境立法、建立海洋自然保护区、加强海洋环境监测、提高消除污染的技术水平。
第二节、海洋工业
一、海水制镁:
1、原理:将石灰乳加入海水或卤水中,沉淀出氢氧化镁,氢氧化镁再与盐酸反应生成氯化镁,电解熔融状态的氯化镁,就能制得金属镁。
2、生产流程:海水或卤水→氢氧化镁→氯化镁→氯化镁晶体→熔融氯化镁→镁
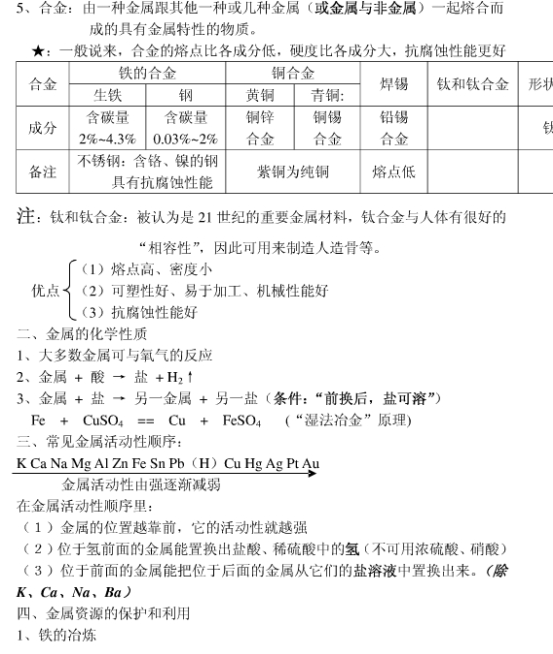
3、化学方程式: MgCl2+Ca(OH)2=Mg (OH)2↓+CaCl2
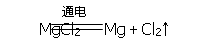 Mg (OH)2+2HCl=MgCl2+2H2O
Mg (OH)2+2HCl=MgCl2+2H2O
注意:从海水中提取MgCl2时,经历了“MgCl2→Mg (OH)2→MgCl2”,的转化过程,这样做的目的是: 将MgCl2富集起来,获得比较纯净的MgCl2.
二、海水淡化:
从海水中获取淡水,解决日益加剧的淡水危机
1、淡化的方法有(1)热法(2)膜法(反渗透法)。(都是物理方法),热法中常见的有低温多效蒸馏法和多级闪急蒸馏法。其中最常用的是多级闪急蒸馏法。
2、海水与淡水的鉴别:分别取样加入硝酸银溶液和稀硝酸,产生大量白色沉淀的是海水,没有沉淀(或沉淀很少)的是淡水。
三、海水晒盐:
从海水中获取食盐,解决生产(工业)、生活中需求的大量食盐
1、原理:蒸发海水使其中的无机盐(主要是食盐)结晶。
2、生产流程:海水→蒸发池→结晶池→粗盐和母液(又称苦卤)。
原料也可采用海水淡化后的残液晒盐,更经济快捷。
四、粗盐提纯:
1、粗盐成分:主要成分:氯化钠
杂质:不溶性杂质(泥沙)
可溶性杂质(Na2SO4、MgCl2、CaCl2)
(1)、除去粗盐中的不溶性杂质(泥沙):
步骤:溶解→过滤→蒸发结晶。反复几次可提高其纯度(重结晶法提纯粗盐)。
(2)、可溶性杂质(Na2SO4、MgCl2、CaCl2)→转化为沉淀→过滤
A、 药品选择:①Na2SO4→过量BaCl2
②MgCl2→过量NaOH
③CaCl2、多余BaCl2→过量Na2CO3
④多余的NaOH、Na2CO3→适量盐酸
B、加入顺序:①、②、③、过滤、④、蒸发结晶;
②、①、③、过滤、④、蒸发结晶;
注意:a.Na2CO3必须在BaCl2之后加;
b.过滤之后再加盐酸。
重结晶法提纯粗盐的步骤:溶解→过滤→蒸发结晶。反复几次可提高其纯度,但这样主要是除去不溶性杂质,若彻底将不溶性和可溶性杂质依次除去,应采取:“溶解→过滤→加入相应化学试剂→过滤→加适量或过量盐酸→蒸发结晶。”的步骤。
五、海水制碱:
1、氨碱法制纯碱
(1)原料:食盐、石灰石。氨气为媒介。
(2)生产流程:盐水→精盐水→氨盐水→碳酸氢钠→碳酸钠(纯碱)
(3)、化学反应原理:NaCl+NH3+CO2+H2O==NaHCO3+NH4Cl
2 NaHCO3==△=== Na2CO3+H20+CO2↑
注意:(1)氨盐水比食盐水更易吸收二氧化碳的原因是氨溶于水显碱性,而二氧化碳溶于水显酸性,二者能发生反应,因此氨盐水比食盐水更易吸收二氧化碳
(2)对生成的NaHCO3和NH4Cl都能溶于水,分离的问题:从课本中溶解度曲线图上查出在室温时氯化铵比碳酸氢铵溶解度大,因此碳酸氢铵先结晶析出。
(3)氨碱法制纯碱的优点: 原料经济易得,CO2和NH3可回收利用连续生产。反应:2NH4Cl+ Ca(OH)2===CaCl2+H2O+NH3↑
缺点:氯化钠的利用率不高,得到的CaCl2用途不大,污染环境。
2、侯氏制碱法(联合制碱法)
我国化学家侯德榜改进了氨碱法的不足,创立了联合制碱法。在反应得到的氯化铵溶液中加入食盐,使氯化铵结晶析出。
第三节、溶解度
一、固体和气体的溶解度
1、固体溶解度
在一定温度下,某固体物质在100g溶剂(通常是水)里达到饱和状态时所能溶解的质量。单位:克,
溶解度的涵义:一定温度下,100g溶剂中最多溶解物质的质量。
例如:20℃时,氯化钠的溶解度是36g.涵义:20℃时,100g水中最多溶解36g氯化钠.或20℃时,100g水中溶解36g氯化钠时达到饱和。
2、气体的溶解度
在一定温度和压强下1体积水中溶解的气体的体积数。
注意:描述物质的溶解度时,必须指明温度。如:“硝酸钾的溶解度是31.6g”是错误的。
二、影响溶解度的因素:
1、影响固体溶解度的因素
(1)内因:溶质、溶剂的性质。
(2) 外因:温度。
①大多数固体物质的溶解度随温度的升高而增大。如:硝酸钾
②少数固体物质的溶解度随受温度的影响很小。如:氯化钠
③极少数固体物质的溶解度随温度的升高而减少。如:氢氧化钙
2、影响气体溶解度的因素:
⑴ 内因:溶质、溶剂的性质。
⑵ 外因:温度、压强。
①温度升高,气体溶解度减小。②压强增大,气体溶解度增大。
三、溶解度曲线
1、溶解度曲线的含义。
①溶解度曲线表示某物质在不同温度下的溶解度及溶解度随温度的变化趋势。
②溶解度曲线上的一点表示溶质在该温度下的溶解度,溶液为饱和状态。
③溶解度曲线上方的一点表示溶质在该温度下有剩余,溶液为饱和状态。
④溶解度曲线下方的一点表示在该温度下溶液为不饱和状态。
⑤两条曲线的交点表示两种物质在对应温度下具有相同的溶解度。
2、曲线的应用:
①查找指定温度时物质的溶解度,并根据溶解度判断溶解性。
②比较相同温度时不同物质溶解度的大小。
③比较和确定物质的溶解度受温度影响的程度,确定物质结晶或混合物分离提纯的方法。
④确定溶液的饱和状态。
⑤进行有关的计算。
3、溶解度与溶解性的关系:
难溶(0.01g)、微溶(0.01~1g)、可溶(1~10g)、易溶(10g)
图示表示: 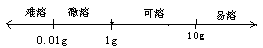
四、结晶
1、定义:固体物质从它的饱和溶液中以晶体的形式析出的过程。
2、方法: ⑴ 蒸发结晶。适用于溶解度随受温度的影响很小的物质。
⑵ 降温结晶。适用于溶解度随温度的升高而增大的物质
第四节、盐
一、常见盐的俗名、性质及用途
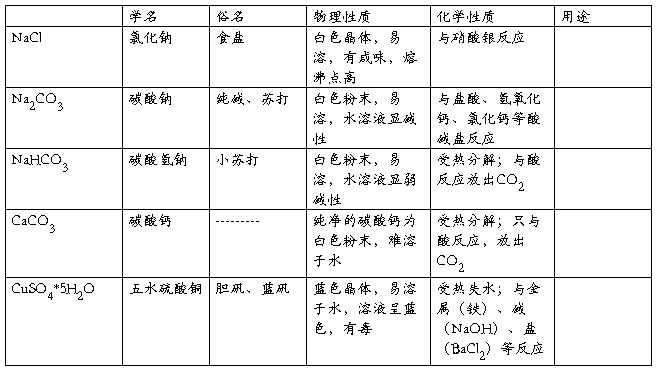
二、盐的通性
1、盐的溶解性:钾、钠、铵盐均可溶,硝酸盐入水无踪影,硫酸盐不溶钡和铅,盐酸盐不溶银和汞;碳酸盐,磷酸盐除去钾、钠、铵盐其余均不溶。
2、彩色盐溶液:含铜离子的盐溶液为蓝色,;含铁离子的盐溶液为棕黄色,含有亚铁离子的溶液为浅绿色。其它离子的盐溶液为无色。(溶液的颜色)
3、盐的化学性质
(1) 盐+金属→新盐+新金属
条件:金属活动性顺序中前面的金属可将其后面的金属从它们的盐溶液中置换出来。 Fe+CuSO4===Cu+FeSO4
现象:铁制品表面附着一层红色物质,溶液颜色变浅(或变为浅绿色)
Cu+2AgNO3===2Ag+Cu(NO3)2
现象:铜制品表面附着一层银白色物质,溶液由无色变为蓝色。
(2) 盐+酸→新盐+新酸
条件:盐可溶也可不溶,生成物中一定有水、气体或沉淀
Na2CO3+2H2SO4==2Na2SO4+H2O+CO2↑ CaCO3+2HCl==2CaCl2+H2O+CO2↑
现象:有气泡产生
(3) 盐+碱→新盐+新碱
条件:反应物都可溶,生成物有沉淀或气体
Na2CO3+Ca(OH)2==2NaOH+ CaCO3↓ 现象:产生白色沉淀。
2NH4Cl+ Ca(OH)2=== CaCl2+ H2O+NH3↑现象:产生刺激性气味的气体
(4) 盐+盐→新盐+新盐
条件:反应物都可溶,生成物有沉淀
Na2CO3+BaCl2==2NaCl+BaCO3↓
Na2SO4+BaCl2==2NaCl+BaSO4↓
三、酸根离子的检验
1、氯离子:溶液中加入硝酸银溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶解,证明有氯离子。
2、硫酸根离子:溶液中加入硝酸钡溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶解,证明有硫酸根离子。
3、碳酸根离子:溶液中加入稀盐酸,若产生使澄清石灰水变浑浊的气体,证明有碳酸根离子。
第二篇:初中化学知识点总结(第八单元)
第八单元 金属和金属材料