初中化学各单元知识点小结
第一单元:走进化学世界
第一单元
化学史--原子分子论-近代化学基础—道尔顿和阿伏加德罗
元素周期律-化学学习和研究变得有规律-门捷列夫
化学实验基本操作
( 要求:认识常见仪器、正确操作方法及错误操作的后果)
要求:1.熟记化学史
2.认识课本上出现的仪器和基本操作及错误操作的后果
第二单元:空气

(知道影响分子、原子运动快慢、分子间隔大小的因素)
要求:1.知道分子、原子、离子都是构成物质的粒子
2.分子和原子区别与联系
3.能用分子、原子的三个基本性质解释日常生活中现象
4.能用分子原子(微观角度)解释物理变化和化学变化
第四单元 物质构成的奥秘
1.原子的构成(质子、中子、电子)
物质构成的奥秘
(核电荷数=核内质子数=核外电子数)
(相对原子质量-不是原子的实际质量)
2.元素(由质子数决定)
[概念、存在(地壳、空气、人体中)]
3.元素周期表(能看懂元素周期表)
4.化合价--应用
要求:1.知道原子是由质子、中子、电子构成的
2.能够识别原子结构示意图
3.记住元素的化学性质决定于最外层电子数;金属元素、非金属元素、稀有气体元素原子结构的特点。
4.知道元素符号的意义(两种)
5.不同元素间的本质区别—质子数不同
6.会判断单质、化合物、氧化物、纯净物、混合物
(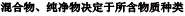 )
)
7.能根据化学式推断某元素的化合价、会根据化合价确定化学式是否正确
(记住常见元素和原子团的化合价和化合价的五条规律)
第五单元:化学方程式
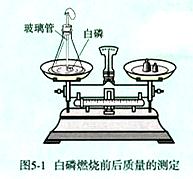
质量守恒定律
1.概念(反应物和生成物前后质量不变)
2.原因(三不变-原子种类、数目、质量反应前后不变)
3.化学方程式有关计算
要求:1.质量守恒定律的测定方法(称量反应前后参加反应和生成的物质质量总和)
(有气体参加或生成应在密封容器中)
2.质量守恒定律适用任何化学反应
3.能用质量守恒定律解释化学变化
4.会运用质量守恒定律的本质(三不变)推断反应前后元素的种类及某物质的化学式
第六单元 碳和碳的氧化物

要求:1.掌握碳的化学性质的化学方程式(稳定性、可燃性和还原性)
2.二氧化碳制取和化学性质的化学方程式
3.二氧化碳的用途-灭火、致冷剂、温室气体肥料(原理)
4.一氧化碳性质的化学方程式(可燃性、还原性、毒性)
5.能熟练完成下列各化学方程式
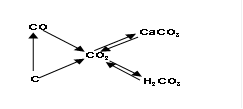
注意:1.碳的稳定性
2.一氧化碳的毒性(原因、检验和尾气处理方法)
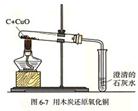
3.二氧化碳的检验(石灰水或小木条)
4.石灰石、大理石、水垢、蛋壳的主要成分(CaCO3)
5.水垢的清处方法
6.二氧化碳是否是紫色石蕊试液变红原因的探究
第七单元燃料及应用
一.燃烧和燃烧的条件
1.燃烧:可燃物与氧气发生的一种发光.发热的剧烈的氧化反应。
注意:燃烧都是氧化反应
2.燃烧的条件
可燃物
跟氧气(空气)接触
温度达到着火点
注意:燃烧条件的探究实验
3.爆炸和爆炸的条件
爆炸:可燃物在有限空间内发生急剧燃烧,可引起爆炸
爆炸的条件:有限空间内、发生急剧燃烧
4.灭火的原理和方法
原理:破坏燃烧的条件,使燃烧反应停止,
常用的灭火器你知道有哪些吗?
5.燃料燃烧的方法:
(1)有足够的空气(氧气)
(2)增大与空气(氧气)接触面积
6.化学反应中的能量变化
二、化石燃料(煤、石油、天然气)
注意:沼气的制取和燃气的安全使用常识
三、乙醇汽油-汽油中加入适量的乙醇
注意:1.乙醇汽油:含碳、硫、氮量都比汽油等石油产品低,燃烧产物中的烟尘、一氧化碳、氮氧化合物等有害物质减少
2.乙醇的制取方法
3.工业酒精中因含有甲醇,有剧毒
第八单元 金属和金属材料

要求:注意做题思路---紧扣溶质质量分数的概念
第十、十一单元:酸、 碱、 盐、化肥
酸
一、酸的通性:(酸=H++酸根离子)
1.跟酸碱指示剂的作用(常用的指示剂-石蕊和酚酞)
2.酸+活泼金属==盐+氢气
注:①掌握Mg、Al、Zn、Fe和盐酸、稀硫酸的反应 ②铁显+2价
3.酸+金属氧化物==盐+水
注:金属表面的锈大多数都是金属氧化物
4.酸+碱==盐+水
注:中和反应及应用
5.酸+盐==新酸+新盐
二、常见的酸
1.盐酸(氯化氢气体的水溶液-混合物;挥发性酸)
2.硫酸:浓硫酸的特性:1.吸水性--可做干燥剂2.脱水性--有强腐蚀性
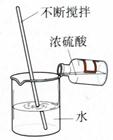
(掌握浓硫酸的稀释方法)
3.盐酸、硫酸用途
三、pH—酸碱度的表示法
1.表示法--pH
2.pH的通常范围:0-----14
3.测定工具和方法:pH试纸
4.了解酸碱度(pH)的意义
碱
一、碱的通性(碱=OH-+金属离子)
1.跟酸碱指示剂作用
2.碱+非金属氧化物==盐+水
掌握CO2、SO2、SO3与碱的反应(切记CO不能跟碱反应)
3.碱+酸==盐+水
4.碱+盐==新碱+新盐
二、常见的碱
1. 氢氧化钠(NaOH)
(掌握俗名、物理性质、用途、保存方法)
2. 氢氧化钙[Ca(OH)2]
(掌握俗名、物理性质、用途、制法)
盐:
一、盐的性质
盐+金属===新盐+新金属
盐+酸====新盐+新酸
盐+碱====新盐+新碱
注意:复分解反应条件
二、常见的盐
1.氯化钠(NaCl)俗名:食盐
A.用途:融雪剂、调味品、生理作用、防腐剂
B.粗盐提纯:溶解—过滤—蒸发(注意操作方法)
2.碳酸钠、碳酸氢钠、碳酸钙(熟记各种盐的俗名)
用途A.碳酸钠(Na2CO3)玻璃、造纸、纺织和洗涤剂
B.碳酸钙(CaCO3)建筑材料、补钙剂
C.碳酸氢钠(NaHCO3)发酵粉、治疗胃酸过多
注意:1.碳酸钠、碳酸氢钠都属于盐但水溶液显碱性
2.会写碳酸钠、碳酸氢钠、碳酸钙跟盐酸反应的化学方程式
3.有关酸、碱、盐的几个重要的化学方程式
除铁锈:Fe2O3+2HCl=FeCl3+H2O
除水垢、制二氧化碳:CaCO3+2HCl=CaCl2+CO2↑+H2O
制烧碱:Na2CO3+Ca(OH)2=CaCO3+2NaOH
制熟石灰:CaO+H2O=Ca(OH)2
烧碱变质:CO2+ 2NaOH= Na2CO3+ H2O
检验CO2和石灰水变质:CO2+ Ca(OH)2=CaCO3↓+H2O
4.熟记酸、碱的通性和盐的性质(注意记忆方法)
5.亚硝酸钠有剧毒,可做防腐剂
6.浓酸、浓碱事故的处理方法
三、化学肥料:
1. 化学肥料的种类和主要作用
2. 化肥、农药的污染
3. 化肥的鉴别(重点的铵态氮肥)
四、书写化学方程式的方法
①金属和酸反应时,金属必须排在氢前面
①金属和盐反应时,金属必须排在盐中金属的前面前面(铁和酸、盐反应显十2价;钾、钙、钠和盐不发生置换反应)
③酸、碱、盐之间的反应一般属于复分解反应。要熟记复分解反应的条件
④浓硫酸、硝酸不能和金属发生置换反应。
五、一些物质的特牲
1.凡是碳酸盐都能跟酸反应,生成二氧化碳
2.一些重要物质的颜色
A.氢氧化铜[Cu(OH)2沉淀为蓝色(由铜盐溶液和碱反应生成)],氢氧化铁(Fe(OH)3沉淀为红褐色(由铁盐溶液和碱反应生成) ;其它沉淀为白色
B.铜盐溶液为蓝色,铁盐溶液为黄色,亚铁盐溶液为浅绿色,其它溶液为无色。
五、几种离子的检验:
1.氯离子(Cl-);2.硫酸根离子(SO42-); 3.碳酸根离子(CO32-)4.铵根离子(NH4+)
5.铁离子(Fe3+); 6.铜离子(Cu2+); 7.氢离子(H+)8.氢氧根离子(OH-)
六、几种气体的检验
氢气(H2)、氧气(O2)、二氧化碳(CO2)、一氧化碳(CO)、甲烷(CH4)、空气
第十二单元 化学与生活
一、营养素:
1.种类:蛋白质、糖类、油脂、维生素、无机盐和水通常称为营养素

(4)维生素:缺乏:VA:夜盲症、VC:坏血病
(注意:主要存在于水果和蔬菜中)
(5)钠、钾对人体健康的影响
Na+、 K+保持一定浓度可维持恒定的pH。是人体维持正常生命活动的必要条件。
二、有机化合物和有机高分子化合物:
1.有机化合物和无机化合物:
注意:A.有机化合物的数目非常多 B.碳的氧化物、碳酸和碳酸盐属于无机化合物
2.有机高分子化合物和有机高分子材料
A.有机高分子化合物:相对分子质量很大(几万-几百万)的有机化合物
B.有机高分子材料:用有机高分子化合物制成的材料。(塑胶、合成纤维、合成橡胶)
3.高分子化合物大部分是由小分子聚合而成的。
链状(热塑性) 网状(热固性)
4.天然纤维和合成纤维鉴别方法:
点燃:无明显气味,产生粉末灰烬的是棉花;有烧焦羽毛气味的是羊毛;结成难粉碎的球状有刺激性气味的是化纤。
5.白色污染的原因和危害
白色污染:废旧塑料难降解
白色污染危害:破坏土壤、污染地下水、危害海洋生物,含氯塑料焚烧产生氯化氢气体,污染空气。
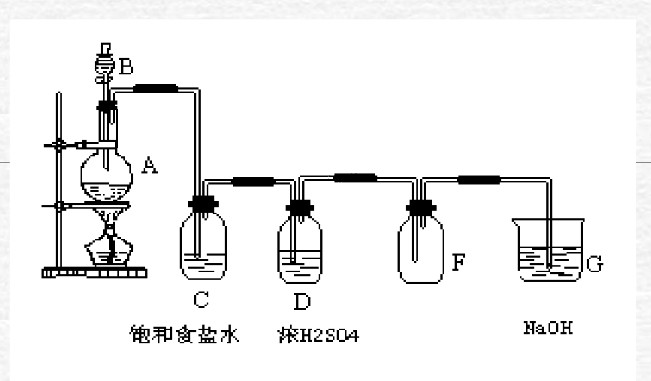
课本上的几个重要装置图(你知道它们的用途吗)
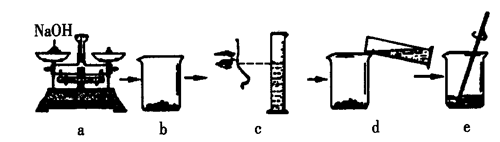
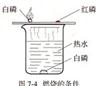
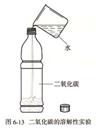
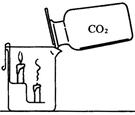

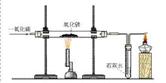



第二篇:初中化学第八单元知识点
第八单元知识点
一、金属材料
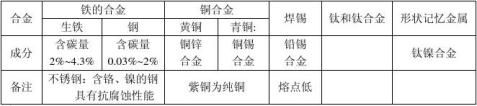
纯金属(90多种) 1、金属材料
合金 (几千种)
2、金属的物理性质: 1)常温下一般为固态(汞为液态),有金属光泽。
(2)大多数呈银白色(铜为紫红色,金为黄色) 3)有良好的导热性、导电性、延展性
3、金属之最:
(1)铝:地壳中含量最多的金属元素 (2)钙:人体中含量最多的金属元素
(3)铁:目前世界年产量最多的金属(铁>铝>铜) (4)银:导电、导热性最好的金属(银>铜>金>铝) (5)铬:硬度最高的金属 (6)钨:熔点最高的金属 (7)汞:熔点最低的金属 (8)锇:密度最大的金属 (9)锂 :密度最小的金属 4、金属分类:
黑色金属:通常指铁、锰、铬及它们的合金。 重金属:如铜、锌、铅等
轻金属:如钠、镁、铝等;
有色金属:通常是指除黑色金属以外的其他金属。
5、合金:由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属
特性的物质。
注:钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,
因此可用来制造人造骨等。 (1)熔点高、密度小
优点(2)可塑性好、易于加工、机械性能好 3)抗腐蚀性能好 二、金属的化学性质
1、大多数金属可与氧气的反应 2、金属 + 酸 → 盐 + H2↑
3、金属 + 盐 → 另一金属 + 另一盐(条件:“前换后,盐可溶”) Fe + CuSO4 == Cu + FeSO4 (“湿法冶金”原理)
三、常见金属活动性顺序: K Ca Na Mg Al Zn Fe Sn Pb(
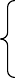
H)金属活动性由强逐渐减弱
在金属活动性顺序里:
(1)金属的位置越靠前,它的活动性就越强
(2)位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)
(3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。(除K、Ca、Na、Ba)
四、金属资源的保护和利用
1、铁的冶炼
(1)原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。 3CO + Fe2O3高温2
(2)原料:铁矿石、焦炭、石灰石、空气
常见的铁矿石有磁铁矿(主要成分是Fe3O4 )、赤铁矿(主要成分是Fe2O3 )
2、铁的锈蚀
(1)铁生锈的条件是:铁与O2、水接触(铁锈的主要成分:Fe2O3)
(铜生铜绿的条件:铜与O2、水、CO2接触。铜绿的化学式:Cu2(OH)2CO3)
(2)防止铁制品生锈的措施:
①保持铁制品表面的清洁、干燥
②表面涂保护膜:如涂油、刷漆、 电镀、烤蓝等
③制成不锈钢
铁锈很疏松,不能阻碍里层的铁继续与氧气、水蒸气反应,因此铁制品可以全部被锈蚀。因而铁锈应及时除去。
而铝与氧气反应生成致密的氧化铝薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
3、金属资源的保护和利用:
保护金属资源的途径:
①防止金属腐蚀
②回收利用废旧金属
③合理开采矿物
④寻找金属的代用品
意义:节约金属资源,减少环境污染
