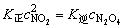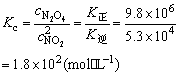第一节 化学反应速率
1、(云南省竞赛题)将10 mol A和5 mol B放入10 L真空箱中,某温度下,发生反应:3A(g)+B(g)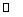 2C(g)。在最初0.2s内,消耗A的平均速率为0.06 mol/(L·s)。则在0.2s时,箱中有________mol C生成。
2C(g)。在最初0.2s内,消耗A的平均速率为0.06 mol/(L·s)。则在0.2s时,箱中有________mol C生成。
大量实验证明:对于一般的化学反应:aA+bB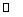 dD+Ee,
dD+Ee,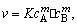 其中K为速率常数,这个定量关系式叫做质量作用定律。同一反应在不同的温度、催化剂等条件下,其K值不同。
其中K为速率常数,这个定量关系式叫做质量作用定律。同一反应在不同的温度、催化剂等条件下,其K值不同。
反应级数=n+m(不一定是a+b)。反应级数可以是整数、分数,也可以是零。
解析:vA︰vB︰vC=3︰2︰1,由vA=0.06mol/(L·s),可确定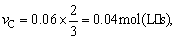 由速率计算公式
由速率计算公式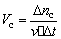 得C生成物的物质的量为△nc=vc·△t·v=0.04×0.2×10=0.08(mol)。
得C生成物的物质的量为△nc=vc·△t·v=0.04×0.2×10=0.08(mol)。
2、(贵州竞赛题)有一化学反应:aA+Bb=C,在298K时将A、B溶液按不同浓度混合,有以下实验数据:
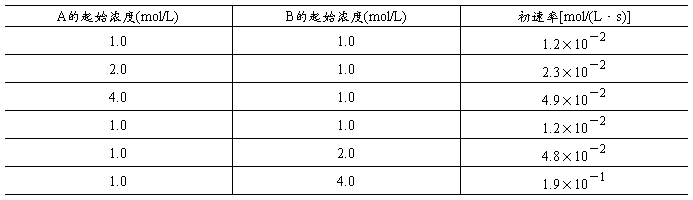
求该反应的速率方程式和速率常数。
解析:反应的速率方程式可写为
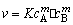
前面三次实验,B的浓度保持不变,而改变A的浓度,当A的浓度增大为原来的x倍,反应速率也增加为原来的x倍。由实验结果看出,反应速率与A浓度与正比,因此m=1。后面三次实验保持A的浓度不变而改变B的浓度。当B的浓度增大为原来的x倍时,反应速率增大为原来的x2倍,说明反应速率与B浓度的平方成正比,则n=2。因此,该反应的速率方程式为v=KcA· ,它是三级反应。
,它是三级反应。
代入任一组数据,即可求出速率常数。

3、(重庆竞赛题)298K时N2O5(g)分解作用的半衰期为5小时1分,此值与N2O5的起始压力无关。试求:
①速率常数 ②作用完成90%所需时间(以小时为单位)。
解析:①半衰期与起始压力无关,说明是一级反应。
②
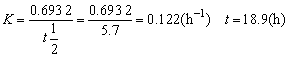
4、放射性同位素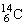 蜕变后成为稳定同位素。起始时(t=0),有N0个
蜕变后成为稳定同位素。起始时(t=0),有N0个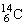 原子,蜕变到终态时(t=t),则剩有N个
原子,蜕变到终态时(t=t),则剩有N个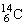 。已知
。已知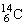 蜕变到只剩一半所需的时间(t1/2)是5 668年。某考古队从古墓中挖掘出一具男尸,经测试发现他衣服上的
蜕变到只剩一半所需的时间(t1/2)是5 668年。某考古队从古墓中挖掘出一具男尸,经测试发现他衣服上的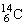 放射性强度仅为
放射性强度仅为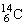 原始量的62.7%,试估算该男尸的生活年代(提示:放射性同位素的蜕变为一级反应)。
原始量的62.7%,试估算该男尸的生活年代(提示:放射性同位素的蜕变为一级反应)。
解析:因为是一级反应,所以可用公式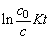
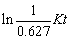

5、2N2O5(g)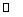 2N2O4(g)+O2(g)反应速率方程式为
2N2O4(g)+O2(g)反应速率方程式为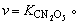 在一定温度下,K=1.68×10-2s-1,现将2.5 mol的N2O5放置在5 L容器中,求:①1分钟时的反应速率。②通过计算,说明浓度对反应速率的影响。
在一定温度下,K=1.68×10-2s-1,现将2.5 mol的N2O5放置在5 L容器中,求:①1分钟时的反应速率。②通过计算,说明浓度对反应速率的影响。
解析:①因为 所以该反应为一级反应。
所以该反应为一级反应。
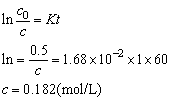
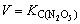 =1.68×10-2×0/182=3.06×10-3 mol/(L·s)
=1.68×10-2×0/182=3.06×10-3 mol/(L·s)
②此例说明:
t=0, c=0.5 mol/L, v0=1.68×10-2×0.5=8.4×10-3 mol/(L·s)
t=60, s,c=0.182 mol/L, v=3.06×10-3 mol/(L·s)
所以 以越大,反应速率越快。反之,浓度越小,反应速率越慢。
6、污染空气中,生成臭氧的反应机理如下:
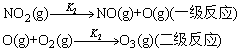
已知K1=6.0×10-3 s-1, K2=1.0×106 dm3·mol-1·s-1,污染空气中NO2与O2的浓度分别为3.0×10-9 mol/dm3与1.0×10-2 mol·dm-3。假定原子氧的浓度趋于某种“稳定状态”,即一种恒定的低浓度状态,在这种情况下,氧在第二个反应中的消耗速率恰与它在第一个反应中的产生速率相等。
(1)计算污染空气中O(g)的稳定浓度。
(2)计算污染空气中O3的生成速率。
(3)若臭氧的生成速率不变,求25℃与1atm下,需经过多长时间臭氧的浓度可达到空气中臭氧的万分之一?(在上述条件下,空气中O3含量为0.04 mol/dm3左右)。
解析:(1)v1=K1C(NO2)=6.0×10-3×3.0×10-9=1.8×10-11 mol/(dm3·s), v1=K2[O][O2]由给定条件知:
O(g)在第二个反应中的消耗速率与它在第一反应中的产生速率相等,即v1=v2,因此有1.8×10-11 = K2[O][O2]
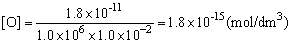
(2)O3的生成速率:
v=K2[O][O2]=1.0×106×1.8×10-15×1.0×10-2
=1.8××10-11 mol/(dm3·s)
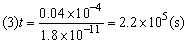
第二节影响化学反应速率的因素
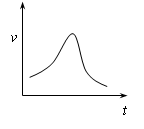 1、氯酸钾和亚硫酸氢钠起氧化还原反应生成Cl(-1价)和S(+6价)的速率如右图所示。又知这个反应速率随着溶液中[H+]增大而加快。求:(1)为什么反应开始时反应速率加快? (2)为什么后期反应速率下降?
1、氯酸钾和亚硫酸氢钠起氧化还原反应生成Cl(-1价)和S(+6价)的速率如右图所示。又知这个反应速率随着溶液中[H+]增大而加快。求:(1)为什么反应开始时反应速率加快? (2)为什么后期反应速率下降?
解析:此题牵涉的知识点一是影响反应速率的因素,另一知识点是借助已有知识,推出氧化还原反应产物。可以将问题(1)作为已知考虑, 开始时反应速率加快,有哪些因素能引起溶液中反应速率加快呢?①增加浓度;②增压;③升温;④加正催化剂。联系题意可排除②④,由于题意中不涉及热量变化,故不需考虑③。接下来考虑①,但题中无外加物,所以只考虑[H+]变化。KClO3—Cl,NaHSO3→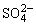 +H+,[H+]增大,反应速率v增大。
+H+,[H+]增大,反应速率v增大。
解析:(1)2KClO3+6NaHSO3=3Na2SO4+2KCl+3H2SO4
[H+]增大,反应速率加快。
(2)生成的H+与反应物中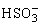 反应,导致
反应,导致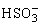 浓度减小,速率减慢。
浓度减小,速率减慢。
2、阿累尼乌斯(Arrhenins)总结了温度与反应速率常数间的关系。对于指定化学反应在不同温度(T1、T2)和相应的速率常数(K1、K2)间的关系式为:
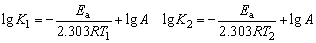
式中:Ea为反应活化能;A为频率因子(与碰撞频率有关);R为气体常数8.315(J/mol·K);T为热力学温度(K)。
今有实验测得反应CO(g)+NO2(g)=CO2(g)+NO(g)在不同温度下的反应速率常数为:
T(K) 600 700 800
K(mol/L·s) 0,028 0 1.3 23.0
试求此反应的活化能。

3、称以四份0.50g锌(相对原子质量65),按下列要求分别盛于四支试管里,塞上带导管的塞子,每隔一定时间分别测定生成氢气的体积。
①0.50g锌+5mL 3mol/L硫酸。
②0.50g锌+5mL 3mol/L硫酸+0.1g铜片。
③0.50g锌+5mL 3mol/L硫酸+0.1g铜粉。
④0.50g锌+5mL 3mol/L硫酸+0.39胆矾(相当于0.1g铜)
请说明各组反应生成氢气的速率及生成氢气的总量是否相同。
解析:本题涉及原电池的知识以及固液反应中固体反应物表面积与反应速率关系的知识。主要反应是Zn+H2SO4=ZnSO4+H2↑。④中存在反应Zn+CuSO4=ZnSO4+Cu,由于②③④中构成Zn—Cu原电池,故放出H2的速率较①快,又因Cu的表面积④>③>②,故产生H2的速率是④>③>②。从用量看,Zn不足,H2SO4过量,由于④中部分锌参与置换Cu,导致产生H2的量最少,而①②③相等。
4、338K时N2O5气相分解的速率常数为0.29min-1,活化能为103.3kJ/mol,求353K时的速率常数K及半衰期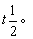
解析:由速率常数单位为min-1,可知该反应为一级反应,代入一级反应半衰期公式可求得该温度下的半衰期,对阿累尼乌斯公式两边取对数,可得:
可见,以lnK对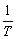 作图也应得到一条直线,其斜率为
作图也应得到一条直线,其斜率为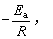 由此可求得活化能Ea的值。
由此可求得活化能Ea的值。
对上式可变换成另一种形式:

代入实验数值:

(2)根据公式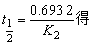
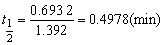
5、(湖北省竞赛题)实验测得在不同温度下,反应NO2+CO=CO2+NO的反应速率常数的数值如下:

试用作图法求反应活化能Ea。
解析 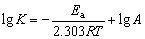
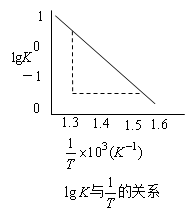 将题意中lgK与
将题意中lgK与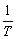 作图,得到如下图所示的直线。
作图,得到如下图所示的直线。
Ea=-(斜率)×2.303×R
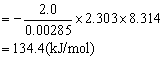
即反应活化能为134.4kJ/mol。
6、将5.6g铁粉投入足量的100 mL 2mol·L-1稀硫酸中,2min时铁刚好完全溶解,下列有关这个反应的速率表示正确的是( )
A.铁的反应速率等于0.5mol/(L·min)
B.硫酸的平均反应速率等于0.5mol/(L·min)
C.硫酸亚铁的平均反应速率等于0.5mol/(L·min)
D.氢气的反应速率等于0.5mol/(L·min)
解析:根据反应速率计算公式要计算2分钟时间内反应物浓度的变化量,在Fe+H2SO4=FeSO4+H2↑反应中,溶液中的溶质浓度发生变化的只有反应物硫酸和生成物硫酸亚铁。5.6g Fe物质的量= 故反应消耗H2SO4的物质的量=生成FeSO4的物质的量=0.1(mol),H2SO4消耗速率=FeSO4的生成速率=
故反应消耗H2SO4的物质的量=生成FeSO4的物质的量=0.1(mol),H2SO4消耗速率=FeSO4的生成速率= 所以B、C正确。
所以B、C正确。
而铁和氢气不溶于水,无浓度变化值,二者的反应速率不能用单位时间内浓度的变化值表示(可分别用单位时间内物质的量变化值等表示),故A、D表达不正确。所以答案为B、C。
第三节化学平衡
1、在773K时CO+H2O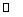 H2+CO2的平衡常数Kc=9,若CO、H2O的起始浓度均为0.020 mol/L,计算在这条件下,CO的转化率是多少?
H2+CO2的平衡常数Kc=9,若CO、H2O的起始浓度均为0.020 mol/L,计算在这条件下,CO的转化率是多少?
解析:设平衡时有x mol/L的CO2和H2生成
CO(g) + H2O(g)  CO2(g) + H2(g)
CO2(g) + H2(g)
起始浓度 0.02 0.02 0 0
转化浓度 x x x x
平衡浓度0.02-x 0.02-x x x
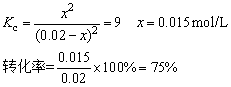
若开始时H2O浓度增大为原来的四倍,其他条件不变,则CO转化率是多少?
CO + H2O  CO2 + H2
CO2 + H2
起始浓度0.02 0.08 0 0
转化浓度 y y y y
平衡浓度0.02-y 0.08-y y y

2、0.05g N2O4气体放入200mL 密闭容器中并在25℃下保温,N2O4 2NO2,Kc=0.005 77。
2NO2,Kc=0.005 77。
求:(1)每一组分气体的平衡浓度。
(2)KP。
解析:(1)设N2O的转化浓度为x,则N2O4起始浓度
N2O4 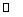 2NO2
2NO2
起始浓度:2.72×10-3 0
转化浓度: x 2x
平衡浓度:2.72×10-3-x 2x

所以平衡时,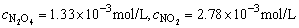
②KP=Kc·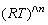 =0.005 77×(0.082×298)=0.141
=0.005 77×(0.082×298)=0.141
3、请先阅读以下的叙述,再解答后面提出的问题。
对于有气体参加的可逆反应,可以用各气体的平衡分压代替平衡浓度来表示其平衡常数。用分压(以大气压为单位)表示的平衡常数叫做压力平衡常数,以KP表示。例如:
2Fe(固)+4H2O(气)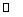 Fe3O4(固)+4H2(气)
Fe3O4(固)+4H2(气)
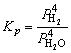
式中 和
和 分别表示平衡时H2和H2O(气)的分压力,其指数与反应式中相应物质的系数相等。注意:KP表达式中不包括纯固体、纯液体的压力项,由于它们的蒸气压在一定温度下为定值,可以包含在平衡常数KP内。
分别表示平衡时H2和H2O(气)的分压力,其指数与反应式中相应物质的系数相等。注意:KP表达式中不包括纯固体、纯液体的压力项,由于它们的蒸气压在一定温度下为定值,可以包含在平衡常数KP内。
问题:将纯H2S通入放有固态FeCl2并已抽成真空的密闭烧瓶内,加热烧瓶到329.9℃,并恒温,四天之后假定反应已达到平衡,此时烧瓶中含有两种固体FeCl2和FeS1+x。气相中仅有H2S、HCl和H2,其分压分别为0.300、0.803和0.056 3大气压。
(1)求化学式FeS1+x中x的值。
(2)写出烧瓶中所发生的平衡反应方程式(相对于1 mol FeCl2而言),并求出其lgKP值。(已知lg 0.300=×0.523, lg0.803=-0.095 3, lg 0.056 3=-1.25)。
解析:(1)(1+x)H2S(g)+FeCl2(s)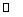 FeS1+x(s)+2HCl(g)+xH2(g)
FeS1+x(s)+2HCl(g)+xH2(g)
反应前,体系内无HCl(g)和H2(g),因此反应生成HCl和H2的物质的量之比等于其分压之比:
2︰x=0.803︰0.056 3 x=0.14
(2)FeCl(s)+1.14H2S(g)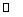 FeS1.14(s)+2HCl(g)+0.14H2(g)
FeS1.14(s)+2HCl(g)+0.14H2(g)
平衡分压(atm) 0.300 0.803 0.056 3

5、理想气体反应2A(g)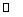 B(g)+xC(g)
B(g)+xC(g)
(1)开始时体系中只有A,A相对分子质量为44。实验测得101.325kPa和2 500K时,A有14%分解,平衡时混合气体的平均相对分子质量为41.12,求x值。
(2)在101.325kPa和3 000K时,实验测得平衡时混合气体的密度为0.15kg/m3,根据此数据计算说明该反应是吸热反应还是放热反应。
解析:(1)2A(g)  B(g) + xC(g) △n
B(g) + xC(g) △n
2n 0 0
平衡时 2n·86% n·14% nx·14% (x-1) n·14%
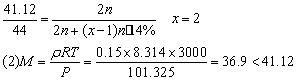
平衡向正反应方向移动,正反应为吸热反应。
 6、在活塞的密闭不锈钢筒中,吸入一定量的炭粉(足量)和1 g水加热至1000℃,发生反应:C(s)+H2O(g)
6、在活塞的密闭不锈钢筒中,吸入一定量的炭粉(足量)和1 g水加热至1000℃,发生反应:C(s)+H2O(g)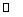 CO(g)+H2(g),一会儿,钢筒活塞处于A处。
CO(g)+H2(g),一会儿,钢筒活塞处于A处。
回答下称问题:(1)在1000℃,1.01×105Pa时钢筒中气体的体积_______5.8L(填:“大于”、“等于”或“小于”),简述原因:__________________________。(2)当温度不变时,将活塞向右推进至B处时,混合气体的平均分子量如何变化?为什么?(3)如果开始时吸入的是一定量的炭粉(足量)和x mol H2O,y mol CO和x mol H2,控制在1000℃,1.01×105Pa,一会儿把活塞向右推,发现混合气体的平均分子量变化与(2)中变化刚好相反,则x,y,z应满足什么条件?原混合气体(H2O为气态)的平均分子量应满足什么条件?
解析:(1)由pV=nRT可知,1 g H2O在1000℃的体积
V=Nrt/p=1 g/(18g/mol)×(8 314.3Pa·L/mol·K-1)×1 273K×(1.01×105Pa)=5.8L。
反应向正反应方向进行,正反应为气体体积增加的反应,所以钢筒中气体体积大于5.8L。
(2)因为右端CO和H2的平均分子量=(28+2)/2=15,左端H2O(g)的分子量为18,加压后平衡向左移动,即向分子量增加的方向移动,所以加压到B处时混合气体平均分子量增大。
(3)设CO转化量为a mol
C(s) + H2O(g) 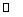 CO(g) + H2(g)
CO(g) + H2(g)
起始物质的量 x y x
转化物质的量 a a a
平衡物质的量 x+a y-a x-a
因为M(初)=(18x+28y+2x)/(x+y+z)
M(末)=[18(x+a)+28(y-a)+2(x-a)]/(x+y+z-a)
=(18x+28y+z-12a)/ (x+y+z-a)
令18x+28y+2z=m, x+y+z=n,则有:M(初)=m/n,M(末)=(m-12a)/(n-a)。
因为M(初)>M(末)。即m/n>(m-12a)/(n-a),整理得:m/n<12,即原混合气体平均分子量应满足M(初)<12。
将M(初)<12代入原式有:(18x+28y+2z)/(x+y+z)<12,整理上式可得:3x+8y<5z,此即为x, y, z应满足的条件。
7、把在常压下NO气体压缩到100个大气压(1个标准大气压=101.325kPa),然后在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,当压力降至略小于原压力的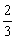 就不再改变,已知其中一种产物的相对分子质量为44。请用化学反应方程式和简单的文字解释这一实验现象________________________。
就不再改变,已知其中一种产物的相对分子质量为44。请用化学反应方程式和简单的文字解释这一实验现象________________________。
解析:(1)加热时压力下降,说明发生了化学反应,生成物中气体的体积相对反应物是减小的。
(2)压力减小到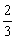 ,说明3体积NO气体反应生成了2体积气体产物。
,说明3体积NO气体反应生成了2体积气体产物。
(3)压力略小于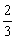 就不再改变,说明有进一步的可逆反应使气体体积略小,达到平衡状态后气体体积便不再改变,这是反应达到平衡状态的特征。
就不再改变,说明有进一步的可逆反应使气体体积略小,达到平衡状态后气体体积便不再改变,这是反应达到平衡状态的特征。
(4)一种产物相对分子质量为44,在氮、氧、氮的氧化物中只N2O的相对分子质量为44。从而可推测3体积的NO首先反应生成了1体积N2O和1体积NO2,在加压下,NO2转化为N2O4使气体体积再进一步减小。
所以 发生反应 气体体积减小到
气体体积减小到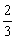 ,故压力为原来的
,故压力为原来的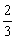 ;又因发生可逆反应2NO2
;又因发生可逆反应2NO2 N2O4,气体体积进一步缩小,故压力小于
N2O4,气体体积进一步缩小,故压力小于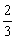 ,且因后者是可逆反应,故反应达到平衡后,压力不变。
,且因后者是可逆反应,故反应达到平衡后,压力不变。
8、1962年,N. Bartlett用PtF6与Xe在一定条件下反应,制得了第一个稀有气体化合物,这种化合物含F的质量分数为0.259。它极易于水反应,0.440 g该化合物与水反应可得标准状况下氙和氧气物质的量比为2︰1的混合气体33.6mL。
请根据上述条件,写出该化合物与水反应的化学方程式。
解析:本题要求写出有关反应的化学方程式,由于部分反应物和生成物未知,有一定难度。其中稀有气体化合物的化学式可通过如下方式求得。
设有1 g该化合物,则含F为0.259 g,含Xe:
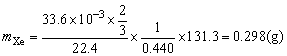
含Pt:mPt=1-(0.259+0.298)=0.443(g)
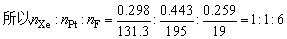
则稀有气体化合物的化学式为XePtF6。
易知,在反应中XePtF6是强氧化剂,这可从两方面理解。一方面作为稀有气体的化合物,应不够稳定,Xe应该容易被还原。另一方面,反应有O2产生,即水被氧化了,那么XePtF6被还原成何物?由题意知Xe是其中之一,Pt是否被还原?

由氧化数升降相等可得:6-x=2,x=4。
即反应后Pt的氧化数变为+4,因为是水解产物,可写成PtO2,所以反应的化学方程式为:
2XePtF6+6H2O=2Xe↑+O2↑+2PtO2+12HF
当然仅从氧化数考虑,将PtO2写成PtF4也可以,但实际PtF4遇水也会强烈水解。
9、二氧化氮是大气中许多含氮氧化物之一,它可二聚成N2O4(g)。
(1)N2O4(g)解离成NO2(g)的反应是一级反应,298K时速率常数是5.3×104s-1,求N2O4(g)分解20%需多长时间?
(2)NO2(g)二聚成N2O4(g)是二级反应,在198K,速率常数是9.8×104L/(mol·s),它的逆反应是一级反应,速率常数是5.3×104s-1。请根据这些数据计算反应2NO2(g) N2O4(g)在198K时的浓度平衡常数Kc。
N2O4(g)在198K时的浓度平衡常数Kc。
解析:(1)在恒容条件下,不考虑逆反应时 将有关数据代入可得:t=4.2×106(s)。
将有关数据代入可得:t=4.2×106(s)。
(2)平衡时,K正