生物化学大实验
一、装柱及标准样品的分子筛层析:
把柱子固定在夹子上,打开下面的盖,用取液器匀速加入介质。保证介质均匀沉淀,且要缓慢加入,防止产生气泡。待介质完全沉降打开柱的上盖,剪一与柱内径大小一致的圆形滤纸片放入柱中,沉淀于介质表面。液体接近界面时加入3ml超纯水,同时在层析杯中加入100ml超纯水,连接泵洗柱15min,同时配制平衡液200mL(20mmol Tris-HCl,pH 8.0; 20mmol NaCl)。待液体接近界面时,在柱中加入3ml平衡液(其余平衡液加到层析杯中),调节流速,控制滴速为3ml/10min(一分钟约6-7滴)。平衡柱过中午。
实验材料:牛血清蛋白、糜蛋白酶 二者比例为2:1 溶于20mmol Tris-HCl,pH 8.0; 20mmol NaCl(教师统一配制)。
缓慢向柱中加入样品(4ml)打开层析柱上下端,使样品靠重力流出。当样品接近界面时在柱中加入3ml 上样缓冲液(即平衡液),连接泵,调T=100 A(0.5A)=0 , 开启记录仪,同时配制100ml 0.1M Nacl。待两个峰都出来后,把层析杯中的液体换为0.1M Nacl洗柱20min,再用超纯水洗柱30min,封柱,关机。
。
实验二 BAP的诱导表达
1. 在5ml培养基中加入Amp 2.5μl(母液为100mg/ml)和10μl菌液。在摇床上37℃ 130转过夜预培养。
2. 取2.5ml菌液加入50ml含有Amp (25μl)的LB培养基中(1:20扩培)。37℃恒温摇床,180-200rpm培养40-60min左右。测OD600,使其值达到0.5-0.7。
3. 加入终浓度为1mM的IPTG(500μl)进行外源基因的诱导表达。于室温诱导4-5小时。
4. 取出后进行细胞超声破碎,留1ml破碎前菌液处理后进行western及PAGE,其余放入冰箱于4度保存。
实验三 BAP的亲和层析纯化
一、 破碎细菌
A. 盐酸胍破碎
1.100ml诱导后的菌液分别放于大离心管中,配平,5000rpm离心15min。去上清。
2.加入1/10体积PH8.0磷酸钠缓冲液(20mM)重悬后5000rpm离心10min,去上清。
3.在沉淀中加入1/10体积的6M的盐酸胍溶液(注:盐酸胍要用20mM的磷酸钠缓冲液溶解)。用玻动棒搅开后在30℃的摇床伤文娱10min。
4.分装于1.5ml离心管中,12000rpm离心10imn,取上清,上样(留100μl上样前的蛋白样品)
B. 超声波破碎
1. 诱导后的菌体于大离心管中,5000rpm离心15min,弃上清。
2. 加入1/10体积的破碎缓冲液洗涤。
3. 离心15min 5000rpm去上清,加入破碎缓冲液及终浓度为50μl/5ml的溶菌酶(现用现配,母液100mg/ml)。 30℃温浴15min。(离心时调好30℃的水浴摇床)。
4. 在冰浴条件下,60%功率超声处理5min(具体做法是每管中0.5ml样品,每五管一组,放于冰浴中连续处理,每管4秒,再重复,直到处理5min为止。再用40%功率超声处理5min)。超声要求a将菌液处理至清亮;b始终保持低温环境;c避免出现黑色沉淀。
5. 将超声处理后的样品于4℃ 2000rpm离心10min,沉淀为细胞碎片弃去。上清再于4℃ 12000rpm离心10min。上清为可溶性蛋白,沉淀为包涵体。(包涵体留样1ml,可溶性蛋白留样100μl)
三、上亲和柱
1、装柱(此步骤在破碎细菌时同时做)
每柱中装1.5ml的介质、乙醇混合液(混合后加)。打开底下的帽,待液体滴至界面时加入5柱体积约4ml的超纯水洗5遍,然后加入5柱体积的storting buffer,5遍平衡柱。
2、上样
待液体接近界面时,用取液器将可溶性蛋白样品加入亲和柱。(盐酸胍破碎)。可少上一些样品,根据流速确定上样量。超声波破碎的要全部上样。并且根据流速可以上2-3次。
3、临洗
待样品流到界面时,用含10mM咪唑的淋洗液洗10柱体积。(注意:咪唑用破碎缓冲液稀释)
4、洗脱
用3ml含有300mM咪唑的洗脱液洗脱,并且用eppendorf管收集每管500μl。(留样100μl)其余的洗脱样品用于离子交换层析。
实验四 BAP的分子筛排阻层析
一、 平衡柱
二、上样(杯中预先加入100ml起始缓冲液)
亲和层析的样品第2、3、4管分别取400µl混匀于1.5ml离心管中上柱,重力使之渗入柱子。样品接近界面时,加入1ml起始缓冲液。打开泵开始收集(加样时即打开读纸器),在峰顶处留样测定酶活。关读纸机。然后用20ml 0.1M Nacl的处理柱子。洗柱,用超纯水洗30min左右。
实验五 SDS-PAGE
一、 样品处理(在配完浓缩胶后静置30min时,每组由一个人处理即可)
1、 包涵体处理:在留样的沉淀中加入500μl 8M的尿素,摇匀。取20μl于1.5ml离心管中,再加入50μl上样缓冲液,于100℃沸水中煮沸5min。
2、 菌体处理:将留样的1ml菌体于12000rpm离心1min,用滤纸吸干残液,用100μl上样缓冲液重悬菌体,100℃沸水中煮沸5min。
3、 亲和层析样品处理:取亲和层析样品,2和3号管各20μl于1.5ml离心管中,再加入20μl上样缓冲液,于100℃沸水中煮沸5min。待样品冷却后12000rpm离心5min。
二、清洗安装
清洗电泳槽,玻璃板(用海绵块洗),胶条等电泳装置,然后用卫生纸轻轻吸水晾干。组装玻璃板(凹面向外),封胶条,要贴紧玻璃板,胶条下端要平直,并且胶条始终要自然弹性范围不要用力拽。每组装好后让老师检查后再去灌胶。
三、配分离胶
每组准备一个小烧杯,按照实验讲义的配方配。12%的分离胶,混匀后立即用取液器加入玻璃板中,加至红线处。然后加入1ml的超纯水。静置30min。待胶凝固后倾斜倒出超纯水。用滤纸吸干残液。
四、配浓缩胶
配5%浓缩胶,混匀后立即加入插上梳子的玻璃板面,直至没过柱子与玻璃板凹面相平。静置30min。
五、上样前准备
待浓缩胶凝固后垂直拔下梳子,取出玻璃板,除去胶条,使玻璃板凹面向内重新组装,然后向内外槽加入电极缓冲液(内槽一定要加满)。
六、点样
按顺序依次点样,两块胶一块做SDS染色(普通Marker),另一块做western杂交(点预染Marker)。Marker要提前处理。
七、电泳
将电泳装置与电泳电源连接(注意正负极)。调电压60V。待溴酚蓝前沿进入分离胶后,换成90V电压,直到溴酚蓝前沿跑出胶,再过半小时,关闭电源停止电泳。
八、胶的处理
电泳完毕后,卸下玻璃板,小心撬开。用手术刀切去浓缩胶。将点有普通Marker的胶浸泡在染色液中。染色→脱色→水洗(过夜)。预染Marker的胶进行转膜处理。
实验六 Western印迹
清洗转移电泳槽等装置。蒸馏水漂洗点有预染Marker的胶。然后浸泡在转移缓冲液中。戴上手套用镊子夹住PVDF膜。先在甲醇中处理15秒(严格计时)。然后放入蒸馏水槽中漂洗一下,最后放于盛有转移缓冲液的盆中平衡15min。同时将4片滤纸2块海绵浸泡在转移缓冲液中。尽量用玻璃棒赶去海绵中的气泡(否则易短路)。然后按照阴极黑板——海绵垫——2层滤纸——凝胶——PVDF膜——2层滤纸——海绵垫——阳极红板的顺序装。80mA恒流下在转移电泳槽中电泳2.5-3小时。然后卸去装置。取出PVDF膜放于干燥滤纸上片刻,但不要吸干膜。灭菌去离子水中冲洗。
将PVDF膜放入玻璃平皿中加入封闭液,在摇床上封闭2小时。封闭液(5ml)TBS(5ml)脱脂奶粉(0.25g)。
封闭2小时后取出PVDF膜,在1*TBS中漂洗2次后放入平皿中加入一抗封闭液(一抗1:2000)。每组10ml,过夜。

在脱色摇床上摇10min,然后4℃过夜孵育。取出膜后在1× TBS中漂洗2次。每次10min。放入二抗封闭液中(二抗1:1000)。每组10ml,孵育1.5-2小时。
配制2000ml 1× TBS倒入5个瓷盆中,取一片BAB溶于37℃预热的10m超纯水。用玻璃棒搅拌至完全溶解。加入20μl 30%的双氧水摇匀。倒入平皿中。将平皿放于抽屉暗处显色5min。取出膜用灭菌去离子水漂洗终止反应,然后用清水冲洗。
酶活力测定步骤
1、 取5只1.5mlEP管标号1—5,向1#管中加入1ml超纯水。2#加50μl总蛋白。3#、4#分别加入50μl亲和层析2号和3号样品。5#中加入1μlBAP和1ml灭菌处理过的超纯水(先加水,后加BAP标准品)。2#、3#、4#、5#管分别加超纯水稀释至1ml。
2、 取5只试管,洗净后标号1—5.每个试管中加入2ml底物溶液,再把相应编号的EP管中的溶液加入试管中。用力混匀。
3、 在大烧杯中盛入适量预热37℃预热的水。将试管放入烧杯中,在恒温37℃水浴中反应5min。
4、 在每支试管中加入250μl 1M NaOH溶液终止反应。
5、 在可见分光光度计测量OD410,计算3次平均值。计算酶活力。
计算:
(1)酶活力单位数

(2)酶的比活力=酶活力单位数/mg蛋白
(3)蛋白浓度(mg/ml)=1.45OD280(×稀释倍数)—0.74OD260(×稀释倍数)
离子交换层析后,蛋白浓度很低,OD260可能为负值。蛋白浓度可以用另一经验公式

(4)mg蛋白= 蛋白浓度(mg/ml)×蛋白体积
(5)

第二篇:生化大实验实验报告
一 蛋白质提取、纯化及分析技术
实验一 多酚氧化酶(PPO)的分离提取
一、材料与试剂
(1)马铃薯(大约每小组200-300g)
(2)试剂:
0.03M磷酸缓冲液PH6.0(内含0.02m巯基乙醇,0.001m EDTA,5%甘油,1%的聚乙烯吡咯烷酮)配制时配×10倍的浓缩液1000ml;固体硫酸铵;0.03M磷酸缓冲液PH6.0(内含0.02m巯基乙醇,0.001m EDTA,0.005m MgCL2)配置时配。
(3)实验器械与仪器设备:
试管与试管架;烧杯、玻璃搅棒;移液管、滴管等;试剂瓶;透析袋;过滤纱布;植物组织匀浆器;PH计和PH试纸;GL-20C高速冷冻离心机;
DL-7A大容量低速冷冻离心机
二、操作步骤
1:粗酶提取:
马铃薯组织按1:1(W/V)比例与0.03m磷酸缓冲液PH6.0(内含0.02M巯基乙醇,0.001m EDTA,5%甘油,1%聚乙烯吡咯烷酮)混合,匀浆4层后纱布过滤,滤液以6000rpm离心10min,弃除沉淀获得酶提取液。
2:盐析分级沉淀:
在酶提取液中加入固体硫酸铵使其达到40%饱和度(边加边搅拌达到充分溶解),然后6000rpm离心20min弃除沉淀;离心上清液在加入固体硫酸铵达到70%饱和度(边加边搅拌达到充分溶解),再以6000rpm离心20min,弃除上清夜,收集粗酶沉淀。沉淀用0.03M磷酸缓冲液PH6.0(内含0.02巯基乙醇,0.001M EDTA,0.005M MgCL2)溶解,装入透析袋中用0.02N KCL溶液透析至无硫酸铵根离子,获得粗酶液供上柱使用。
三、实验结果
获得PPO粗酶液供上柱使用。
实验二 柱层析纯化PPO
一、材料与试剂
试剂:0.02M Tris-HCL缓冲液Ph7.4(内含0.001M EDTA)配制时配×10倍浓缩液1000ml;NaCL;聚已二醇;葡聚糖凝胶Sephadex G-200等;
实验器械与仪器设备:试管与试管架、烧杯、玻璃搅棒、移液管、滴管等;试剂瓶、层析柱、pH计和pH试纸、恒流泵、梯度混合仪、核酸蛋白监测仪、GL-20C高速冷冻离心机、DL-7A大容量低速冷冻离心机
二、操作步骤
1.葡聚糖凝胶的处理、装柱及平衡
(1)柱材处理
称取一定量的Sephadex G-200干粉,加无离子水或蒸馏水浸泡溶胀48h,去掉悬浮的细微颗粒,为防止凝胶颗粒中的空气存在,影响层析效果,凝胶装柱前一定要将凝胶液中的气体除掉,其办法是将凝胶液放进抽滤瓶中,进行抽真空处理,直到凝胶液中没有气泡出现为止。
(2)装柱
将层析柱清洗干净垂直固定到层析架上,加1/3体积的无离子水,打开下出液口,水流畅通,即刻将小烧杯中装有适宜浓度的凝胶液(凝胶的浓度过高会产生气泡,影响蛋白质分离速度,浓度过低易产生凝胶分层,影响蛋白质的分离效果)轻轻倒入层析柱中,凝胶自然慢慢沉降在层析柱底部,凝胶沉积直到离层析柱上端1.5-2cm处,停止装柱,剪一与柱内径相等的滤纸片覆盖于凝胶上。层析柱上端进液口连接恒流泵,下出液口连接蛋白质监测仪,待层析柱的平衡。
(3)平衡
在柱层析上样前必须对层析柱进行平衡,所谓平衡就是将层析柱中的溶液用层析过程的缓冲液(洗脱液)置换出来,使层析柱中的缓冲系统与柱层析过程中的系统一致。其方法是:利用层析柱上端的恒流泵将平衡缓冲液泵入到层析柱内,打开层析柱下端的出口,平衡液流速在0.5-1ml/min,当下出口流出液的PH值与平衡缓冲液的PH值一致时,层析柱达到了平衡。在本实验中,用0.002M Tris-HCL缓冲液PH7.4(内含0.0001M EDTA),平衡Sephadex G-200凝胶。
2.上样:将粗酶液上柱。
3.洗脱:用0.02M Tris-HCL缓冲液Ph7.4(内含0.001M EDTA)洗脱,收集洗脱液进行酶活性、蛋白质浓度、聚丙烯酰胺凝胶电泳分子量的基本性质分析测定。
4.测定酶活性和蛋白质浓度
注释:透析就是把(NH4)2SO4透析出去
三、实验结果
取含有蛋白的洗脱液第1至19管,每管含洗脱液约5ml,以供后续实验检测蛋白含量和酶活用。
实验三 实验蛋白质含量及活性测定
一、仪器与试剂
1.材料:
经硫酸铵沉淀获得PPO粗酶液, Sephadex G-200分离纯化的酶液样品。
2.仪器与器皿:
分光光度计,分析天平,容量瓶,移液管和试管等。
3.试剂:
考马斯亮蓝G-100蛋白试剂:
称取100mg考马斯亮蓝G-100溶于50ml90%的乙醇中,加入85%(V/V)磷酸100ml,最后加入无离子水或蒸馏水定容到1000ml,此溶液可在常温下放置一个月。
二、操作步骤
样品中蛋白质浓度的测定:
蛋白质含量测定(630nm)。96孔酶标板依次加入考马斯亮兰100微升,样品10微升,原酶液10微升,对照为Tris-HCl缓冲液10微升。用DG5031型酶联免疫检测仪测定蛋白质含量。
样品中PPO活性的测定:
96孔酶标板依次加入磷酸-柠檬酸缓冲液100μL→底物邻苯二酚10μL→样品10μL,原酶液10μL,对照为Tris-HCl缓冲液10μL。
三、实验结果
结果列表
表1 葡萄糖凝胶处理过柱后酶活与蛋白质含量(OD值)



图1 PPO蛋白含量和活性OD值
从图表中可以看出,其中5和6号试管中PPO的含量较高,5号试管的活性最高,说明5号试管中的PPO纯化度最高。
实验四 SDS-PAGE测定蛋白质分子量及蛋白质的纯度鉴定
一、仪器与试剂
1.材料: 硫酸铵盐析沉淀的多酚氧化酶粗酶样品、DEAE-纤维素DE52柱层析的样品,Sephadex G-100柱层析的样品。
2.试剂:
(1)丙稀酰胺(Acr母液):30%Acr (Acr/Bis)
(2)10%的SDS溶液
(3)10%的过硫酸铵溶液
(4)四甲基乙二胺(TEMED)
(5)分离胶缓冲液:1.5M Tris,PH8.8
(6)浓缩胶缓冲液:1.0M Tris,PH6.8
(7)电极缓冲液:10×30g Tris,125g 甘氨酸和5g SDS,加水溶解定容至1000ml,pH8.3
(8)样品缓冲液:0.2M Tris,PH6.8,1%SDS,30%甘油,巯基乙醇及溴酚兰
(9)染色液:0.15%考马斯亮蓝R250,溶于脱色液
(10)脱色液:50%的甲醇,7%的冰醋酸的水溶液
(11)标准分子量蛋白。
3.仪器设备: 电泳仪,垂直电泳槽等。
二、操作步骤
1.凝胶制备:
用两块电泳玻璃板制成垂直板槽(不能漏胶),垂直放置。将配制好的分离胶溶液,倒入,滴加入无离子水,待凝胶聚集后,倒出无离子水,用吸水纸吸干,倒入浓缩胶,再插入梳子。
分离胶和浓缩胶的配备分别是:

2.上样:分别取样品若干ml于离心管中,按1/1-1/5比例加入5×样品缓冲液,再沸水浴中加热3-5min,取出待用。用微量注射器分别吸取不超过30ul不同浓度的标准蛋白样品和试验样品注入样品槽。点样结束后,调节电泳仪电流到10mA(2-3mA/em),保持电流稳定不变,当溴酚蓝迁移到离分离胶底1-2cm时,即可停止电泳。
3.染色:电泳完毕后,取出凝胶板,浸入染色液中,在37℃温箱中保温过夜。倒掉染色液,24h后,即可看到清晰的蛋白质条带。
4.标准蛋白质迁移率-分子量对数图制作及未知蛋白质分子量计算。
三、实验结果
电泳槽中溴酚兰指示条带出现明显的条带;整个泳道染色偏重,可能是原液中含很多杂质所致;2柱的染色结果很淡,可能是酶蛋白含量偏低造成。从实验结果可以看出,随着纯化的进行,条带颜色越来越浅,杂带得颜色也越来浅(纯化的样品的条带明显比杂带的清晰),说明杂蛋白的含量减少,但酶蛋白含量也大量的减少。Maker情况不清楚,无法判断分子量。
实验五 胰酶分离提取
一、材料与试剂
1.仪器
紫外光分光光度计、恒温水浴、离心机、组织捣碎机、PH计、显微镜、秒表、剪刀、镊子、搪瓷盆、乳钵、大玻璃漏斗、抽滤瓶,塑料小桶、纱布、PH试纸,滤纸、玻璃器皿等。
2.材料:新鲜猪胰脏
3.试剂及溶液配制
pH2.5乙酸酸化水、2.5M H2SO4溶液、2M.NaOH溶液、5M NaOH溶液、01M HCL溶液、0.025M HCL溶液、0.01M HCL溶液、0.4M pH9.0硼酸缓冲液(母液为0.8M,用时稀释一倍)、Tris、硫酸铵。
0.8M pH9.0硼酸缓冲液:取20ml0.8M四硼酸钠溶液,混合后用PH计校正。
二、操作步骤
(1)新鲜猪胰脏一个,剥除脂肪和结缔组织→称重27.5g→手动绞肉机绞碎→加入2倍体积预冷的pH2.5-3.0乙酸酸化水溶液60ml提取→用10%乙酸调节pH在3.0以下→冷室5℃提取20h。
胰蛋白酶提取关键:控制低温;控制pH低于3.0,维持胰蛋白酶提取过程中的稳定。
操作过程中的问题:乙酸调节酸度不稳定。
(2)过夜后粗提取物四层纱布过滤,滤液呈乳白色→滤渣再加入10ml乙酸溶液浸提残渣,浸提2h。
(3)浸提液离心,取上层黄绿色清液110ml,称量52.36g硫酸铵盐(每100ml加入47.36g)缓慢加入溶解→冷室静置。
(4)冷置后离心10min得胰蛋白酶粗制品→取沉淀称重10g→计算需要加入氯化钙的质量[m×1/4×1/132×111g/M + (0.1M×10×10g/1000)×111g/M = m钙],计算后需要加入氯化钙3.2g混匀 →用氢氧化钠溶液调节pH至8.0,过夜。
(5)75%硫酸铵溶液沉淀,包括猪胰酶沉淀和硫酸钙沉淀,为节约时间,此步骤老师已经准备好。离心10000g 10min ,沉淀转移到50ml离心管,加15ml蒸馏水复溶,再10000g离心,得上层清液预备上柱。
实验六 卵清蛋白分离提取
一、材料与试剂:
1.材料:新鲜鸡蛋2只
2:仪器:抽滤瓶500-1000ml、烧结漏斗、移液器、磁力搅拌器
3:试剂:
10%TCA,用固体NaOH调调PH至1.05-1.10,需要50ml、5N HCL、5N NaOH、冷丙酮、胰蛋白酶液、BAEE-0.05M,PH8.0Tris-HCL缓冲液(每ml含0.34BAEE和2.22mgCaCL2),50ml
pH8.0,0.1M Tris-HCL缓冲液
二、操作步骤
(1)新鲜鸡蛋两枚取蛋清51ml→25℃外用热水浴中缓慢加入51ml三氯乙酸-丙酮→温摇床30min→4℃静置过夜
操作关键:要在热水浴中缓慢加入有机溶剂,不可在热水浴之前加入;取蛋清时注意不能混入蛋黄,否则引入杂蛋白。
(2)粗提取物于50ml离心管10000g离心10min→取上清液50ml,加入2V丙酮100ml沉淀→4℃放置2h。
(3)放置后取沉淀离心4000g5min,收集沉淀→10ml去离子水溶解蛋白透析。
(4)透析液离心4000g 10min ,取上层清液17ml,加蒸馏水至35ml,用于亲和柱层析。
实验七 亲和层析纯化胰酶
一、仪器与试剂
1.鸡卵粘蛋白制备
2.Sephadex-G75的活化和偶联
2.5g干重的葡聚糖凝胶Sephadex-G75 、0.05M NaCL溶液 50ml、纯化的鸡卵粘蛋白87.5mg、 5% K2CO3、0.27gKBH4 (溶于20ml水)
3.亲和层析
0.1M Tris-HCL pH7.5(含0.5M KCL,0.05M CaCL2) 200ml、粗胰蛋白酶约50ml 、0.1N甲酸钾、0.5M KCL pH2.5 100ml
仪器器材:抽滤瓶500-1000ml、层析柱、紫外分光光度计、紫外蛋白检测仪、烧杯漏斗、移液管、磁力搅拌器
二、操作步骤
1、鸡卵粘蛋白的制备
2、Sephadex-G75的活化及偶联
2.5g干重的葡聚糖凝胶Sephadex-G75溶胀洗涤数次,缓慢搅拌,加入0.05M NaCL溶液50ml ,30min,蒸馏水洗涤数次,抽干备用,活化凝胶,纯化的鸡卵粘蛋白87.5mg 溶于35ml水,加入活化葡聚糖凝胶,75%K2CO3,调pH7.5-9.0,缓慢搅拌3h。反应过程随时加入5%K2CO3,以维持pH的稳定。0.27gKBH4 溶于20ml水,缓慢搅拌加入上述体系反应5h,pH维持在6.5-7.5,洗涤。
3、胰蛋白酶的亲和层析
(1)亲和层析
将鸡卵粘蛋白-Sephadex-G75装柱(1×10cm),用pH7.5,0.1M含 0.5M KCL,0.05M CaCL2的缓冲液平衡,平衡约2-3倍的柱体积。将粗胰酶液上柱层析。用紫外蛋白监测仪280nm处检测蛋白质吸收峰,随着上柱和流出的杂蛋白量的平衡,吸收峰达到稳定,一旦上柱的胰蛋白酶量超过柱的负荷时,则胰蛋白酶溢出,使吸收峰升高,此时应停止样品上样,改用pH7.5的平衡缓冲液冲洗出杂蛋白,待洗出液的吸收回到基线后,改用0.1N的甲酸钾0.5M KCL,Ph2.5的洗脱液解析,柱的流速维持在1.5ml/min左右,收集洗脱下来的蛋白峰蛋白,测总蛋白量及比活性,并根据上柱样品的总蛋白量和比活性计算经亲和层析后胰蛋白酶比活性提高的倍数,总蛋白回收率,胰蛋白酶量。
当胰蛋白酶峰洗出,待紫外吸收回到基线后,重新用缓冲液平衡,亲和层析柱可以反复使用。
(2)胰酶蛋白和活性测定
三、实验结果
表2 亲和层析处理过柱后酶活与蛋白质含量(OD值)



图2 亲和层析后胰酶的含量和活性OD值
从图表中可以看出,其中5和6号试管中胰酶的含量较高,6号试管的活性最高,说明6号试管中的胰酶纯化度最高。
二 免疫学实验
实验八单向琼脂扩散实验
一、操作步骤
1.取一块干净的玻璃板,用少量75%乙醇冲洗,晾干后置于水平台,将1%琼脂糖融化,56℃水浴中保温。
2.取15ml琼脂糖加到56℃预热玻璃管中,加入约200微升抗血清,充分混匀后铺于玻璃板上,厚度约为0.1cm。
3.待凝胶凝固后打孔,直径为3㎜,将孔内琼脂弄出。
4.将系列稀释的标准抗原和待检抗原分别加到凝胶孔内,每孔5微升。
将凝胶板置于湿盒内,室温过夜,观察结果。
二、实验结果

图3 单扩结果
抗原1孔周围有不明显沉淀环,抗原2看不出有沉淀环
三、结果分析
凝胶中抗体的浓度是10-2,并且抗体扩散弱,因此结果不明显。
所以沉淀环的大小与抗原的浓度成反比,基本成线性相关。其大小不仅与孔中抗原的浓度相关,而且和琼脂中抗体的浓度以及胶浓度有关。
实验九 双向琼脂扩散实验
一、操作步骤
1.取一块干净的玻璃板,用少量75%乙醇冲洗,晾干后置于水平台,将1%琼脂糖融化,56℃水浴中保温。
2.将琼脂糖铺于玻璃板上,厚度约为1㎜。
3.打孔,孔距为4㎜,
4.将抗原按二倍稀释法稀释成1:2, 1:4, 1:8, 1:16, 1:32的不同浓度。
在周围孔中加入不同浓度的抗原,中心孔加抗体。
将凝胶板置于湿盒内,室温过夜,观察结果
二、实验结果

图4 双扩结果
抗体1浓度为10-1,抗体2浓度为10-2,结果中只有抗体1与抗原1和抗原2产生了沉淀线,其余均无。
三、结果分析
抗体稀释浓度过底。
实验十二 酶联免疫分析技术(双抗体夹心法 DAS-ELISA)
一、 原理
此法常用于测定抗原,将已知抗体吸附于固相载体,加入待测标本(含相应抗原)与之结合。温育后洗涤,加入酶标抗体和底物进行测定。
二、操作步骤
1. 用已知特异性抗体包被固相载体
2. 加待测标本,经过温育使相应抗原与固相抗体结合;洗涤,除去无关的物质
3. 加酶标特异性抗体与已结合在固相抗体上的抗原反应,37℃,1h;dH2O洗涤3次,除去未结合的酶标抗体
4. 加底物H2O2和TMB显色,终止反应后,可目测来定性或用酶标仪测定光密度值进行定量测定。
三、测定结果
表3 ELISA实验结果记录
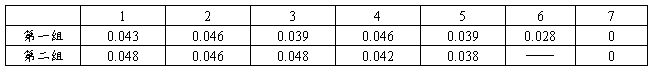
注:1代表第一组抗体1,第二组抗体2;2 至6分别表示稀释倍数从10+1至10+5;7为 对照组


图 7 第一组OD值 图8 第二组OD值
四、结果分析
理论上应该是直线型,有可能是样品量不够造成。
实验十三 Western-blotting
一、操作步骤
剪6块3mm滤纸,和一块NC膜。将剪好的3mm滤纸和NC膜在转移缓冲液中浸泡5分钟。
安装转移装置,将3块3mm的滤纸放在海绵上,然后依次将NC膜,凝胶,另3块滤纸海绵的顺序放好。
在支架加紧上述几层,放入电泳槽中,NC膜的一次向正极,凝胶一侧向负极,在40V电压下电泳6小时。
转移结束后,切下一个孔所对应的膜的一半用考马思量兰染色。
观察转移效果。将其余的NC膜放在一张干净的3mm滤纸上,室温干燥1小时。
将NC膜封闭:将干燥后的NC膜放于平皿中,加入封闭液,液面要没住,轻轻摇荡2小时。
将第一抗体用封闭液稀释,将封闭好的NC膜放入塑料袋中,加入一抗0.1ml,将袋中气泡排除,封口,4℃下轻轻振荡2小时。
反应结束,剪开塑料袋,弃去反应液,用PBS洗三次,将膜放入一个塑料袋中,加入稀释过的二抗溶液0.1ml,封口,在室温下振荡1小时。
反映结束,取出,用PBS洗3次。
将膜放入显色液中,室温下轻轻摇荡。待条代出现后,用水冲洗,用TE终止。
二、实验结果及分析
标准酶样品的带可观察到,但不是很清楚,粗提的样品的带也可观察到,比较清楚,纯化后的带很弱,只是隐约可见。主要原因是由于纯化的过程中酶的丢失严重所致。
三、注意事项
蛋白质的电泳时间要足够长,否则,条带不能分开。
电转过程中要注意电极的正负,不能放反。
要注意电转膜与胶之间不能有气泡,电转电压也不宜过高,最好低压过夜。
在杂交袋中杂交时,注意感气泡,封口,不要漏液。
显影的时间要足够长。
三 核酸部分
实验十四 染色体DNA的提取
一、材料与方法
1.材料: 培养菌体
2.仪器设备:
超净工作台、培养箱、摇床、高速冷冻离心机、超级恒温器或恒温水浴、台式离心机、取液器一套、低温冰箱或冰柜、冷冻真空干燥器、电泳仪、水平电泳槽、紫外观测仪
3.试剂:
细胞裂解液 100m M Tris-HCL
5m M EDTA
5OOm M NaCL
1.25%SDS
pH7.5
饱和酚 氯仿/异戊醇 酚/氯仿/异戊醇 异丙醇 70%无水乙醇 3M NaAC RNase 50×TAE缓冲液 电泳载样缓冲液
二、操作步骤:
培养菌体
1g材料 + 600ml提取液(65℃预热),60ul酚混合(变性蛋白,操作应缓和,不可剧烈振荡,以免DNA烈解)
65℃ 30min(5-10min,混匀一次)
+600ul 氯仿,混匀
15000g离心,10min
吸取上清,+1/10体积的乙酸钠,2倍体积的乙醇,置于-80℃,30min
10000g 离心10min,复融
+RNase A,65℃,30min
氯仿抽提一次,70%乙醇洗沉淀
干燥,
复溶于1.0ml的TE中,电泳
三、实验结果
所提取的大肠杆菌基因组DNA由琼脂糖凝胶电泳分析结果,泳道较清晰,有一条很亮的DNA条带,其上方有几条弱带,弱带大概有三条,可能为未降解的RNA,获得染色体DNA用于后续实验。
实验十五 质粒DNA的提取与纯化
一、材料与方法
1.材料:大肠杆菌
2.仪器:
超净工作台,培养箱,摇床,超级恒温箱或恒温水浴,台式离心机,取液器一套,低温水箱或冰柜,冷冻真空干燥器,电泳仪,水平电泳槽,紫外观测仪
3.试剂:
Solution Ⅰ 50mM葡萄糖
25mM Tris-HCL(Ph 8.0)
10mM EDTA(pH 8.0)
高压灭菌,4℃保存
Solution Ⅱ 0.2M NaOH ,1%SDS,现配现用
Solution Ⅲ 5N KAC pH4.8, 高压灭菌,4℃保存
3M NaAC Ph5.2 高压灭菌,4℃保存,氨苄青霉素 25mg/ml,溶菌酶 8mg/ml,氯仿/酚,异丙醇,LB培养基,电泳试剂
4.操作步骤:
2ml/20ml 培养菌体37℃ 200rpm 过夜
离心,4℃ 5000rpm,10min
沉淀(菌体细胞),加入预冷的100ul SolutionⅠ,复溶
加入200ul Solution Ⅱ,颠倒3-5次,冰浴3-5min
加入150ul Solution Ⅲ,颠倒3-5次,冰浴5-10min,离心 10000g 5min
取上清,加等体积氯仿,混匀静置
离心 10000g 4min
取上清,加2倍体积乙醇,1/10 体积乙酸钠,-80℃ 30min,
15000g 离心10min
70%乙醇复沉淀
干燥,在悬浮于50ul TE缓冲液中,电泳
二、实验结果
对提取的质粒DNA进行琼脂糖凝胶电泳,共得到三条带,跑的最慢的是我们提取的开环的质粒DNA分子,中间的条带是操作过程中断裂的线性DNA分子,跑在最前面的应该是超螺旋的质粒DNA分子。
实验十六 DNA片段的酶切
一、材料与方法
1.材料:λ DNA
2.仪器:离心机,恒温水浴,取液器,电泳仪,电泳槽,紫外观测仪
3.试剂:EcoRI及缓冲液,HindIII及缓冲液,λDNA,TAE缓冲液
4.操作
EcoRI、HindIII双酶切, 取2只干净、灭菌新Eppendorf管,分别如下加入(μl)

37℃保温2小时。加入6μl电泳加样缓冲液。电泳分析。
二、实验结果
双酶切的结果是电泳出现了5条带,表明DNA 已被切割成若干段,由maker可以得到带相对的大小,带的亮度表明了相对量的多少。
实验十七 DNA片段的连接技术
一、材料和方法
1、仪器:离心机,恒温设备,真空干燥机,取液器
2、试剂:T4DNA连接酶,10×T4DNA连接酶缓冲液、200mM Tris-HCl(pH7.6)、50mM MgCl2、50mM DTT、500μg/ml牛血清白蛋白、5mM ATP、λDNA、酚,TE缓冲液,电泳缓冲液、3M NaAC
3、操作:
取干净、灭菌新Eppendorf管,加入各试液如下(μl)

4℃ 保温过夜,提取已连接好的DNA片段,电泳分析。
二、实验结果
由maker和阴性对照(未连接的质粒载体)可以判断连接成功。由电泳图片判断得知连接成功,可以用于转化。
实验十九 重组片段的转化及克隆和筛选
一、材料和方法
1.材料:大肠杆菌
2.仪器:离心机,恒温摇床,恒温水浴,超净工作台,冰柜
3. 试剂:
LB培养基; 0.1M mM CaCl2 ; 0.1M MgCl2 ; 3mM氯化6氨高钴。TFB:10mM MES(pH 6.3),45mM MnCl2, 10mM CaCl2, 100mM KCl
二、操作过程
取100μl感受态细胞悬液,加5μl连接DNA,冰浴30min。然后42℃,90s后,冰箱里防治5min,加入200μl LB培养基,37℃下培养45~60min。取20μl培养的菌液连同 4μlIPTG和10μlX-gal涂布在含有Amp的LB培养基上。37℃下培养过夜,观测菌落形态和颜色。
三、实验结果
培养皿上会出现白色菌落和兰色菌落,但兰色菌落数量很少。兰色菌落表示其中的转化子能产生有功能的β-半乳糖苷酶,是由于转化的是切割后自连接的载体。虽然是转化子,却不是我们需要的。只有白色菌落,才是含有外源DNA的转化子,由于外源DNA的插入使不能产生有功能的β-半乳糖苷酶,所以不能分解X-gal,这就是我们所需要的重组子。
本实验观察:蓝色的菌落很少(3-4个菌落),未发现白色菌落,2天后观察到一白色斑点。
四、结果分析:
未得到所需重组子原因很多,首先连接的效率不是很高,由电泳图片可以观察到,但连接的产物应该还是可以转化成功的。其次,感受态细胞制备操作过程中可能有失误,造成转化失败。再者,用于培养转化细胞的固体培养基可能出了问题(可能放置时间太长),由平板上蓝色菌落也很少,可以得出这方面的失误的可能性较大。还或者是在操作过程中,由于操作不规范造成质粒载体效率下降。
