
第二篇:课时2 化学反应的焓变 导学案
高二化学导学案 选修 化学反应原理 专题1 第一单元 化学反应中的热效应 高二化学备课组 编号:02
班级 座号 姓名
一.化 学 反 应 的 焓 变(课时2)
【导 学 目 标】
1、了解反应热和焓变的含义;
2、知道吸热反应和放热反应;
3、能正确书写热化学方程式
【学 习 重、难 点】
正确书写热化学方程式并利用热化学方程式进行简单计算
【导 学 过 程】
学点1 热化学方程式的书写(P4)
写出下列反应的热化学方程式:
(1)N2(g)与H2(g)反应生成1mol NH3(g),放出46.1KJ热量。
_________________________________________
(2)1mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8 KJ热量。
_________________________________________
(3)2molC2H2(g)在O2(g)中完全燃烧生成CO2和H2O(l),放出2598.8KJ热量。 _________________________________________
(4)1molC(石墨)与适量的H2O(g)反应生成CO(g)和H2(g),吸收131.3 KJ热量。 _________________________________________
(5)2 g H2和足量的O2充分燃烧生成液态水,放出热量为285.8KJ,则H2和O2燃烧的热化学方程式:_______________________________________
学点2 化学键与能量的变化(键能与反应热的关系)(P4-5)
物质发生化学反应的实质是。旧化学键的断裂要吸收能量,新化学键的形成要放出能量,这两部分能量一般不相等,其差就是 。根据键能求化学反应的反应热和焓变
△一。△H>0,化学反应为吸热反应;△H<0,化学反应为放热反应。
注意:①拆开1 mol化学键所吸收的能量与形成1 mol化学键所放出的能量相等。
②断开1 mol分子中所有的化学键需吸收的能量(也就是在相同条件下由原子形成1 mol分子中的化学键所放出的能量)等于断开分子内所有1 mol化学键所需吸收能量的总和。
【导 疑 案 例】
〖例1〗已知拆开1 mol H2分子中的化学键需要消耗436 kJ能量,拆开1 mol O2分子中的化学键需要消耗496 kJ能量,形成水分子中的1 mol H一O共价键能释放出463 kJ能量。试说明反应2H2+O2=2H2O中的能量变化,并写出相应的热化学方程式。
1
高二化学导学案 选修 化学反应原理 专题1 第一单元 化学反应中的热效应 高二化学备课组 编号:02
〖变式题2〗一定条件下,实验测得由H、O原子形成1 molH2O2放出的能量为1072 kJ,形
成1 mol H—O键放出的能量为464 kJ,据此可计算出形成1 mol O—O键放出的能量为 kJ。而在相同条件下,实验测得由O原子形成1 mol O2分子放出的能量为493 kJ。请推测由O原子形成1 mol O一O键和形成1 mol O2分子放出的能量不相等的主要原因。
〖例2〗 已知:①1 molH2分子中化学键断裂时需要吸收436 kJ的能量;②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量;③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量。下列叙述正确的是 ( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是:H2(g)+C12(g)=2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183 kJ/mol
C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=一183 kJ/mol
D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H=一183 kT/mol
〖变式题2〗化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6分子结构如下图所示,现提供以下化学键的键能(kJ·mol—1):P—P:198,P—O:360,O=O:498,则反应P4(白磷)+3O2=P4O6的反应热△H为 ( )
白磷(P4) 六氧化四磷(P4O6)
A.一1638 kJ·mol1 B.+1638 kJ·mol1 ——
C.一126 kJ·mol—1 D.+126 kJ·mol—1
〖变式题3〗已知破坏1 mo N≡N键、H—H键和N—H键分别需要吸收的能量为946 kJ、436 kJ、391 kJ。试计算1 molN2(g)和3 mol H2(g)完全转化为NH3(g)的反应热的理论值。
【导 练 达 标】
1.下列说法中,正确的是 ( )
A.反应热指的是反应过程中放出的热量。

2
高二化学导学案 选修 化学反应原理 专题1 第一单元 化学反应中的热效应 高二化学备课组 编号:02
B.热化学方程中的化学计量数可以表示分子的数目。
C.在热化学方程式中必须表明物质的聚集状态。
D.所有的化学反应都伴随着能量的变化。
2.下列说法中,正确的是 ( )
A.需要加热才能发生的反应一定是吸热反应。
B.化学反应中的能量变化只能表现为热量的变化。
C.当反应物的总能量高于生成物的总能量时,通常发生放热反应。
D.当反应物的总能量高于生成物的总能量时,通常发生吸热反应。
3.已知热化学方程式2H2(g)+ O2(g)== 2H2O(l),△H= —571.6KJ/mol。下列有关叙述中,错误的是 ( )
A.2mol H2完全燃烧生成液态水时放出571.6KJ能量。
B.1mol H2完全燃烧生成液态水时放出285.8KJ能量。
C.2个氢分子完全燃烧生成液态水时放出571.6KJ能量。
D.氢气在氧气中完全燃烧生成液态水的热化学方程式还可以表示为:
H2(g)+ 1/2O2(g)==== H2O(l),△H=—285.8KJ/mol
4.已知H2(g)+ Cl2(g)====2HCl (g)△H= —184.6KJ/mol,则反应
HCl(g)====1/2 H2(g)+1/2 Cl2(g)的△H为 ( )
A.184.6 KJ/mol B.—92.3 KJ/mol C.—369.2 KJ/mol D.92.3 KJ/mol
5.下列各图中,表示正反应是吸热反应的图是 ( )
6.下列各组热化学方程式中,化学反应的△H前者大于后者的是 ( ) ①C(s)+O2(g)===CO2(g);△H1 C(s)+1/2O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
③H2(g)+1/2O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)===Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
7.如右图所示,把试管放入盛有25℃时饱和石灰水的
中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试
下列问题:
(1)实验中观察到的现象是。
(2)产生上述现象的原因
是 。
(3)写出有关反应的离子方程式:。
(4)由实验推知,MgCl2溶液和H2 的总能量 (填“大于”“小于”或“等于”)镁片和盐酸的总能量。
3 烧杯中,试管管中。试回答
高二化学导学案 选修 化学反应原理 专题1 第一单元 化学反应中的热效应 高二化学备课组 编号:02
8.家用液化气的主要成分是丙烷、丁烷、丙烯等,将0.112 rn3(标况)丙烷(C3H8)气体完全燃烧,生成CO2 气体和液态水,放出11 089 kJ热,该反应的热化学方程式为 。
【能 力 提 高】
9.氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为: H2(g) + 1/2O2(g) = H2O(l);△H= —285.8 kJ/mol
CO(g) + 1/2O2(g) = CO2(g);△H= —283.0 kJ/mol
C8H18(l) + 25/2O2(g) = 8CO2(g) + 9 H2O(l);△H= —5518 kJ/mol
CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l);△H= —890.3 kJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是 ( )
A.H2(g) B.C8H18(l) C.CO(g) D.CH4(g)
10.已知热化学方程式:SO2(g)+ 1/2O2
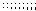
(g) SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为 ( )
A. <196.64kJ B. 196.64kJ/mol C. 196.64kJ D. >196.64kJ
11.已知:①2C2H6(g)+7O2(g)→4CO2(g)+6H2O(g);②2C2H6(g)+7O2(g)→4CO2(g)+6H2O(1)。根据所学过的知识推测:等物质的量的C2H6完全燃烧时放出的热量更多的是 (填①或②),理由是 。
12.已知下列两个热化学方程式;
H2(g)+1/2 O2(g)===H2O(1);△H=-285.6kJ/mol
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1);△H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6164kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol写出丙烷燃烧生成CO2和气态水的热化学方程式
13.通常人们把拆开1mol化学键所吸收的能量看成键能,键能的大小可以衡量化学键的强弱,也可以用于计算化学反应中的反应热(△H),化学反应中的△H等于反应中断裂的化学键
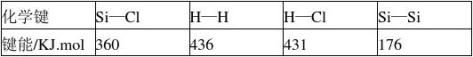
为多少?
【作 业 布 置】P12 练习与实践 3
4 工业上高纯硅可通过下列反应制取: SiCl4(g)+2H2(g)==Si(s)+4HCl(g),该反应的反应热△H
