化学平衡常数及分配系数的测定
1. 简述测定反应KI+I2=KI3的平衡常数的基本原理。
答: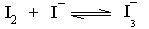 在恒温下,碘(I2)溶在含有碘离子(I-)的溶液中,大部分成为络离子(I3-),并存在下列平衡:
在恒温下,碘(I2)溶在含有碘离子(I-)的溶液中,大部分成为络离子(I3-),并存在下列平衡:
其平衡常数表达式为:
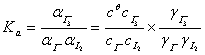 (2)
(2)
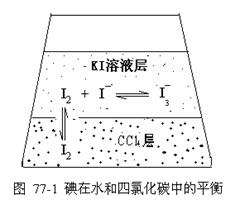 式中:α,c,γ分别为活度,浓度和活度系数。由于在同一溶液中,离子强度相同(I-与I3-电价相同)。由德拜-休克尔公式:
式中:α,c,γ分别为活度,浓度和活度系数。由于在同一溶液中,离子强度相同(I-与I3-电价相同)。由德拜-休克尔公式:
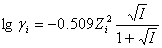 (3)
(3)
计算可知,活度系数
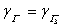 (4)
(4)
在水溶液中,I2浓度很小
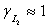 (5)
(5)
一定温度下,故得:
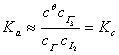 (6)
(6)
为了测定平衡常数,应在不干扰动态平衡的条件下测定平衡组成。在本实验中,当达到上述平衡时,若用硫代硫酸钠标准液来滴定溶液中的I2浓度,则会随着I2的消耗,平衡将向左端移动,使I3-继续分解,因而最终只能测得溶液中I2和I3-的总量。
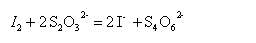
为了解决这个问题,可在上述溶液中加入四氯化碳(CCl4),然后充分震荡 (I-和I3-不溶于CCl4),当温度一定时,上述化学平衡及I2在四氯化碳层和水层的分配平衡同时建立,如图1所示。首先测出I2在H2O及CCl4层中的分配系数Kd,待平衡后再测出I2在CCl4中的浓度,根据分配系数,可算出I2在KI水溶液中的浓度。再取上层水溶液分析,得到I2和I3-的总量。
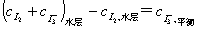 (7)
(7)
由于在溶液中I-总量不变,固有:
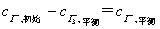 (9)
(9)
因此,将平衡后各物质的浓度代入式(7)就可求出此温度下的平衡常数Kc。
2. 在KI+I2=KI3反应平衡常数测定实验中,所用的碘量瓶和锥形瓶哪些需要干燥?哪些不需要干燥?为什么?
答:配置2号液的碘量瓶需要干燥,配置1号液的碘量瓶和锥形瓶不需要干燥。因为2号液是用来测定平衡浓度的,平衡时I-的浓度是用公式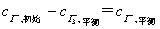 求得,初始的KI浓度必须准确已知,所以必须干燥。1号液是用来测I2在H2O及CCl4层中的分配系数Kd,分配系数与浓度无关,锥形瓶是滴定用的,滴定的是I2的总的物质的量,与浓度无关,因此不需干燥。
求得,初始的KI浓度必须准确已知,所以必须干燥。1号液是用来测I2在H2O及CCl4层中的分配系数Kd,分配系数与浓度无关,锥形瓶是滴定用的,滴定的是I2的总的物质的量,与浓度无关,因此不需干燥。
3. 在KI+I2=KI3反应平衡常数测定实验中,配制1、2号溶液的目的何在?
答:配置1号液是用来测I2在H2O及CCl4层中的分配系数Kd,配置2号液是用来测定反应KI+I2=KI3达平衡时各物质的平衡浓度的。
4. 在KI+I2=KI3反应平衡常数测定实验中,滴定CCl4层样品时,为什么要先加KI水溶液?
答:硫代硫酸钠标准液与溶液中I2的反应是在水层中进行,滴定CCl4层样品的I2时,先加KI水溶液是为了加快CCl4层中的I2借助于反应KI+I2=KI3提取到水层中,有利于Na2S2O3滴定的顺利进行。
5. 在KI+I2=KI3反应平衡常数测定实验中,配制的1、2号溶液是否需要恒温?为什么?
答:需要恒温,因为分配系数Kd和反应平衡常数均与温度有关,定温下为定值。
6. 在KI+I2=KI3反应平衡常数测定实验中,1、2号溶液达平衡后能否拿到恒温槽外取样?为什么?
答:不能,因为反应平衡常数与温度有关,温度改变,平衡会发生移动。
7. 在化学平衡常数及分配系数的测定实验中,如何通过平衡常数求得I3- 的解离焓。
答:测出两个反应温度下的的平衡常数,再由下式可计算的I3-解离焓。
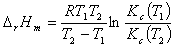
8. 在化学平衡常数及分配系数的测定实验中,为什么应严格控制恒温?如何控制?
答:因为分配系数Kd和反应平衡常数均与温度有关,定温下为定值。所以应严格控制恒温。所配置溶液放在恒温水浴中恒温。
9. 在KI+I2=KI3反应平衡常数测定实验中,需要直接测得哪些实验数据?如何测得?
答:配制的1、2号溶液达平衡后,用硫代硫酸钠标准液来滴定两溶液中的水层和四氯化碳层I2浓度所消耗的硫代硫酸钠标准液的体积。
用标准Na2S2O3溶液滴定碘时,先要滴定至淡黄色再加淀粉溶液滴至水层淀粉指示剂的蓝色消失。取CCl4层样品时勿使水层进入移液管中,为此用洗耳球使移液管尖鼓气情况下穿过水层插入CCl4层中取样。在滴定CCl4层样品的I2时,应加入10ml0.1mol/L的KI水溶液以加快CCl4层中的I2借助于反应KI+I2=KI3提取到水层中,这样有利于Na2S2O3滴定的顺利进行,滴定时要充分摇荡,细心地滴至水层淀粉指示剂的蓝色消失,四氯化碳层不再现红色。滴定后的和末用完的CCl4皆应倒人回收瓶中。
10. 在KI+I2=KI3反应平衡常数测定实验中,如何求得反应达平衡时I2 、I-、I3-的浓度?
答:为了测定平衡常数,应在不干扰动态平衡的条件下测定平衡组成。在本实验中,当达到上述平衡时,若用硫代硫酸钠标准液来滴定溶液中的I2浓度,则会随着I2的消耗,平衡将向左端移动,使I3-继续分解,因而最终只能测得溶液中I2和I3-的总量。
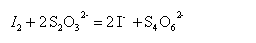
为了解决这个问题,可在上述溶液中加入四氯化碳(CCl4),然后充分震荡 (I-和I3-不溶于CCl4),当温度一定时,上述化学平衡及I2在四氯化碳层和水层的分配平衡同时建立,如图1所示。首先测出I2在H2O及CCl4层中的分配系数Kd,待平衡后再测出I2在CCl4中的浓度,根据分配系数,可算出I2在KI水溶液中的浓度。再取上层水溶液分析,得到I2和I3-的总量。
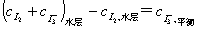 (7)
(7)
由于在溶液中I-总量不变,固有:
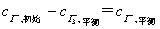 (9)
(9)
因此,将平衡后各物质的浓度代入式(6)就可求出此温度下的平衡常数Kc。
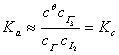 (6)
(6)
11. 在KI+I2=KI3反应平衡常数测定实验中,若吸CCl4层样品时混进水层对结果有何影响?
答:吸CCl4层样品时混进水层会造成CCl4层碘的浓度有误差。
12. 在化学平衡常数及分配系数的测定实验中,吸取CCl4层样品为什么要用洗耳球使移液管尖鼓气情况下穿过水层?
答:防止水层进入移液管中而引起实验误差。
13.装好溶液后的碘量瓶为什么要立即塞紧磨口塞?
答:因为碘和四氯化碳易挥发,故立即塞紧磨口塞是为了防止碘和CCl4挥发。
14. 在KI+I2=KI3反应平衡常数测定实验中,每隔10min震荡一次的目的何在,若震荡时间不够有何影响?
答:每隔10min振荡一次是为了加快分配平衡的到达。若振荡时间不够,没有到达分配平衡,会导致实验结果有误差。
15. 在KI+I2=KI3反应平衡常数测定实验中,滴定过程中哪些要用微量管?哪些要用25mL滴定管?为什么?
答:滴定1号液25ml水层样品和2号液5mlCCl4层时要用微量管,滴定1号液5mlCCl4层和2号液25ml水层样品时用25ml滴定管。因为滴定1号液25ml水层样品和2号液5mlCCl4层时所需硫代硫酸钠体积少,用微量管可以减少滴定误差;而滴定1号液5mlCCl4层和2号液25ml水层样品时硫代硫酸钠所用体积则较多,即要用容量大的滴定管。
16. 在化学平衡常数及分配系数的测定实验中,若温度控制误差超±1℃,有何影响?
答:化学平衡常数及分配系数对温度的影响较为灵敏,若温度控制误差超±1℃,会导致较大的实验误差。
17. 在化学平衡常数及分配系数的测定实验中,在配置系统溶液时,是否需要精确量取,为什么?
答:不需要精确量取。因为最终所需的各浓度都用硫代硫酸钠精确滴定出来,配置系统溶液的多少,不会影响化学平衡常数及分配系数。但至少应能保证实验分析用量。
18. 在化学平衡常数及分配系数的测定实验中,滴定各层碘的浓度的目的何在?
答:滴定1号液的25ml水层样品是为了求出水层中碘的浓度,滴定5mlCCl4层是为了求出CCl4层中碘的浓度,由此来求出分配系数。滴定2号液的25ml水层样品是为了求出水层中碘的总浓度,滴定5mlCCl4层是为了求出CCl4层中碘的浓度,从而求出化学反应达平衡时I2 、I-、I3-的平衡浓度。
第二篇:物化实验一++化学平衡常数及分配系数的测定
实验一 化学平衡常数及分配系数的测定
【实验目的】
1、了解反应KI+I2→KI3。
2、熟悉测定反应的平衡常数及分配系数的一种方法。
【实验器材】
恒温槽1套,250ml碘量瓶3个,50mL移液管,250ml锥形瓶4个,碱式滴定管1支,100ml量筒1个
0.01mol/L Na2S2O3标准溶液,0.1 mol/L KI溶液,分析纯四氯化碳,碘的四氯化碳饱和溶液,0.1%淀粉溶液
【实验原理】
定温、定压下,碘和碘化钾在水溶液中建立如下的平衡:KI+I2→KI3,为了测定平衡常数,若用标准溶液来滴定溶液中I2的浓度,平衡将向左移动,使KI3继续分解,因而最终只能测定溶液中I2和KI3的总量。为了解决这个问题,可在上述溶液中加入四氯化碳,然后充分摇混(KI和KI3不溶于四氯化碳),当温度和压力一定时,上述平衡及I2在四氯化碳和水层的分配平衡同时建立。测得四氯化碳层中I2的浓度,即可根据分配系数求得水层中I2 的浓度。其反应式为:S2O32-+I2→S4O62-+I-,设水层中KI和KI3总浓度为b,KI的初始浓度为c,四氯化碳层I2的浓度为a’,I2在水层及四氯化碳的分配系数为K,实验测定分配系数K及四氯化碳层中I2的浓度a’后,则根据K=a’/a,即可求得水层中I2的浓度a。再从已知c及测得的b,即可求得平衡常数:Kc=[KI3]/[ I2][KI]=(b-a)/a[c-(b-a)]
【实验内容】
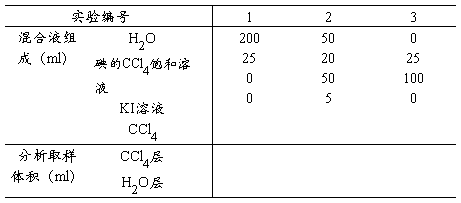
1. 按列表要求将溶液配于碘量瓶中,并将数据记录于表中;
2. 将配好的溶液置于30℃的恒温槽内,每隔5分钟取出震荡一次,约半小时后,按表列数据取样进行分析。
3. 水层分析时,用Na2S2O3滴定,加淀粉溶液做指示剂,然后仔细滴定至蓝色恰好消失。
4. 取CCl4层分析时,用洗耳球使移液管较微鼓泡通过水层进入四氯化碳层,以免水进入移液管中。于锥形瓶中加入10~15ml水,6滴淀粉溶液,然后将四氯化碳层样放入水层(为增快I2进入水层,可加入KI)。小心地滴定至水层蓝色消失,四氯化碳不再显红色。滴定各瓶上、下两层所需Na2S2O3量,记于表中。
5. 滴定后和未用完的四氯化碳层,皆应倾入回收瓶中。
实验数据及其处理
室温: 气压: KI浓度: Na2S2O3浓度:

【实验注意事项】
(1) 整个测定过程,保持在恒温条件下进行。
(2) 为加快反应速度到达平衡即使I2进入水层,可加入KI。
【实验思考题】
(1) 测定平衡常数及分配系数时为什么要求恒温?
(2) 配制1、2、3瓶溶液时,那些试剂需要准确计量其体积?
