实验一 分光光度计法测溶液化学反应的
一、实验目的
1.利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁离子的平衡常数。
2.通过实验了解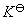 与反应物起始浓度无关。
与反应物起始浓度无关。
3.掌握分光光度计的正确使用方法。
二、实验原理
Fe3+离子与SCN-离子在溶液中可生成一系列的络离子,并共存于同一个平衡体系中。当SCN-离子的浓度增加时,Fe3+离子与SCN-离子生成的络合物的组成发生如下的改变:
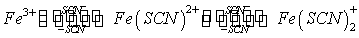

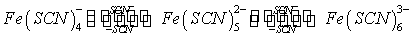
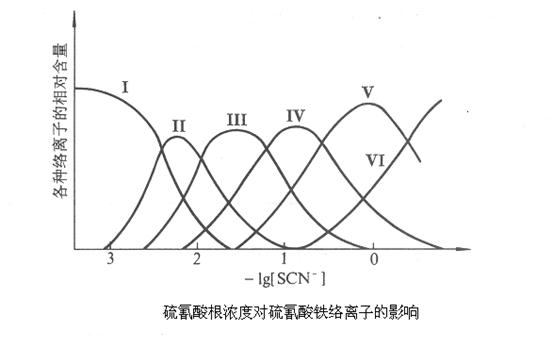
而这些不同的络离子颜色也不同。由图可知,当Fe3+离子与浓度很低的SCN-离子(一般应小于5×10-3mol·dm-3)时,只进行如下反应:

即反应被控制在仅仅生成最简单的Fe(SCN)2+络离子。其标准平衡常数
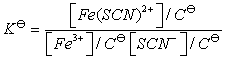
根据朗伯-比尔定律,吸光度与溶液中Fe(SCN)2+络离子浓度成正比。
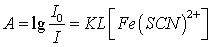
(A为吸光度,K为常数, L为液层厚度)。借助于分光光度计测定溶液的吸光度,可计算出平衡时Fe(SCN)2+络离子的浓度以及Fe3+离子和SCN-离子的浓度,从而求出该反应的平衡常数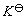 。
。
由于:
(1) Fe3+离子在水溶液中存在下列水解平衡
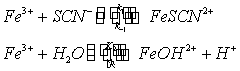

达平衡时

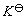 与酸度有关。依此,各实验溶液的pH值必须相同。
与酸度有关。依此,各实验溶液的pH值必须相同。
(2)溶液中离子反应的平衡常数受离子强度影响较大。依此,各被测溶液的离子强度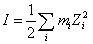 必须保持一致。
必须保持一致。
(3)Cl-、PO3-4等多种阴离子可与Fe3+离子络合,降低Fe(SCN)2+络离子浓度、减弱溶液颜色、甚至完全消失。依此,实验中必须设法避免Cl-、PO3-4等阴离子的参与。
三、仪器与药品
1.仪器
分光光度计1台(带自制恒温夹套); 超级恒温槽1台; 50mL容量瓶4只; 移液管10mL 支、25mL 2支。
2.药品(A.R)
1×10-3mol·dm-3NH4SCN(需准确标定);0.1mol·dm-3FeNH4(SO4)2(需准确标定Fe3+浓度,并加HNO3使溶液的H+浓度为0.1mol·dm-3);1mol·dm-3HNO3;1mol·dm-3KNO3。
四、操作步骤
1.将恒温夹套与恒温槽连接后放入分光光度计的暗合中。将恒温水调到( )℃。
)℃。

2. 取四个50mL容量瓶,编成1#,2#,3#,4#。配制离子强度为0.7,氢离子浓度为0.15mol·dm-3,SCN-离子浓度为2×10-4mol·dm-3,Fe3+离子浓度分别为5×10-2mol·dm-3、1×10-2mol·dm-3、5×10-3mol·dm-3、2×10-3mol·dm-3的四种溶液,先计算出所需的标准溶液量,填写下表:

根据计算结果,配制四种溶液,置于恒温槽中恒温。
3. 用分光光度计测量样品溶液的的吸光度
(1)打开电源开关预热20min,调节工作波长为460nm
(2)调节”MODE”键使仪器呈“透射比T”方式,将挡光体插入比色器架、调节“%T” 键使仪器透光率为零;取出挡光体,调节“100%T”键使仪器透光率100.00。
(3)调节“MODE”键使仪器呈“吸光度A”方式,用蒸馏水调“吸光度OA”键使仪器吸光度为零。
(4)取少量恒温的1# 溶液洗比色皿二次,并把其注入(80%)比色皿中、置于夹套中恒温5min,然后准确测量溶液的吸光度。更换溶液测定三次,取其平均值;用同样的方法测量2#,3#,4#号溶液的吸光度。
五、数据记录和处理
将测得的数据,填于下表,并计算出平衡常数 值。
值。

(表中浓度单位:mol·dm-3)。
按 Fe3+ + SCN- = Fe(SCN)2+

 0
0
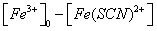
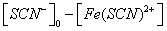
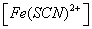
对1# 容量瓶Fe3+离子与SCN-离子反应达平衡时,可认为SCN-离子全部消耗,此平衡时硫氰合铁离子的浓度[Fe(SCN)2+]等于开始时硫氰酸根离子的浓度:
[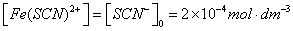
以1# 溶液的吸光度为基准,则对应于2#,3#,4# 溶液的吸光度可求出各吸光度比,而2#,3#,4#各溶液中[Fe(SCN)2+]、[Fe3+]、[SCN-]可分别按下式求得:
[FeSCN2+] = 吸光度比·[FeSCN2+]1#)= 吸光度比·[SCN-]0
[Fe3+]=[Fe3+]0 -[Fe(SCN)2+]
[SCN-]=[SCN-]0 -[FeSCN2+]
六、注意事项
1.使用分光光度计时,先接通电源,预热20min。为了延长光电管的寿命,在不测定数值时,应打开暗盒盖。
2.使用比色皿时,应注意溶液不要装得太满,溶液约为80%即可。并注意比色皿上白色箭头的方向,指向光路方向。
3.温度影响反应平衡常数,实验时体系应始终恒温。
4.实验用水最好是二次蒸馏水。
【思考题】
1.如果Fe3+、SCN-离子浓度较大时则不能按公式
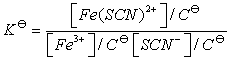
计算 值,为什么?
值,为什么?
2. 为什么可用
[FeSCN2+]= 吸光度比· 来计算[Fe(SCN)2+]?
来计算[Fe(SCN)2+]?
第二篇:物化实验一++化学平衡常数及分配系数的测定
实验一 化学平衡常数及分配系数的测定
【实验目的】
1、了解反应KI+I2→KI3。
2、熟悉测定反应的平衡常数及分配系数的一种方法。
【实验器材】
恒温槽1套,250ml碘量瓶3个,50mL移液管,250ml锥形瓶4个,碱式滴定管1支,100ml量筒1个
0.01mol/L Na2S2O3标准溶液,0.1 mol/L KI溶液,分析纯四氯化碳,碘的四氯化碳饱和溶液,0.1%淀粉溶液
【实验原理】
定温、定压下,碘和碘化钾在水溶液中建立如下的平衡:KI+I2→KI3,为了测定平衡常数,若用标准溶液来滴定溶液中I2的浓度,平衡将向左移动,使KI3继续分解,因而最终只能测定溶液中I2和KI3的总量。为了解决这个问题,可在上述溶液中加入四氯化碳,然后充分摇混(KI和KI3不溶于四氯化碳),当温度和压力一定时,上述平衡及I2在四氯化碳和水层的分配平衡同时建立。测得四氯化碳层中I2的浓度,即可根据分配系数求得水层中I2 的浓度。其反应式为:S2O32-+I2→S4O62-+I-,设水层中KI和KI3总浓度为b,KI的初始浓度为c,四氯化碳层I2的浓度为a’,I2在水层及四氯化碳的分配系数为K,实验测定分配系数K及四氯化碳层中I2的浓度a’后,则根据K=a’/a,即可求得水层中I2的浓度a。再从已知c及测得的b,即可求得平衡常数:Kc=[KI3]/[ I2][KI]=(b-a)/a[c-(b-a)]
【实验内容】
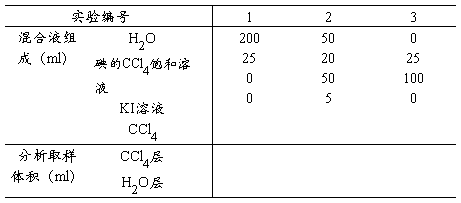
1. 按列表要求将溶液配于碘量瓶中,并将数据记录于表中;
2. 将配好的溶液置于30℃的恒温槽内,每隔5分钟取出震荡一次,约半小时后,按表列数据取样进行分析。
3. 水层分析时,用Na2S2O3滴定,加淀粉溶液做指示剂,然后仔细滴定至蓝色恰好消失。
4. 取CCl4层分析时,用洗耳球使移液管较微鼓泡通过水层进入四氯化碳层,以免水进入移液管中。于锥形瓶中加入10~15ml水,6滴淀粉溶液,然后将四氯化碳层样放入水层(为增快I2进入水层,可加入KI)。小心地滴定至水层蓝色消失,四氯化碳不再显红色。滴定各瓶上、下两层所需Na2S2O3量,记于表中。
5. 滴定后和未用完的四氯化碳层,皆应倾入回收瓶中。
实验数据及其处理
室温: 气压: KI浓度: Na2S2O3浓度:

【实验注意事项】
(1) 整个测定过程,保持在恒温条件下进行。
(2) 为加快反应速度到达平衡即使I2进入水层,可加入KI。
【实验思考题】
(1) 测定平衡常数及分配系数时为什么要求恒温?
(2) 配制1、2、3瓶溶液时,那些试剂需要准确计量其体积?
