原子吸收光谱法测定未知溶液中的铜和镉的含量
一、实验目的
1、学习原子吸收光谱分析法的基本原理;
2、了解原子吸收光谱分析仪的基本结构及使用方法;
3、掌握以标准曲线法测定未知溶液中的铜、镉含量的方法;
4、增强小组协作解决问题的能力。
二、实验原理
原子吸收光谱分析是一种动态分析方法,用校准曲线进行定量。常用的定量方法有标准曲线法、标准加入法和浓度直读法。如为多通道仪器,可用内标法定量。在这些方法中,标准曲线法是最基本的定量方法。
标准曲线法是原子吸收光谱分析中最常用的方法之一,该法是配制已知浓度的标准溶液系列,在一定的仪器条件下,依次测出它们的吸光度,以加入的标准溶液的浓度为横坐标,相应的吸光度为纵坐标,绘制标准曲线。试样经适当处理后,在与测量标准曲线吸光度相同的实验条件下测量其吸光度,根据试样溶液的吸光度,在标准曲线上即可查出试样溶液中被测元素的含量。
三、实验仪器及试剂
1、仪器
原子吸收光谱仪、空气压缩机、乙炔钢瓶、容量瓶、移液管、烧杯
2、试剂
铜、镉贮备液个100ml
四、实验步骤
1、标准溶液的配制
镉标准溶液系列:准确吸取镉贮备液(10ppm)和铜贮备液(10ppm)各0.10ml、0.30ml、0.50ml、1.00ml、2.00ml,分别置于5只10ml容量瓶中,用去离子水稀释至刻度,摇匀备用。该标准溶液系列的镉(铜)浓度分别为0.10ppm、0.30ppm、0.50ppm、1.00ppm、2.00ppm。
2、未知溶液的配制
准确移取未知溶液5ml,置于25ml容量瓶中,用去离子水稀释至刻度,摇匀,以用来测定镉的含量。再准确吸取未知溶液2.5ml,置于25ml容量瓶中,用去离子水稀释至刻度,摇匀,以用来测定铜的含量。
3、加标试样的配制
准确移取镉贮备液和铜贮备液各2.5ml,未知溶液5ml置于50ml容量瓶中,用去离子水稀释至刻度,摇匀,以用来测定镉的含量。再准确吸取镉贮备液和铜贮备液各0.63ml,未知溶液2.5ml置于50ml容量瓶中,用去离子水稀释至刻度,摇匀,以用来测定铜的含量。
4、用原子吸收光谱仪测定
根据实验条件,将原子吸收光谱仪按一定步骤进行调节,然后按照浓度由低到高的原则,依次间隔测量标准溶液,并记录吸光度。然后测定配制好的加标试样,以检验测定结果的准确性。测定结束后,清洁燃烧器,然后关闭仪器。
五、实验结果与数据处理
加标回收率:设未知样品体积为V1,浓度为C1;加标后总体积为V2,浓度为C2;加标体积为VS,浓度为CS。则加标回收率P=(V2·C2 –V1·C1)/ VS·CS 。
1、Cd含量的确定
表1. 不同含量Cd的吸光度

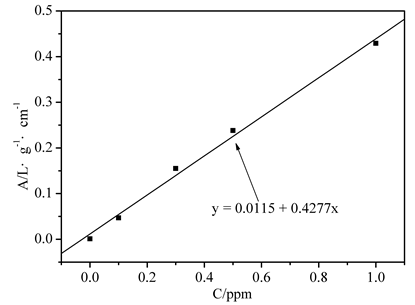
图1. Cd标准曲线及拟合
拟合常数:R = 0.9971
Cd的含量C=0.454×5=2.075 ppm
P=(0.740×50–0.415×25)/(10×2.5)=106.2%
2、Cu含量的确定
表2. 不同含量Cu的吸光度
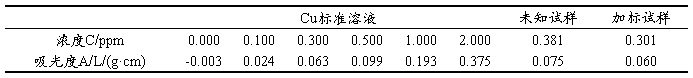
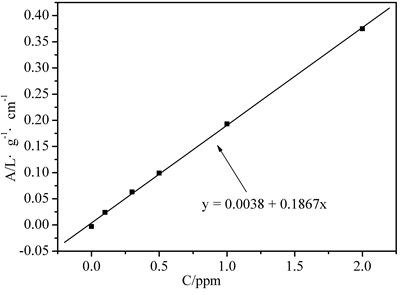
图2. Cu标准曲线及拟合
拟合常数:R = 0.9996
Cu的含量 C=0.381×10=3.81 ppm
P=(0.301×50–0.381×25)/(10×0.63)=87.7%
六、分析与讨论
1、通过绘制Cd标准曲线及拟合图时,Cd标准溶液的浓度大于1ppm时,线性关系明显降低,故在做标准曲线时舍弃Cd离子2ppm时的点,这样各吸光度均分布直线两侧,线性关系明显改变,而Cu的标准曲线与理论吻合较好,因为Cu标准溶液的线性变化范围较大可到10ppm。
2、标准曲线法常用于分析共存的基体成分较为简单的试样。如果试样中共存的基体成分比较复杂,则应在标准溶液中加入相同类型和浓度的基体成分,以消除或减少基体效应带来的干扰,必要时应采用标准加入法进行定量分析。本实验所采取的未知试样为实验室配制的,成分较为简单,试样经稀释后,即可采用标准曲线法进行测定。
3、在采用加标回收方法时:加标量一般要求加标物的浓度较高而体积较小,本实验中Cd和Cu的加标回收率都能取得较满意的效果。
4、应加强分析理论知识的学习,培养和建立分析各种复杂问题的思维能力和分析方法。
七、结论
本实验在小组成员间的互相帮助下取得了较好的结果,通过实验操作加深了对理论知识的理解,也增强团队协作意识,同时也发现了论理论知识缺乏等一系列问题,需要在以后的学习生活中加以弥补。
第二篇:火焰原子吸收光谱法测定污水中的铜 实验报告
火焰原子吸收光谱法测定污水中的铜
****
***学院 广州 510275
* 通讯作者, E-mail: ***@mail2.sysu.edu.cn

引言
由于工业化的发展,金属制品的制造与使用的广泛,使得各种金属元素普遍存在于各种污水(包括工业污水、生活污水和土壤液)之中。随着工业的发展,对环境质量的损害也日益加大,因此国家对工业污水的排放制定了严密的检测要求,特别是其中的金属离子定性定量检测更是重要[1]。随着人口的快速增长和城市化进程的加快,生活污水的排放量剧增,若这些未经处理污水中含有过量的重金属元素,有可能与天然水体中的各种物质作用而被积聚,从而引起二次污染,甚至因被再次饮用而诱发癌症等疾病[2]。土壤是生物生存的重要环境,土壤中各金属(特别是重金属)含量的高低可以从有益到带来麻烦甚至到受污染而产生剧毒,从而影响植物的生长和其周围的水质,最终直接或间接地影响人类的生活和健康,因此对土壤中重金属元素的监测至关重要[3]。
检测水中金属元素常用的方法有分光光度法、原子吸收法(AAS)、电感耦合等离子体原子发射光谱法(ICP-AES)、离子色谱法等。近半个世纪以来,原子吸收光谱法是广泛用于定量测定试样中单独元素的分析方法。其具有选择性级、灵敏度高、取样量少、简便快速等特点,目前也是测定水中金属元素常用的方法。常用的原子化技术有火焰原子化(FAAS)和石墨炉原子化(GFAAS),但就重现性而言火焰原子化要比迄今提出的所有其它原子化方法都好。该法适用于测定易原子化的元素是AAS中应用最为普遍的一种,对大多数元素有较高的灵敏度和检测限,且易于操作[4]。
本实验采用FAAS方法测定污水的铜含量,以标准曲线法进行定量分析,同时通过多次测定以确定方法的精密度和检出限。
1 实验部分
1.1 仪器与试剂
日立 Z-2000火焰/石墨炉原子吸收分光光度计,Cu空心阴极灯。
Cu标准使用液:50 μg/mL,硝酸(A.R.),蒸馏水。
1.2 仪器工作条件
Cu空心阴极灯,波长324.8 nm,灯电流7.5 mA;狭缝宽1.3 nm;读数延时0 s;火焰性质:贫燃焰。
1.3 标准溶液和样品的测定
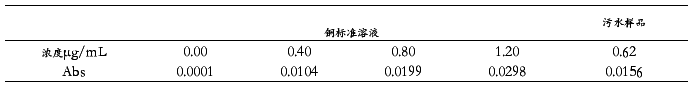
在4个25 mL具塞试管中,各加入2滴HNO3(1+1),再分别准确移取0.00、0.20、0.40、0.60 ml 50 µg/mL Cu标准溶液并依次加入各试管中,则得到质量浓度为0.00、0.40、0.80、1.20 µg/mL的Cu标准样品溶液。启动AAS仪器,设定测定条件,使仪器进入正常工作状态。记录30 s内雾化器的进水量。待仪器基线稳定后将配制好的标准样品溶液依次进样,以吸光度Abs对浓度作图,进行线性回归绘制校准曲线。同时吸入准备好的污水处理液样品在同等条件下检测。
1.4 特征浓度与精密度
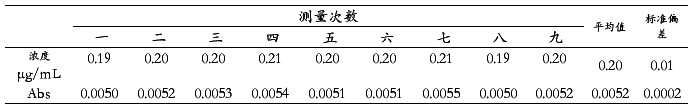
配制0.20 μg/mL的铜标准溶液,用最佳实验条件重复测定9次,计算特征浓度和方法的精密度。
2 结果与分析
2.1 提升量
在一定压力、流量条件下,喷雾器在单位时间内吸入纯水的体积称为提升量。一般来说,提升量在3~6 mL/min时具有最佳的灵敏度。实验中测得,在本实验仪器参数下,喷雾器30 s吸入体积为2.70 mL的纯水,则提升量为5.40 mL/min,位于较好的范围内。
2.2 工作曲线与样品测定
在设定的仪器工作条件下,测得的Cu标准溶液和污水样品的吸光度见表1。对标准溶液的吸光度进行线性拟合,得到直线方程为y=0.0247x+0.0003,相关系数R2=0.9998,可见线性较好。由此方程计算得出污水样品中的铜浓度为0.62±0.01 µg/mL。
2.3 精密度与检出限
对0.20 µg/mL铜标准溶液在设定条件参数下进行9次测定的数据见表2,以下分别用特征浓度、检出限、精密度对方法进行衡量。
特征浓度:能产生1%吸收(或0.0044吸光度)信号时,所对应的被测元素的浓度或被测元素的质量,其单位为μg/mL或μg(或ng)/1%。特征浓度愈小,表明方法灵敏度愈高。特征浓度可由式(1)求出,本实验中标准溶液浓度c=0.20 µg/mL,吸光度平均值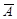 =0.0052,代入式中可得特征浓度
=0.0052,代入式中可得特征浓度 =0.17 µg/mL·1%。
=0.17 µg/mL·1%。
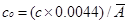 (1)
(1)
检出限:特定的分析方法,以适当的置信水平(一般要求为95%)被检出的最低浓度或最小量。只有存在量达到或高于检出限,才能可靠地将有效分析信号与噪声信号区分开,确定试样中被测元素具有统计意义的存在。检出限可由式(2)求出,本实验中标准溶液浓度c=0.20 µg/mL,置信系数K=3(置信水平为95%),标准偏差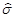 =0.0002,吸光度平均值
=0.0002,吸光度平均值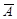 =0.0052,代入式中可得检出限
=0.0052,代入式中可得检出限 =0.02 µg/mL。
=0.02 µg/mL。
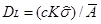 (2)
(2)
精密度:指方法的重现性,常用相对标准偏差 R.S.D.表示。R.S.D可由式(3)求出,本实验中标准偏差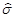 =0.0002,吸光度平均值
=0.0002,吸光度平均值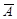 =0.0052,代入式中可得R.S.D=3.8%。
=0.0052,代入式中可得R.S.D=3.8%。
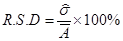 (3)
(3)




2.4 问题与思考
2.3.1 原子吸收分光光度计为何应采用空心阴极灯作光源?
虽然原子吸收光谱中积分吸收与样品浓度呈线性关系,但由于原子吸收线的半宽度很小,如果采用连续光源,要测定半宽度很小的吸收线的积分吸收值就需要分辨率非常高的单色器,目前的技术条件尚达不到,因此只能借助锐线光源,利用峰值吸收来代替。空心阴极灯锐线光源是发射线半宽度远小于吸收线半宽度的光源,光源发射线半宽度很小,并且发射线与吸收线的中心频率一致。这时发射线的轮廓可看作一个很窄的矩形,即峰值吸收系数Kn在此轮廓内不随频率而改变,吸收只限于发射线轮廓内。这样,求出一定的峰值吸收系数即可测出一定的原子浓度。
2.3.2 影响火焰原子吸收光度测定的主要因素有哪
些?如何获得最佳分析结果?
影响火焰原子吸收光度测定的主要因素有灯电流、雾化器、提升量、分析线选择、火焰位置、火焰类型、狭缝宽度和操作员等,以下分别说明影响原因及如何获得好的分析结果。
1)灯电流:火焰原子吸收光谱仪使用光源大都是空心阴极灯,空心阴极灯的灯电流大小决定着灯辐射强度。在一定范围内增大灯电流可以增大辐射强度,同时噪音也增大,但是仪器灵敏度降低。如果灯电流过大,会导致灯本身发生自蚀现象而缩短灯使用寿命;会放电不正常。相反,在一定范围内降低灯电流可以降低辐射强度,仪器灵敏度提高,但灯稳定性和信噪比下降。因此,在具体检测工作中,如被测样浓度高时,则使用较大灯电流,以获得较好稳定性;如被测样浓度低时,则在保证稳定性满足要求的前提下,使用较低的灯电流,以获得较好的灵敏度。
2)雾化器:雾化器作用是将试液雾化。它是原子吸收光谱仪重要部件,其性能对测定灵敏度、精密度和化学物理干扰等产生显著影响。雾化器喷雾越稳定,雾滴越微小均匀,雾化效率也就越高,相应灵敏度越高,精密度越好,化学物理干扰越小。雾化器调节目前都是通过人工调节撞击球和毛细管之间相对位置来实现。应将雾化器调节到雾滴细小而均匀,最好是雾滴在撞击球周围均匀分布。
3)试液提升量:提升量大小影响到灵敏度高低。过高或过低的提升量会使雾化器雾化不稳定。每个厂家仪器提升量范围各不相同,各自有一定变化范围。增大提升量办法有:(1) 增大助燃气流量,这样增大负压使提升量增大;(2)缩短进样管长度,缩短进样管长度使管阻力减小,使试液流量增大。相反,如想降低提升量,则可以减小助燃气流量或加长进样管长度。
4)元素的分析线:每种元素的分析线有很多条,通常共振线灵敏度最高,经常被用来作为分析线,但测量较高浓度样品时,就要选择次灵敏线,即在灵敏性好和干扰小之间选择适宜的分析线。
5)火焰位置:调节燃烧头高度和前后位置,使来自空心阴极灯光束通过自由电子浓度最大火焰区,此时灵敏度最高,稳定性最好。若不需要高灵敏度时,如测定高浓度试液时,可通过旋转燃烧头角度来降低灵敏度,以便有利于检测。
6)火焰类型:火焰类型和状态对灵敏度高低起着重要作用,应根据被测元素特性去选择不同火焰。目前火焰按类型分有空气-氢火焰、空气-乙炔火焰、一氧化氮-乙炔火焰。空气-氢火焰的火焰温度较低,用于测定火焰中容易原子化的元素如砷、硒等;空气-乙炔火焰属于中温火焰,用于测定火焰中较难离解的元素如镁、钙、铜、锌、铅、锰等;一氧化氮-乙炔火焰属于高温火焰,用于测定火焰中难于离解的元素如钒、铝等。火焰按状态分有贫焰、化学计量焰、富焰。贫焰是指使用过量氧化剂时的火焰,由于大量冷的氧化剂带走火焰中的热量,这种火焰温度较低,又由于氧化剂充分,燃烧完全,火焰具有氧化性气氛,所以这种火焰适用于碱金属元素的测定。化学计量焰是按化学计量关系计算的燃料和氧化剂比率燃烧的火焰,它具有温度高、干扰少、稳定、背景低等特点,除碱金属和易形成难离解氧化物的元素,大多数常见元素常用这种火焰。富焰是便用过量燃料的火焰,由于燃烧不完全,火焰具有较强的还原气氛,所以,这种火焰具有还原性,适用于测定较易于形成难熔氧化物的元素如钥、稀土元素等。
7)狭缝:在其他条件一定的情况下,狭缝的大小是决定灵敏度的又一原因。当被测元素无邻近干扰线时,可采用较大的狭缝。当被测元素有邻近干扰线时,可采用较小的狭缝。不引起吸光度减小的最大狭缝宽度为应选择的合适的狭缝宽度。
8)操作者:在仪器条件最佳且一定的情况下,操作者的熟练与决策往往直接影响了分析的结果。因此在实际操作时,实验人员必须严格按照仪器的相关要求来执行,同时细心和仔细地分析一切可能或已经出现的问题,实验过程必须符合分析化学的严谨性要求。
2.3.3 雾化器的提升量和雾化效率为什么会影响分析方法的灵敏度?
雾化室的作用是使气溶胶的雾粒更为细微、更均匀,并与燃气、助燃气混合均匀后进入燃烧器。雾化室中装有撞击球,其作用是把雾滴撞碎,还装有扰流器,可以阻挡大的雾滴进入燃烧器,使其沿室壁流入废液管排出,还可使气体混合均匀。它是原子吸收光谱仪重要部件,其性能对测定灵敏度、精密度和化学物理干扰等产生显著影响,是影响火焰原子化法灵敏度提高与检测限降低的主要因素。雾化器喷雾越稳定,雾滴越微小均匀,雾化效率也就越高,相应灵敏度越高,精密度越好,化学物理干扰越小。雾化器调节目前都是通过人工调节撞击球和毛细管之间相对位置来实现。应将雾化器调节到雾滴细小而均匀,最好是雾滴在撞击球周围均匀分布。
在合理的范围内,较大提升量可以得到较大的吸光度信号,能提高测量灵敏度,但噪声也会增加。过高或过低的提升量会使雾化器雾化不稳定,若提升量过大,导致雾化不完全,浪费试剂的同时可能使废液排出不及时,而且会对火焰有冷却效应。每个厂家仪器提升量范围各不相同,各自有一定变化范围。定标和测量必须用同样的提升量进样,才能保证测量结果的准确。
2.3.4 调节燃烧器的位置应达到什么目的?
调节燃烧头高度和前后位置,使来自空心阴极灯光束通过自由电子浓度最大火焰区,此时灵敏度最高,稳定性最好。若不需要高灵敏度时,如测定高浓度试液时,可通过旋转燃烧头角度来降低灵敏度,以便有利于检测。总之,通过调节燃烧器的位置可以选择到最合适的检测点(灵敏度较高、干扰较小)。
2.3.5 富燃性火焰适合于哪些元素分析?
富焰是便用过量燃料的火焰,由于燃烧不完全,火焰具有较强的还原气氛,所以,这种火焰具有还原性,适用于测定较易于形成难熔氧化物的元素如钥、稀土元素等。
2.3.6 原子吸收定量分析时为什么要采用标准溶液浓度校准?
原子吸收是一种相对而不是绝对的分析技术,基体也有一定的吸光值,其对被测元素的定量必须通过对标准溶液或标准物质的相比较而得到,同时通过选择合适的定量校准技术或标准溶液,可消除许多干扰。
2.3.7 污水中重金属分析为什么要进行消化处理?
要测定的是污水样品中的重金属总量,而污水样品基体是复杂的,含有各种有机物等可能干扰测定,同时待测金属元素在样品中的分布和状态不是单一的,有离子态,有原子态的,也有形成分子而沉淀的或是与有机物配位形成络合物等。通过消化处理,可以金属的几乎全部转化为离子态,同时使得提取液成分变得更加简单,从而即可尽量保持与标准溶液基体一致,又可尽量降低复杂成分对原子吸收的干扰。
2.3.8 为什么有高的灵敏度不一定有低的检出限?在原子吸收分析中,特征浓度与灵敏度如何区别?
灵敏度的定义为分析物浓度或量的微小变化灵敏所产生的分析信号的变化,在原子吸收中即为ΔAbs/Δc,它的实质为工作曲线的斜率。而检出限指,在特定的分析方法下,以适当的置信水平(一般要求为95%)被检出的最低浓度或最小量度,其公式见式(2)。灵敏度和检测限都是衡量分析方法和仪器性能的重要指标,检出限考虑了噪声的影响,其意义比灵敏度更明确。同一元素在不同仪器上有时灵敏度 相同,但由于两台仪器的噪声水平不同,检测限可相差一个数量级以上。
在原子吸收光度法中,特征浓度 表示给定条件下能产生1%吸光度的样品浓度,是仪器灵敏度的一种表示方法,其公式见式(1)。从属关系上讲,特征浓度只是灵敏度的一种衡量指标,其为相对灵敏度,不包含测定时的噪声。
表示给定条件下能产生1%吸光度的样品浓度,是仪器灵敏度的一种表示方法,其公式见式(1)。从属关系上讲,特征浓度只是灵敏度的一种衡量指标,其为相对灵敏度,不包含测定时的噪声。
2.3.9 怎样测定检出限?检测限与检出限有什么区别?
检出限的定义与公式上文已有所提及,其测定可将仪器调整到最佳工作状态后,对同一溶液进行多次(一般不少于10次)测量,计算吸光度的平均值和标准偏差,代入公式(2)计算火焰法浓度检出限。
虽然全国自然科学名词审定委员会公布的《化学名词》中并未规定“检测限(detectability)”一词,但实际上该词也在广泛的应用。1997年通过的《分析术语纲要》没有单独定义“检测限”,但有“minimum detectability”,其定义为流动相中样品组分在检测器上产生两倍基线噪声信号时相当的浓度或质量流量。而比较式可知,两者公式的区别仅在于K值的不同,可见,IUPAC规定的“minimum detectability”实际上是“检出限”的另外一种提法[5]。
4 结论
本文采用火焰原子吸收光谱法(FAAS)测定了污水中的铜含量,当铜含量在0.01-1.2 µg/mL范围内浓度与吸光度呈正比关系,工作曲线线性相关系数为0.9998,方法特征浓度为0.17 µg/mL·1%,检出限为0.01 µg/mL,R.S.D为3.8%。实验结果表明:污水处理液样品中的铜含量为0.62±0.01 µg/mL。实验过程快速而简便,实验数据准确可信。
 参考文献
参考文献
1 陈峰华. 利用UV-260型分光光度计进行污水金属离子检测. 太原重型机械学院学报. 2004, 04: 259-261.
2 董维广, 吕孝江, 刘志涛. 生活污水中金属离子含量的测定与分析. 牡丹江师范学院学报. 2006, 03: 35-36.
3 吴红文, 黄坚萍. 微波消解-ICP-AES法测定土壤中的金属元素. 上海水务. 2007, 23: 14-16.
4 耿薇, 郑敏, 魏永生, 马占营. 原子吸收光谱法检测水中金属元素的研究进展. 咸阳师范学院学报. 2010, 25: 41-44.
5 杜进祥. 分析化学中的检出限、测定限与检测限. 广西师范大学学报. 2003, 21: 349-350.
