实验七 蛋白质含量测定
测定蛋白质的定量方法有很多,目前常用的有染料法,双缩脲(Biuret)法,酚试剂法(Lowry)法及紫外吸收法。
[目的要求]
1.掌握测定蛋白质的含量基本方法。
2.了解染料法、双缩脲法、Lowry法和紫外吸收法测定原理。
一、染料法
[实验原理]
在酸性溶液中染料考马斯亮蓝G-250与蛋白质结合,此时考马斯亮蓝G-250颜色从红色变为蓝色,吸收高峰从460nm移至595nm。利用这个原理可以测定蛋白质含量。
该法近年在某些方面有取代经典的Lowry法趋势,因为它操作简单,反应时间短,染料-蛋白质颜色稳定,抗干扰性强。本法的缺点是:对于那些与标准蛋白氨基酸组成有较大差异的蛋白质,有一定误差,因为不同的蛋白质与染料的结合是不同的,故该法适合测定与标准蛋白质氨基酸组成相近的蛋白质。
[器材]
吸量管; 试管;721型分光光度计
[试剂]
1.标准牛血清白蛋白溶液:配成0.1mg/ml的溶液。
2.待测蛋白质溶液。
3.染料溶液:称取考马斯亮蓝G-250 0.1g溶于95%的酒精50ml,再加入85%的浓磷酸100ml,用水稀释至1000ml,混匀备用。
[操作步骤]
1. 标准曲线的绘制:
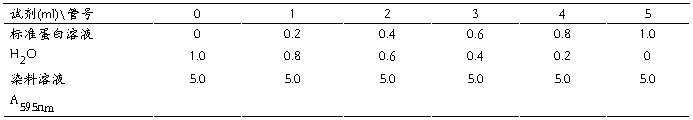
按上表分别向各支试管内加入各种试剂,充分混匀,5min后在595nm波长处以0号管调零,测定各管吸光度值(A)。以吸光度值为纵坐标,蛋白质浓度为横坐标绘制标准曲线。
2.样品测定:
取1ml样品溶液(约含25~250微克蛋白质),加入染料溶液5ml混匀,5min后测定其595nm吸光度值,对照标准曲线求得蛋白质浓度。
二、双缩脲(Biuret)法测定蛋白质含量
[实验原理]
在碱性溶液中,双缩脲(H2N-CO-NH-CO-NH2)与二价铜离子作用形成紫红色的络合物,这一反应称双缩脲反应。凡分子中含二个或二个以上酰胺基(—CO-NH2),或与此相似的基团[如—CH2-NH2,—CS-NH2,—C(NH)NH2]的任何化合物,无论这类基团直接相连还是通过一个碳或氮原子间接相连,均可发生上述反应。蛋白质分子含有众多肽键(—CO-NH—),可发生双缩脲反应,且呈色强度在一定浓度范围内与肽键数量即与蛋白质含量成正比,可用比色法测定蛋白含量。测定范围为1~10mg蛋白质。干扰这一测定的物质主要有:硫酸铵、Tris缓冲液和某些氨基酸等。
此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。主要的缺点是灵敏度差。因此双缩脲法常用于快速,但并不需要十分精确的蛋白质测定。
[试剂]
1.双缩脲试剂: 取CuSO4·5H20(c.P.)1.5g和酒石酸钾钠(c.P.)6.0g以少量蒸馏水溶解,再加2.5mol/L NaOH溶液300ml,KI 1.0g,然后加水至1000ml。棕色瓶中避光保存。长期放置后若有暗红色沉淀出现,即不能使用。
2.标准蛋白质溶液: 用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10g/L的标准蛋白溶液,可用BSA浓度1g/L的A280为0.66来校正其纯度。如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。牛血清清蛋白用H2O 或0.9%NaCl配制,酪蛋白用0.05mol/L NaOH配制。
[器材]
1.试管:15×150mm 试管7只 ;
2.1ml,5ml移液管;
3.坐标纸 ;
4.721分光光度计。
[操作步骤]
取试管7支,编号,按下表操作:
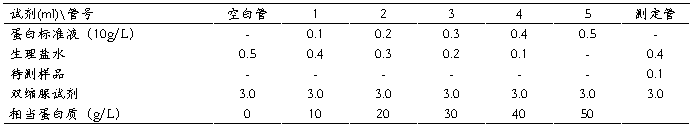
混匀,37℃水浴20分钟,冷却至室温,在分光光度计波长540nm处,用空白管调零,读取各管吸光度值。1~5为标准曲线管,测得吸光度后,以吸光度为纵坐标,蛋白质浓度为横坐标绘制标准曲线。以测定管的吸光度,在标准曲线上求得蛋白质浓度。
[注意事项]
1.双缩脲试剂中,加入酒石酸钾钠,Cu2+形成稳定的络合铜离子,以防止CuSO4·5H20不稳定形成Cu(OH)2沉淀。酒石酸钾钠与CuSO4·5H20之比不低于3∶1,加入KI作为抗氧化试剂。
2.双缩脲试剂要封闭贮存,防止吸收空气中的二氧化碳。
3.本法各种蛋白质的显色程度基本相同,重复性好,几乎不受温度影响,唯一缺点是灵敏度较低。
4.黄疸血清、严重溶血对本法有明显干扰。
[思考题]
1.双缩脲法测定蛋白质的原理是什么?其它还有什么方法测定蛋白质的含量?
2.请用双缩脲法,设计一个测定蛋白质含量的定量方法(除标准曲线法外)。
三、酚试剂法测定血清蛋白质含量
(改良Lowry法)
[实验原理]
蛋白质分子中所含肽键在碱性条件下与铜络合生成复合物产生紫红色化合物(双缩脲反应),同时使肽链展开,蛋白质中半胱氨酸、络氨酸、色氨酸和组氨酸均能使钨酸、钼酸同时失去1个,2个或者3个氧原子,还原成多种还原型的混合酸,并且有特殊的蓝颜色(最大吸收峰波长为745~750nm,反应式一)其蓝色深浅与蛋白质含量在一定范围内成正比,由此可测出样品中蛋白质的含量。同时蛋白质肽键发生烯醇化反应(反应式二)能使钼离子在pH10时螯合在肽结构中,形成复合物,从而使电子转移到混合酸的显色剂上,大大增加了酚试剂对蛋白质的敏感性。
反应式一 3H2OP2O5?13WO3?5MoO3?10H2O
3H2OP2O5?14WO3?4MoO3?10H2O

反应式二 3H2OP2O5?13WO2?5MoO3?10H2O
3H2OP2O5?14WO2?4MoO2?10H2O

烯醇化反应后,可与Cu2+络合,络合后,易于使肽释放电子,使酚试剂还原。
[试剂器材]
1.碱性铜试剂:
甲液:称取无水碳酸钠2.0g,溶于0.1mol/L NaOH溶液100ml中。
乙液:取硫酸铜(CuSO4 ?5H2O )0.5g,溶于1%酒石酸钾溶液100ml中。
临用前取甲液50ml,乙液1ml混合,即为碱性铜试剂。此液需现用现配。
2.标准蛋白质溶液(250 mg/ml):精确称取结晶牛血清清蛋白25mg,溶于0.9%NaCl溶液中,以容量瓶定容至100ml。
3.样品:取血清0.1ml,置于50ml容量瓶中,用0.9%NaCl溶液稀释至刻度处,混匀,为待测血清样品。
4.酚试剂:取钨酸钠(Na2WO4?2H2O)100g和钼酸钠(Na2MoO4?2H2O)25g,溶于700ml蒸馏水中,再加入85%磷酸50ml和浓硫酸100ml充分混匀,置于1500ml圆底烧瓶中温和地回流10小时,冷却,取下冷凝装置,再加入硫酸锂(Li2SO4?2H2O)150g,水50ml,溴3~4滴,开口继续沸腾15分钟,驱除过量的溴,冷却后稀释至1000ml,过滤,溶液应呈黄色或金黄色(如带绿色不能使用,应继续加溴煮沸),置于棕色瓶中保存。使用前,以酚酞为指示剂,用0.1mol/LNaOH溶液滴定,求出酚试剂的摩尔浓度。然后根据此浓度,将酚试剂用蒸馏水稀释至最后酸度为1mol/L。(滴定时可将酚试剂稀释,以免颜色影响)。试剂放置过久,变成绿色时,可再加溴数滴煮15分钟,如能恢复原有的金黄色仍可使用。
5.721分光光度计;旋涡混合器;秒表;试管。
[操作步骤]
取试管7支,编号,按下表操作:

混匀,室温放置30min后,以0管调零点,在波长650nm比色,分别读取各管吸光度值。以蛋白质含量为横坐标,吸光度值为纵坐标,绘制标准曲线。以测定管吸光度值,查标准曲线求得血清蛋白质含量。
[临床意义]
1.血清总蛋白浓度增高:
(1)血清中水分减少,而使蛋白浓度相对增高。如急性失水时(呕吐、腹泻、高热);休克时,由于毛细管通透性的变化,血浆也发生浓缩等。
(2)蛋白合成增加,大多数发生多发性骨髓瘤患者中,主要是血清球蛋白增加。
2.血清蛋白合成降低:
(1)合成障碍,主要为肝功能障碍,肝脏是合成蛋白质的场所,肝功严重损害时,蛋白质的合成减少,以白蛋白最为显著。
(2)蛋白质丢失,如严重灼伤时,大量血浆渗出;肾病综合症时,尿液中长期丢失蛋白质等。
(3)营养不良或长期消耗性疾病,如严重结核或长期消耗性疾病。
(4)血液中水分增加,血浆被稀释,因各种原因引起的水钠潴留或输注过多低渗溶液。
[注意事项]
1.酚试剂在酸性条件下较稳定,而碱性铜试剂是在碱性条件下与蛋白质相互作用,所以当加入酚试剂后,应迅速摇匀(加一管摇一管),使还原反应发生在磷钼酸-磷钨酸试剂被破坏之前。
2.碱性铜试剂必须临用前配制。
3.磷钼酸、磷钨酸的显色反应是由于和还原物质的还原反应而引起的,因此本法可受很多还原性物质的干扰,如带有-SH的化合物,糖类、酚类等甚至有些缓冲剂(如Tris)也能干扰测定。但如控制在低浓度范围内,则不影响测定,Lowry法很灵敏,可以对5~100μg蛋白质样品进行很好的显色反应,而如此低的蛋白质浓度常常已把干扰物质的浓度稀释到一个不起作用的水平。
4.所有器材必须清洗干净,否则影响实验结果。
5.血清稀释的倍数应使蛋白质含量在标准曲线范围内,若超过此范围需要将血清酌情稀释。
6.本法操作简便、灵敏度高,缺点是试剂只与蛋白质中半胱氨酸、色氨酸等起反应,因此可因各种蛋白质中含这几种氨基酸的量不同使显色强度稍有不同。
[思考题]
1.用酚试剂法测定蛋白质含量有哪些优点?
2.用酚试剂法测定蛋白质含量有哪些干扰作用?应如何注意?
四、紫外吸收法
[实验原理]
蛋白质分子中,酪氨酸、苯丙氨酸和色氨酸残基的苯环含有共轭双键,使蛋白质具有吸收紫外光的性质。吸收高峰在280nm处,其吸光度(即光密度值)与蛋白质含量成正比。此外,蛋白质溶液在238nm的光吸收值与肽键含量成正比。利用一定波长下,蛋白质溶液的光吸收值与蛋白质浓度的正比关系,可以进行蛋白质含量的测定。
紫外吸收法简便、灵敏、快速,不消耗样品,测定后仍能回收使用。低浓度的盐,例如生化制备中常用的(NH4)2SO4等和大多数缓冲液不干扰测定。特别适用于柱层析洗脱液的快速连续检测,因为此时只需测定蛋白质浓度的变化,而不需知道其绝对值。
此法的特点是测定蛋白质含量的准确度较差,干扰物质多,在用标准曲线法测定蛋白质含量时,对那些与标准蛋白质中酪氨酸和色氨酸含量差异大的蛋白质,有一定的误差。故该法适于用测定与标准蛋白质氨基酸组成相似的蛋白质。若样品中含有嘌呤、嘧啶及核酸等吸收紫外光的物质,会出现较大的干扰。核酸的干扰可以通过查校正表,再进行计算的方法,加以适当的校正。但是因为不同的蛋白质和核酸的紫外吸收是不相同的,虽然经过校正,测定的结果还是存在一定的误差。
此外,进行紫外吸收法测定时,由于蛋白质吸收高峰常因pH的改变而有变化,因此要注意溶液的pH值,测定样品时的pH要与测定标准曲线的pH相一致。
[试剂器材]
1.蛋白质标准液(1mg/ml): 准确称量经微量凯氏定氮法校正的标准蛋白质配制。
2.紫外分光光度计。
[操作步骤]
1.标准曲线的绘制:
取8支试管,按下表编号并加入试剂:

混匀。在280nm处测定各管溶液的吸光度值。以0号管调零,以蛋白质溶液浓度为横坐标,吸光度值为纵坐标,绘制出蛋白质标准曲线。
2.蛋白质样品溶液,在280nm处测得吸光度值,从标准曲线上查出其浓度。
[注意事项]
1.蛋白质的最高吸收峰可因pH的改变而发生变化,因此要注意保持待测蛋白质溶液的pH值与标准蛋白质溶液一致。
2. 测定液必须澄清,以免造成结果误差。
3.本法需用石英比色杯。
[思考题]
1.为什么紫外吸收法可作为蛋白质定量测定方法?其理论依据是什么?
2.此法测定蛋白质具有什么特点?
实验二十一紫外光吸收法测定蛋白质浓度
目的和要求
了解紫外吸收法测定蛋白质浓度的原理。熟悉紫外分光光度计的使用。
原理
蛋白质组成中长含有酪蛋白和色氨酸等芳香族氨基酸,在紫外光280nm波长处有最大吸收峰,一定浓度范围内其浓度与吸光度成正比,故可用紫外分光光度计通过比色来测定蛋白质的含量。
由于核酸在280nm波长处也有光吸收,对蛋白质测定有一定的干扰作用,但核酸的最大吸收峰在260nm处。如同时测定260nm的光吸收,通过计算可以消除其对蛋白质测定的影响。因此如溶中存在核酸时必须同时测定280nm及260nm的吸光度,方可通过计算测得溶液中的蛋白质浓度。
操作步骤
一.直接测定法
在紫外分光光度计上,将未知的蛋白质溶液小心盛于石英比色皿中,以生理盐水为对照,测得280nm和260nm两种波长的吸光度(A280nm及A260nm)。
将A280nm及A260nm波长处测得的吸光度按下列公式计算蛋白质浓度。
C = 1.45A280nm -0.74A260nm
式中C:蛋白质质量浓度(mg/ml);
A280nm:蛋白质溶液在280nm处测得的吸光度;
A260nm:蛋白质溶液在260nm处测得的吸光
本法对微量蛋白质的测定既快又方便,它还适用于硫酸铵或其他盐类混杂的情况,这时用其他方法测定往往较困难。
为方便起见对于混合蛋白质溶液,可用A280nm乘以0.75来代表其中蛋白质的大致含量(mg/ml)。
(二)标准曲线
- 标准曲线的绘制
取8支干净试管,编号,按下表加入试剂。

加毕,用紫外分光光度计测A280nm,以吸光度为纵坐标,蛋白质浓度为横坐标作图。
- 样液测定
取未知浓度的蛋白液1.0ml,加蒸馏水3.0 ml,测A280nm,对照标准曲线求得蛋白质浓度。
试剂和器材
一、试剂
1. 卵清蛋白标准液:约1g卵清蛋白溶于100ml0.9%NaCl溶液,离心,取上清液,用克氏定氮法测定其蛋白质含量。根据测定结果,用0.9%NaCl溶液稀释卵清蛋白溶液,使其蛋白质含量为1mg/ml。亦可用1mg/ml的牛血清白蛋白溶液。
2. 未知浓度蛋白质溶液:用酪蛋白配制,浓度控制在1.0~2.5mg/ml范围内。或用稀释血清代替:准确吸取0.1ml血清置于50ml容量瓶中,用生理盐水稀释至刻度。
- 0.9%NaCl。
二. 器材
1. 752型分光光度计。
2. 容量瓶50ml(×1)。
3.试管1.5cm×15cm(×9)。
4. 吸管0.50ml(×1)、1.0 ml(×3)、2.0ml(×2)、5.0ml(×2)。
思考题
1.紫外吸收属于光谱光度分析的哪一类?其基本原理是什么?
2.若样品中含有核酸类杂质,应如何校正?
第二篇:蛋白质含量测定方法的研究
实验一 蛋白质含量测定方法的研究
一、研究背景
蛋白质是生物的重要组成部分,在人类发现蛋白质后一直没有停下过研究得脚步。在实
验室提取蛋白质的过程中,目标蛋白质的来源是广泛的,而不同的样品中目标蛋白质的含量是不同的,为了得到更多的目标蛋白,就需要了解样品中蛋白质的含量。在实际的生活中也需要运用蛋白质含量的测定,例如牛奶、奶粉中蛋白质含量。记得前几年轰动一时三聚氰胺事件,国家的标准蛋白质检测方法被不法分子所利用,通过蛋白质检测方法的缺陷来谋取暴利。目前常用的蛋白质检测方法有五种:凯式定氮法、Folin-酚法、考马斯亮蓝法、紫外法、双缩脲法。不同的方法有不同的优缺点。
二、研究目标
通过四种不同的蛋白质测定方法了解各种方法的优缺点。在不同的条件下,能选择正确的测定方法,从而获得正确的数据。
三、研究策略
根据资料可以知道四种方法的局限性,针对这一个单一的变量设计五组实验。一个是标准对照组,其他四组分别在标准组的基础上引入一种变量。用四种方法分别测定五种溶液。在对同一种溶液的测定结果中,必有一种方法的结果和其他的结果有显著差异,同时与标准液的结果也有显著的差异。我们就认为这组溶液中的变量对于该蛋白质测定的方法影响较大。
四、研究方案及可行性分析
研究方案:
1、配置一组浓度梯度的标准液,分别用四种方法测定,并建立标准曲线。
2、配置五种等浓度的样品蛋白质溶液并编号ABCDE。在配置过程中,A组加10毫升蒸馏水;B组加10毫升嘌呤溶液;C组加入10毫升EDTA溶液;D组加入10毫升双氧水溶液;E组加入10毫升盐酸溶液。
3、分别用四种方法测定五种蛋白质溶液。
4、分析结果
可行性分析:
更具已有资料设计了四个单一的变量,分别针对四种实验的缺点,同时保证没有其他的变量。
预期结果:
在每组实验的结果中分别有一个数据是在横向和纵向上都有显著差异的。我们可以确定这个变量对该实验有很大的影响。
五、具体实验设计
1. 建立标准曲线
紫外法
a.仪器:紫外分光光度仪、移液管、试管和试管架
试剂:标准牛血清蛋白溶液
b.主要步骤
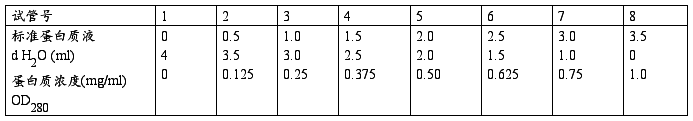
按照上表分别向没知识观众加入各种试剂,混匀。选用光程为1cm的石英比色杯,在280nm下测其光密度值。以OD值为纵坐标,绘制标准曲线。
双缩脲法
a.仪器:分光光度计,分析天平,振荡机刻度吸管,具塞三角瓶,漏斗
试剂:双缩脲试剂,0.05mol/L的NaOH,标准酪蛋白溶液配制成5mg/ml的溶液
b.主要步骤
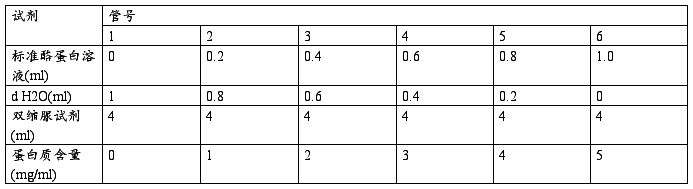
震荡15min,室温静置30min,540nm比色,以蛋白含量(mg/ml)为横坐标,吸光度为纵坐标,绘制标准曲线。
Folin-酚法
a.仪器:722型分光光度计,恒温水浴,具塞刻度吸管15ml*8,小烧杯*2,漏斗及架,分析天平,移液管(0.5ml*1,1ml*2,5ml*1),容量瓶(50ml*1),研钵
试剂:试剂甲(A:10g碳酸钠,2g氢氧化钠,0.5g酒石酸钾钠溶液溶解后蒸馏水定容至500ml;B:0.5g五水硫酸铜溶解后,蒸馏水定容至100ml;使用前将A与B按50:1比例混合,混合液有效期1天),试剂乙(1.5L磨口回流器中加入100g钨酸钠和25g钼酸钠及700ml蒸馏水,再加入50ml85%的磷酸,100ml浓盐酸充分混合,小火回流10h结束后加入150g硫酸锂,50ml蒸馏水及数滴溴,开口沸腾15min。稀释至1L,过滤,使用时加入大约一倍的水),牛血清蛋白标准溶液,在分析天平上精确称取0.0250g结晶牛血清蛋白,溶解后转入100ml容量瓶中,配成标准液(250μg/ml)。
b.主要步骤
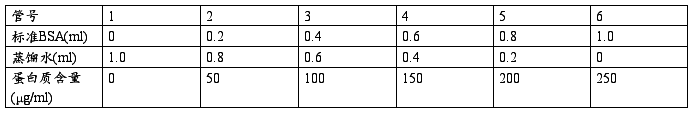
根据上表配好溶液,以后各加试剂甲5ml,混合后在室温下放置10min,再加入0.5ml试剂乙(要立即混匀)。半小时后以不含蛋白质的1号管为对照,用722型分光光度计计于650nm的波长下比色,记录消光值。以消光值为纵坐标,牛血清蛋白含量为横坐标,绘制曲线。
考马斯亮蓝G-250法
a.仪器:721或722型分光光度计,离心机,分析天平(万分之一),药物天平,量筒10ml*1,研钵,烧杯,量瓶10ml*1,刻度吸管1ml*2,0.1ml*2,具塞刻度试管10ml*4,漏斗及架,剪刀
试剂:牛血清蛋白,考马斯亮蓝G250,乙醇
b.主要步骤
(1)0-100μg/ml标准曲线的制作
取6支试管,按下表数据配制成标准溶液各1ml
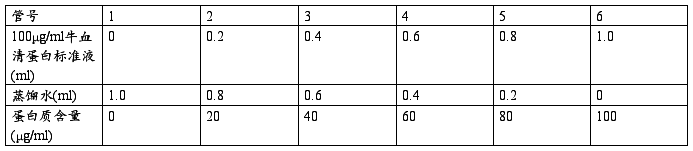
准确吸取所配置的溶液1ml,分别放入10ml的具塞试管中,加入5ml考马斯亮蓝G250蛋白试剂,盖塞,将试管中溶液纵向倒转混合,放置2min后用10mm光径的比色杯在595nm下比色,做出标准曲线。
(2)0-1000μg/ml标准曲线的制作
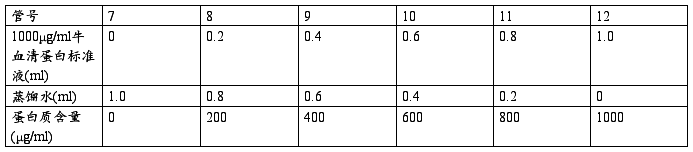
与步骤(1)操作相同,做出0-1000μg/ml标准曲线。
2. 测定待测液蛋白质含量
紫外法
a.配置相同浓度的待测液5个并编号ABCDE。在配置过程中,A组加10毫升蒸馏水;B组加10毫升嘌呤溶液;C组加入10毫升EDTA溶液;D组加入10毫升双氧水溶液;E组加入10毫升盐酸溶液。
b.分别取待测液ABCDE1ml,加入蒸馏水3ml混匀,测其OD280,然后再标准曲线上查出待测液的蛋白质浓度。
c.测定OD280和OD260,并计算OD280/ OD260的比值,根据校正数据表查出此时的校正因子。
d.将原始数据代入经验公式:蛋白质浓度(mg/ml)=F*(1/d)*OD280*D
OD280为该溶液在280nm下的紫外吸收,d为石英比色杯的厚度(cm),D为溶液稀释倍数。
e.计算此时蛋白浓度与未加入干扰时的相对误差,确定是否有明显影响。
双缩脲法
a.将磨碎的样品在80℃条件下烘干至恒重。取出至于干燥器中冷却待用。
b.称取烘干的样品约0.2g两份,分别放入两个干燥三角瓶中。然后再个瓶中分别加入5ml0.05mol/L的氢氧化钠润湿,之后再加入20ml的双缩脲试剂,震荡15min,室温中静置30min,分别过滤,取滤液在540nm波长下比色。在标准曲线上查出相应的蛋白质含量(mg)。
c.称取烘干的样品约0.2g四份,配置五种等浓度的样品蛋白质溶液并编号BCDE。在配置过程中,B组加10毫升嘌呤溶液;C组加入10毫升EDTA溶液;D组加入10毫升双氧水溶液;E组加入10毫升盐酸溶液。测定每一份的蛋白含量d.将原始数据e.代入公式:样品蛋白含量(%)=从标准曲线上查得的蛋白含量(mg)/样品重*100*酪蛋白纯度。
Folin-酚法
a.分别称取绿豆芽下胚轴1g于研钵内,加入适量石英砂,匀浆,转入50ml容量瓶中,定容过滤。获得样品液。配置相同浓度的待测液5个并编号ABCDE。在配置过程中,A组加10毫升蒸馏水;B组加10毫升嘌呤溶液;C组加入10毫升EDTA溶液;D组加入10毫升双氧水溶液;E组加入10毫升盐酸溶液。
b.取具塞试管两支,分别加入1ml滤液,分别加入试剂甲5ml,混合均匀后放置10分钟。然后各加试剂乙0.5ml,迅速混匀,室温下放置30min,于650nm波长下比色,记录吸光值,取平均值完成计算。
原始数据代入公式:样品蛋白含量(%)={[蛋白含量(μg/ml]*样品总体积(ml)]/[样品重(g)*106]}*100%,比较在迅速混合的条件下和有时间间隔的条件下的相对误差。
考马斯亮蓝法
a.称取3g新鲜绿豆芽下胚轴,放入研钵中,滴加适量蒸馏水研成匀浆,转移至离心管仲,放置30min-60min,在4000转/分离心20min,过滤沉淀,上清液转入容量瓶,以蒸馏水定容至50ml。配置相同浓度的待测液5个并编号ABCDE。在配置过程中,A组加10毫升蒸馏水;B组加10毫升嘌呤溶液;C组加入10毫升EDTA溶液;D组加入10毫升双氧水溶液;E组加入10毫升盐酸溶液。
b.吸各个取待测液1ml做一个平行,放入具塞试管中,加入5ml考马斯亮蓝G250,充分混合,放置2min后用10mm光径比色杯在595nm下比色,记录消光值,以标准曲线1号试管做空白。
c.原始数据代入公式,样品蛋白含量=A*(提取液总体积/测定取用体积)/样品重(g),计算相对误差。
3.预期原始数据记录
紫外法

双缩脲法

Folin-酚法

考马斯亮蓝法

六、质疑及相关思考
1.四个变量并不一定是最具有代表性的。
2.ABCDE各组加入的试剂量有待商榷,加入的试剂浓度也没有确定。
七、预习思考题
1.先了解该物质的化学物理性质
其次,确定该物质存在于生物体系中的那个部位或那个部位数量最多
再次,了解目标部位中还存在什么物质,了解这些物质的性质
最后,选用合适的方法提取。
2.结构复杂、容易失活。提取条件温和,保证生物化合物的活性,同时操作要谨慎防止以机械方式破坏结构。
3.生物大分子容易失去活性。缓冲液可以保证大分子的PH环境适宜,防止失活。防止缓冲液中的离子干扰生物化合物的检测。
