实验:福林(Folin)-酚试剂法测定蛋白质的浓度
一、 原理
蛋白质或多肽分子中有带酚基酪氨酸或色氨酸,在碱性条件下,可使酚试剂中的磷钼酸化合物还原成蓝色(生成钼蓝和钨蓝化合物)。蓝色的深浅与蛋白质的含量成正比,可用比色法测定
二、实验仪器
1.卵清蛋白片
2.7220分光光度计
3.试管
4.移液管
三、实验试剂
1.Folin-酚试剂A:碱性铜溶液
甲液:取Na2CO32g溶于100ml0.1mol/l氢氧化钠溶液中
乙液:取CuSO4.5H2O晶体0.5g,溶于1%酒石酸钾100ml中。
临用时按甲:乙=50:1混合使用。
2.Folin-酚试剂B:将100g钨酸钠、25g钼酸钠、700ml蒸馏水、50ml85%磷酸继100ml浓盐酸置于1500ml的磨口圆底烧瓶中,充分混匀后,接上磨口冷凝管,回馏10小时,再加入硫酸锂150g,蒸馏水50ml及液溴数滴,开口煮沸15分钟,在通风橱内驱除过量的溴。冷却,稀释至1000ml,过滤,滤液成微绿色,贮于棕色瓶中。临用时,用1mol/l的氢氧化钠溶液滴定,用酚酞作指示剂,根据滴定结果,将试剂稀释至相当于1mol/L的酸。
3.1mg/mL牛血清蛋白液:称取1g牛血清蛋白片溶于0.9%氯化钠溶液中,并稀释至 1000ml
四、实验步骤
1.标准曲线的绘制
取7支干燥的试管,编号,按下表加入试剂,比色后,以光密度为纵坐标,蛋白质浓度为横坐标作图。
2.样品测定
准确吸取样液0.5ml于干燥的试管中,同样按下表加入试剂,测出光密度值后,对照标准曲线求出样液的蛋白质浓度。
五、实验数据
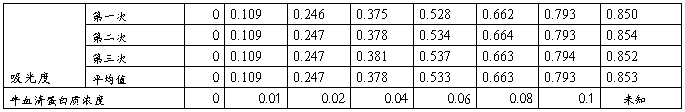
1标准曲线的绘制
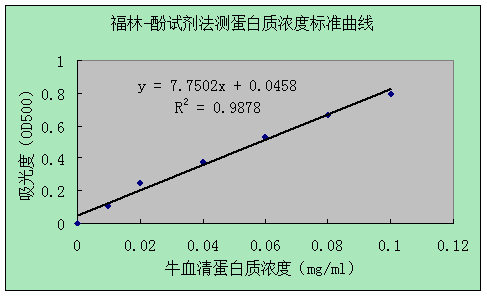
2.样品测定
右上表可知待测样液的蛋白质吸光度y=0.853,则由图可知x=0.104mg/ml
故待测样液的蛋白质浓度为0.104mg/ml×5ml÷0.5ml=1.04mg/ml
六、实验分析
注意事项:
1. 在实验时,不要将牛血清蛋白和样液加反了;
2. 一定要注意实验的时间,因为溶液的光密度值是随着时间在不断增大的,如果时间超过了30分钟,则测得的光密度值就不准确了;
3. 由于分光光度计比较精密,所以往试管中加药品的时候要尽量做到准确;
4. 在使用分光光度计时,那比色皿是要拿它的毛面,不可以用手接触它的光滑面,防止自己手上的油污是测量值不准确;
5. 在擦拭比色皿时,要顺着一个方向擦;
6. 在比色皿中装入的液体量大约要是比色皿体积的三分之二
第二篇:福林酚试剂法测定蛋白质
食品与药品 Food and Drug 20xx年第13卷第03期 147
·知识介绍·
福林酚试剂法测定蛋白质
Lowry O H, Rosebrough N J, Farr A L, Randall R J
自19xx年Wu(吴)提出用福林酚(Folin-酚)试剂测定蛋白质含量 [1],已有许多采用这一试剂的改良分析操作进行血清[2-6]、抗原-抗体沉淀物[7-9]和胰岛素[10]中蛋白质含量测定的报道。
虽然这一试剂以其灵敏度高和操作简便得到推荐,但并不适合普遍的生物化学应用。
尽管这一试剂对某些应用有相当的优势,但在全面开发之前需掌握它的特性和局限性,已研究了pH、反应时间及反应物浓度、处理蛋白质常用试剂的允许水平和干扰物质等变化的影响。本文说明了溶液中或采用酸及其他试剂沉淀后蛋白质,以及低达0.2 μg的微量蛋白质的测定操作。1 方法1.1 试剂
试剂A,含2 % Na2CO3的0.10 mol/L NaOH。试剂B,含0.5 % CuSO4?5H2O的 1 %酒石酸钠或酒石酸钾。试剂C,碱性Cu溶液。试剂A与试剂B以体积比50∶1混合,1 d内使用。试剂D,碳酸铜溶液,与试剂C相同,但不含NaOH。试剂E,稀释的Folin试剂。以酚酞指示终点,用NaOH滴定Folin-酚试剂[11](Eimer and Amend, Fisher Scientific公司,纽约)。以此滴定为基础稀释Folin试剂(约2倍)至酸为1 mol/L(1 N)。人血清稀释100~1000倍(约70~700 μg/mL)用作工作标准物质。此可用结晶牛血清白蛋白标准溶液依次校正(Armour公司,芝加哥);1 μg牛血清白蛋白相当于0.97 μg人血清蛋白(见下文)。实验发现稀释的牛血清白蛋白溶液由于显著的表面变性不适合作为标准。
1.2 溶液中或稀碱中快速溶解蛋白质的操作 (定位于终体积1.1~1.3 mL, 当体积为此值的倍数或分数时可按所述操作1)(注释1见正文最后)
含5~100 μg蛋白质的0.2 mL或更少体积的样品,置于3~10 mL试管中,加入试剂C 1 mL,混匀后室温放置10 min以上。迅速加入试剂E 0.10 mL,并在1~2 s内混匀(见下文)。30 min或更长时间后,用比色计或分光光度计测定样品。终体积中蛋白质含量为5~25 μg/mL时,在波长750 nm左右吸收峰处测定。含量更高的溶液,通过波长500 nm左右的测定使读数保持在可行范围内(见图2)。根据标准曲线计算,如果需要,对现行标准和所测特定蛋白质间的色差值进行校正(见下文)。
加入碱性Cu试剂之前,不需要所有样品的体积与标准
溶液的相同。所给出的校正就是针对终体积的微小差异。关键是碱性Cu溶液和Folin试剂的体积。
若蛋白质已存在于非常稀的溶液中(低于25 μg /mL),0.5 mL蛋白质溶液与0.5 mL两倍浓度的试剂C混合,其他操作如上所述。1.3 不溶性蛋白质等
多数蛋白沉淀物,如钨酸盐沉淀物在碱性Cu试剂中易溶。然而蛋白质经三氯醋酸或高氯酸沉淀后,在0.1 mol/L此碱性试剂中极少溶解。若继续采用脂溶剂提取,蛋白质变得更难溶解,且100 ℃干燥后,溶解难度更大。
下述操作不可能适用于所有情况,但有助于酸沉淀蛋白质的测定。若蛋白质量不多,散布的相当薄,在1 mol/L NaOH中于室温下通常0.5 h左右即可溶解。因此,5~100 μg沉淀蛋白质可加入1 mol/L NaOH 0.1 mL。放置0.5 h或以上,加入试剂D(不含NaOH)1 mL,10 min后常规加入0.1 mL稀释的Folin试剂E。
大样本或较难处理的沉淀物,需要在1 mol/L碱溶液中100 ℃加热10 min以上。虽然这样会造成结果低估,但可重复性强,且可用经相同处理的标准溶液进行测定2(注释2见正文最后)。1.4 微量分析
用适合0.05 mL体积的贝克曼分光光度计[12],可测定低达0.2 μg的蛋白质,且精密度良好。除减少样品和试剂的体积外,唯一可行的改变是采用足够细长的试管进行反应。若试管的直径过大,易造成结果低估。下面是操作的说明,需按序沉淀蛋白质,如,测定相同样品的酸可溶性构成。在这一实例中,假定样品体积忽略不计。另外需采用更小体积较高浓度的三氯醋酸。
含0.2~3 μg蛋白质的样品置于内径3 mm,长4 cm的试管中3(注释3见正文最后),加入5 %三氯醋酸10 μL4(注释4见正文最后),混匀离心后,弃去8 μL上清。沉淀加8 mol/L NaOH 5 μL。样品通过轻敲或震荡5(注释5见正文最后)充分混匀,并用橡皮帽或高分子膜封口。30 min后加入试剂D 50 μL,震荡器混匀,放置10 min以上,加入稀释的Folin试剂E 5 μL并迅速震荡混匀,30 min 后测定。标准溶液的制备可采用10 %三氯醋酸 5 μL分别沉淀5 μL 5 %,10 %,20 %等血清蛋白溶液,后续处理与其他样品相同。2 实验
148 食品与药品 Food and Drug 20xx年第13卷第03期
有两个不同的步骤导致蛋白质的最终显色:(1)与碱性溶液中的Cu反应;(2)Cu处理蛋白质的磷钼酸-磷钨酸试剂还原。
2.1 与碱性溶液中的Cu反应
这一反应的特点如下:(1)不含Cu时显色可能完全归因于所含的酪氨酸和色氨酸[16-17],且碱性预处理不会使色强大增(参考文献4-6和表1)。(2)Cu存在下,碱处理蛋白质可使色增加3~15倍,相反,Cu的存在对游离酪氨酸和色氨酸所显色影响较小(参考文献17, 18和表1)。(3)与Cu的反应虽不是瞬时的,但在所述条件及室温下5~10 min反应接近完全。加热到100 ℃或增加碱浓度可加速与Cu的反应,不改变最终所得色。(4)单独用碱进行预处理并不改变后续与碱性溶液中Cu的反应。即使2 mol/L NaOH 在60 ℃处理1 h或1 mol/L NaOH 100 ℃处理5 min,随之进行常规Cu处理后,对后续色基本无影响。延长与强碱的加热时间反而会降低最终所得色2。
虽然碱性Cu反应和双缩脲反应似有关联,但并不严格
对应,且对于不同的蛋白质,双缩脲显色量与Folin试剂显色中Cu造成的色增加正好成比例(表1)。
极少量的Cu足够给出几近最终色的最大值(表2)。这一反应不是催化反应。假定单一的关系:Cu+蛋白质 Cu-蛋白质,可用低Cu浓度数据计算3×10-6 mol/L与最高达每7或8个氨基酸残基含1 mol生色蛋白结合Cu的表观离解常数(表2)。
推断双缩脲反应中一个Cu原子大约结合4个氨基酸残基[19-20],且Mehl等推算出Cu+蛋白质蛋白质反应的离解常数要比此处报道的Folin-活性物质形成的平均大10倍。因此,与Cu结合的全部可能位点中,大约只有一半可使Folin试剂产生强烈还原,此外,这一部分与其他部分相比,与Cu有更大的亲和力。2.2 Folin试剂的还原
主要做到以下3点:(1)当将Folin试剂加到Cu处理的蛋白质中时,pH 10左右还原显最大色。(2)在此pH下,试剂的活性只维持很短时间[16]。因此,即使完全混匀仅延迟
表1 不同方法处理的蛋白质的消光系数
当量消光系数e750(或550)是指在波长750(或550)nm处,1 L中1 mol N的吸光度(A)。采用Miller和Houghton[24]的凯氏操作测定氮。双缩脲显色通过Weichselbaum[25]试剂。蛋白质的来源:结晶胰蛋白酶,结晶糜蛋白酶和结晶牛血清白蛋白,Armour公司,芝加哥;细胞色素c,Sigma化学公司,圣路易斯;结晶锌胰岛素,礼来公司,印第安纳波利斯;明胶,Difco试验室有限公司,底特律;L-酪氨酸,伊斯曼公司,罗切斯特。
N
e750
蛋白质胰蛋白酶胰岛素糜蛋白酶细胞色素c人血清牛血清白蛋白
明胶酪氨酸
无Cu
未处理碱处理*733910989998278425703738320365312358797813 70013 850
碱性Cu处理+
3 600
3 0002 9302 4952 1202 0501 14515 100
Cu增值2690xxxxxxxxxxxx755169210671250
双缩脲显色
26.324.425.8++21.421.818.0
*加入Folin试剂前,在0.1 mol/L NaOH中室温放置30 min+按所述操作步骤常规处理++由于细胞色素c的颜色,不可行
表2 少量铜造成的色增加
血清蛋白浓度12.1 μg/mL。K和生色-结合Cu(Cu-蛋白质)的计算为:K = Cu×蛋白质/Cu-蛋白质= [Cu (总蛋白质-Cu-蛋白质) ]/ Cu-蛋白质= [Cu (△A *max-△A)]/△A (假定与蛋白质结合的生色Cu与△A成比例)。
总Cu-6
(10 mol/L)
820402 000
*吸光度(A)
(750 nm)166237267286
△A88159189208
△A /△A max百分值
427691100
(×10-6)
2.93.02.8
(计算)
0.050.100.120.13
+摩尔每117 g蛋白质,即每氨基酸残基
食品与药品 Food and Drug 20xx年第13卷第03期 149
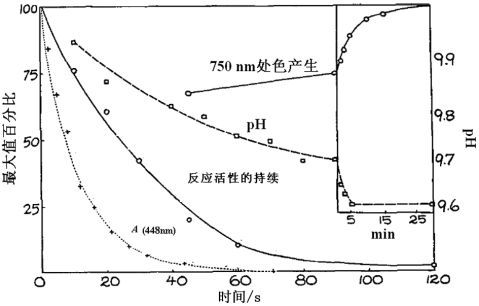
数秒时间,也会降低显色量(图1)。试剂活性的降低是磷钼酸盐原始黄色消失的作用(半衰期8 s,图1),也可归因于磷酸盐从钼酸盐的解离。值得关注的是,当试剂本身对新加入的蛋白质无活性后,仍可与蛋白质在数分钟内持续显色(图1)。吸收光谱在3~30 min内形态改变,这可能是最初还原物质重新排列造成的(图2)。(3)加入Folin试剂后大约1 min内,额外的酸释出(图1),也会导致磷钼酸盐解离。因此,为达最大色,溶液缓冲性必须良好。发现足够中和多余磷酸的NaOH和Na2CO3混合缓冲溶液在pH 10左右,可比单用任一试剂获得更多的色(图3
)。
波长/nm
A
图2 Folin试剂加入到蛋白质溶液(23.3 μg/mL)的吸
收光谱
A(750nm)
6 % Folin试剂
图1 反应活性的持续和色产生
“反应活性的持续”测定是通过加Folin试剂至无蛋白质的碱中;一定时间后,加微量Cu-处理蛋白质,30 min后测定750 nm处A值。“色产生”指的是常规处理的血清蛋白样品。观测“A(448 nm)”各点(无蛋白质存在);曲线是理论上半衰期为8 s的单分子反应。
加入0.1 mL稀释的Folin试剂前计算NaOH浓度。除标注外,Folin试剂终浓度为3 %,Na2CO3为1.6 %。直到Folin试剂加入前几秒,所有样品(Cu处理蛋白质)的组成相同(见正文)。蛋白质终浓度为12 μg/mL。2.3 消光系数和比例
mol/L
图3 碱浓度对最终色生成的影响
不同的纯蛋白质与Folin试剂的消光系数不同(表1)。胰蛋白酶最大和明胶最小,仅在显色性(chromogenicity)因素3有差别。可以发现,无Cu离子,差异更大。必须关注显色性的差异,但不同组织中蛋白质混合物的差异较小(表3),且对很多用途来说,这并不是一个严重的障碍。
色与蛋白质浓度之间并不呈严格地线性(表4)。2.4 特异性和干扰物质
生物学操作中遇到的少许物质可造成严重的干扰。5种不同组织的酸提取物或脂质提取物仅得少量色(表3)。 因
表3 兔全组织和组织提取物经凯氏定氮和Folin显色测得的相近的蛋白质含量
组织经匀浆加工处理,并用5 %三氯醋酸沉淀,0.1 mol/L的醋酸钾乙醇、乙醇和异丙醚连续提取,去除脂质(醋酸盐的作用是中和酸并防止部分蛋白质在乙醇中的溶解)。N的测定见表1。通过N和提取沉淀物的色推算消光系数。
分析的材料
脑肾肝骨骼肌心
*见表1
+通过统计;其他值为直接测定
基于N×6.25基于Folin显色基于N×6.25基于Folin显色基于N×6.25基于Folin显色基于N×6.25基于Folin显色基于N×6.25基于Folin显色
提取的沉淀物/%
9.59.513.913.917.117.117.817.813.013.0
三氯醋酸提取/%
1.080.150.300.490.150.20
脂质提取/%
1.050.280.210.280.090.17
全组织/%11.89.815.914.519.918.020.118.815.313.4+
Ne750
*
19601865187519421975
150 食品与药品 Food and Drug 20xx年第13卷第03期
此,未提取的全组织测量的误差仅3 %~6 %,而基于定N的方法则高估15 %~20 %。
尿酸[16],鸟嘌呤和黄嘌呤[21-22]与Folin试剂发生反应。相同质量的鸟嘌呤比血清蛋白多产生50 %的色。Cu对此色无影响。鸟嘌呤核苷则无任何反应。次黄嘌呤纯化后也不反应[21]。腺嘌呤、阿糖腺苷、胞嘧啶、胞啶、尿嘧啶、胸腺嘧啶和胸腺嘧啶脱氧核苷所得色也几不可测[22]。
以下物质在给定的终浓度时未观察到色或对蛋白质色产生的干扰:尿素 (0.5 %)、胍(0.5 %)、钨酸钠 (0.5 %)、硫酸钠 (1 %)、硝酸钠(1 %)、高氯酸 (中和至0.5 %)、三氯醋酸(中和至0.5 %)、乙醇(5 %)、乙醚(5 %)、丙酮(0.5 %)、硫酸锌(0.1 %)、氢氧化钡(0.1 %)。
硝基苯酚外的大多数酚类,可还原试剂[16];因此,麝香草酚和更少量的磺基水杨酸都有干扰,而苦味酸可容许至0.1 %。甘氨酸(0.5 %)可使蛋白质的显色降低50 %。0.5
%以上的肼可增加空白。
硫酸铵终浓度达0.15 %以上可减少色的发生。这部分地归因于碱性下降,若在样品中加入等量的额外碱,可耐受至0.25 %左右。额外的Cu并无影响。2.5 微量分析
终体积低于0.1 mL,尤其反应在宽试管中进行时,显色量相应地少于大规模。广泛的测试并不能明确地鉴别色减少的原因。氧、二氧化碳和玻璃表面都无影响。关键步骤是与碱和Cu共反应的时期。
这一困难的实际解决可选用细试管并在相同条件下运行标准。表4显示了少量脑样品中蛋白质测定的可重复性。兔脑经过匀浆加工处理并稀释200~2 000倍。取3.6 μL分析蛋白质,终体积为0.082 mL。采用常量分析计算存在的蛋白质的量,误差一般不大于0.02 μg。3 讨论
表4 兔脑中微量蛋白质的测定(终体积0.082 mL)
A*
(750 nm)0.0440.0400.0890.0950.0910.1840.1910.191
*空白校正
E(750 nm)
蛋白质
测定/μg0.150.140.330.350.340.650.670.67
含量/μg0.160.160.330.330.330.660.660.66
A *
(750 nm)0.2920.2830.3650.3670.3650.4410.4430.444
E(750 nm)236233227228227219220221
蛋白质
测量/μg1.030.991.301.311.321.601.621.61
含量/μg1.001.001.321.321.321.661.661.66
221236226228236236
Cu和Folin试剂联合测定蛋白质具有以下优点:(1)与纳氏(Nessler)试剂一样灵敏,而不需要消化;(2)灵敏度为测定280 nm处紫外吸收的10~20倍,特异性更强且对浊度干扰较不敏感;(3)灵敏度为茚三酮反应的数倍[23]且操作简便更适于小规模分析。茚三酮反应中,游离氨基酸比蛋白质显更多色,而与Folin试剂正好相反;(4)灵敏度为双缩脲反应的100倍。
Folin反应有两个主要的缺点:(1)显色量随蛋白质的不同有差异。从这一方面看,Folin反应的稳定情况不如双缩脲反应,但高于测定280 nm处的吸收;(2)色与浓度并不呈严格地比例关系。
考虑到Cu-Folin反应的优点和缺点,这一反应的可能应用包括:(1)酶分级分离等过程中蛋白质的测量;(2)混合组织蛋白质的测量,尤其是不要求绝对值时;(3)绝对微量或高度稀释蛋白质的测量(如脊髓液)及与有色或其他含氮物质混合的蛋白质;(4)相似蛋白质样品的大量分析,如抗原-抗体沉淀物。4 总结
4.1 研究了碱性Cu处理后,采用Folin-酚试剂测量蛋白质的方法。采用该试剂时,需考虑此基本反应具有的确定特性。4.2 给出了溶液中蛋白质和酸沉淀蛋白质等的测量方法。给出了测定低达0.2 μg蛋白质的微量操作。
4.3 记录了显色量与多种蛋白质间的差别。列出了干扰物。4.4 这一反应的简便性和灵敏性优点使其适用于多种生物化学目的。
1
例如,用Klett比色计,将体积不足1 mL的25~500 μg
蛋白质转移至比色计管中,若需要加水至1 mL。加入试剂C 5 mL,10 min后,加试剂E 0.5 mL。30 min后,用66号滤色片,测定读数。若读数过高,则用54号滤色片测定样品,标准溶液和空白。
2
牛血清白蛋白沉淀后很难再溶解。数个40 mg的样品
用三氯醋酸沉淀,乙醇和异丙醚洗涤,并干燥。这些样品在2 mL 1mol/L NaOH中溶解非常缓慢。而放置过夜后,蛋白质几近全溶且溶解部分所得读数为未沉淀样品的97 %。其他样品在1 mol/L NaOH中100 ℃加热30 min,溶解且溶液呈轻微黄色。最终读数核对良好,但仅为未沉淀样品的
食品与药品 Food and Drug 20xx年第13卷第03期 151
82 %。从其他经验判断可能用1 mol/L NaOH 在较低温度下加热即可,与较弱的碱加热无效。用1 mol/L以上的较强碱并无改进。
3
[8] Heidelberger M, MacPherson C F C. Science, 1943, 97:405.[9] Kabat E A, Mayer M M. Experimental immunochemistry,
Spring?eld, 1948, 321.
[10] Sutherland E W, Cori C F, Haynes R, et al. J Biol Chem, 1949,
180:825.
[11] Folin O, Ciocalteu V. J Biol Chem, 1927, 78:627.[12] Lowry O H, Bessey O A. J Biol Chem, 1946, 183:633.
[13] Levy M. Compt.-rend trav Lab Carlsberg, Serie chim., 1945,
21:101.
[14] Bessey O A, Lowry O H, Brock M J. J Biol Chem, 1946, 184:321-329.
[15] Bessey O A, Lowry O H, Brock M J, et al. J Biol Chem, 1946,
166:177-188.
[16] Folin O, Denis W. J Biol Chem, 1912, 12: 239.[17] Herriott R M. J Gen Physiol, 1935, 19:283.
[18] Herriott R M. Proc Soc Exp Biol and Med, 1941, 46:642.[19] Mehl J W, Pacovska E, Winzler R J. J Biol Chem, 1949, 177:13.[20] Rising M M, Yang P S. J Biol Chem, 1932-33, 99:755.[21] Hitchings G H. J Biol Chem, 1941, 189:843.[22] Funk C, Macallum A B. Biochem J, 1913, 7:356.[23] Kunkel H G, Ward S M. J Biol Chem, 1950, 182:597-604.[24] Miller L, Houghton J A. J Biol Chem, 1945, 159:373.[25] Weichselbaum, T E. Am J Clin Path, Tech Sect, 1946, 10:40.
陈祥娥 编译,边 玲 校
[J Biol Chem, 1951, 193(1):265-275]
编者按:本文系“经典论文编译”,供读者参考。欢迎对此栏目投稿。
这些试管的清理经稀NaOH冲洗,半浓HNO3煮沸,并
用双蒸水冲洗若干遍。通过缓慢离心几秒钟,将装满试管的烧杯(长型无嘴烧杯)充满或排空。排空时,试管从上侧向下转移至有不锈钢防护虚底的第二个烧杯中。缓慢离心以防烧杯破裂。
4
适宜的微吸量管是Lang-Levy品种[13-14]。为进入这些试管与快速旋转的平直杆或钉保持一定角度。任何高
小直径管,弯曲尖端必须特别短且细。
5
速度的手持工具都应固定在夹钳上。试管中的物质应激烈混合且不流出[15]。市售尖端包橡胶的按摩振动器也可达到类似效果。参考文献
[1] Wu H. J Biol Chem, 1922, 51:33.
[2] Wu H, Ling S M. Chin J Physiol, 1927, 1:161.[3] Greenberg D M. J Biol Chem, 1929, 82:545.
[4] Andersch M, Gibson R B. J Lab and Clin Med, 1933, 18: 816.[5] Greenberg D M, Mirolubova T N. J Lab and Clin Med, 1936,
21:431.
[6] Minot A S, Keller M. J Lab and Clin Med, 1936, 21:743-51. [7] Pressman D. Ind and Eng Chem, Anal Ed, 1943, 16:357.
·书 讯·
《生物制药工业中生产规模的生物分离》一书出版
由Taylor & Francis Group出版的专著Process Scale Bioseparations for the Biopharmaceutical Industry(《生物制药工业中生产规模的生物分离》)一书由山东省药学科学院凌沛学研究员主译,已由中国轻工业出版社于20xx年3月出版。
本书内容共包括20章。书中主要介绍了生物工程中多种纯化技术,如离心、过滤、膨胀床吸附、高梯度磁钓、蛋白质复性、蛋白质结晶、色谱分离、膜色谱、超滤等的基本原理、操作方法及工艺放大。重点介绍了各种技术的工艺放大方法,并提供了多个生产规模的操作实例。因此,本书对生物药物的大规模生产具有很高的指导意义。本书也详细介绍了下游工艺开发中极为重要的辅助工作,包括病毒清除及验证、分析检验等的实施策略。另外,本书以已上市的蛋白质类药物的生产工艺变更为实例,对生物制药工业中的工艺开发和申报策略也提出了有价值的指导意见。
本书既可作为高校教师、研究生及高年级本科生的教学用书,也可作为生物制药领域研究、开发人员的参考书。购书方法:各地新华书店、中国轻工业出版社网站(.cn)、当当网()、卓越网()、轻工书店(联系电话:010-65128352)、中国轻工业出版社邮购(联系电话:010-65241695)。
金 艳
