盐酸标准溶液的配制与标定
一、目的要求
1. 掌握减量法准确称取基准物的方法。
2. 掌握滴定操作并学会正确判断滴定终点的方法。
3. 学会配制和标定盐酸标准溶液的方法。
二、原理
由于浓盐酸容易挥发,不能用它们来直接配制具有准确浓度的标准溶液,因此,配制HCl标准溶液时,只能先配制成近似浓度的溶液,然后用基准物质标定它们的准确浓度,或者用另一已知准确浓度的标准溶液滴定该溶液,再根据它们的体积比计算该溶液的准确浓度。 标定HCl溶液的基准物质常用的是无水Na2CO3,其反应式如下:
Na2CO3 + 2HCl 2NaCl + CO2+ H2O
滴定至反应完全时,溶液pH为3.89,通常选用溴甲酚绿-甲基红混合液作指示剂。
三、试剂
1.浓盐酸(密度1.19)
2.溴甲酚绿-甲基红混合液指示剂:量取30mL溴甲酚绿乙醇溶液(/L),加入20mL甲基红乙醇溶液(/L),混匀。
四、步骤
1. 0.1mol·L-1HCl溶液的配制
用量筒量取浓盐酸9mL,倒入预先盛有适量水的试剂瓶中,加水稀释至1000mL,摇匀,贴上标签。
2. 盐酸溶液浓度的标定
用减量法准确称取约在270~干燥至恒量的基准无水碳酸钠,置于250mL锥形瓶,加50mL水使之溶解,再加10滴溴甲酚绿-甲基红混合液指示剂,用配制好的HCl溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色。由Na2CO3的重量及实际消耗的HCl溶液的体积,计算HCl溶液的准确浓度。
五、注意事项
1. 干燥至恒重的无水碳酸钠有吸湿性,因此在标定中精密称取基准无水碳酸钠时,宜采用“减量法”称取,并应迅速将称量瓶加盖密闭。
2. 在滴定过程中产生的二氧化碳,使终点变色不够敏锐。因此,在溶液滴定进行至临近终点时,应将溶液加热煮沸,以除去二氧化碳,待冷至室温后,再继续滴定
第二篇:自用分析化学教案 盐酸标准溶液的配制与标定
实验四 盐酸标准溶液的配制与标定
一、实验目的与要求
1.学会配制、标定盐酸标准溶液;
2.学习酸碱指示剂的使用原理,指示剂选择的原则,了解混合指示剂的作用;
3.巩固减量法称量,学习滴定操作,滴定终点的判断;
4.学习数据处理的有关知识,有效数字的概念及应用。
二、基本操作
1.差减称量法
2.酸式滴定管的使用;
三、思考与检查
1.0.1mol·L-1盐酸标准溶液的浓度为什么要标定,而不能准确配制;
2. 在标定过程中,HCl与Na2CO3发生了哪些反应,有几个化学计量点,计量点的pH各是多少?
3.如何计算盐酸使用量?如何计算分析结果?
(1)配制0.1mol/L盐酸溶液需要量取浓盐酸多少毫升?如何配制?
(2)用基准无水碳酸钠标定盐酸,0.1503g无水碳酸钠耗掉盐酸标准溶液26.50mL。问:盐酸标准溶液的浓度是多少(mol/L)?
4. 差减称量法操作
5.酸式滴定管操作操作顺序
可能存在的问题

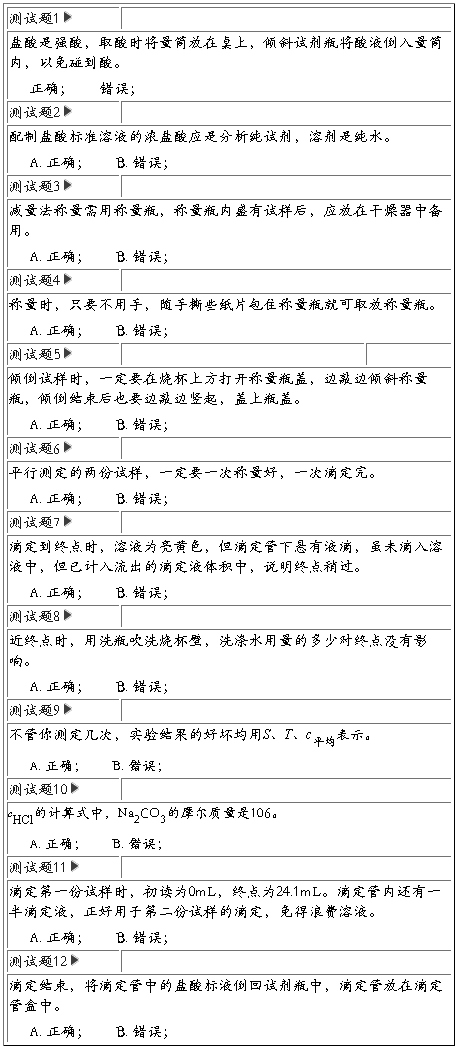
实验四盐酸标准溶液的配制和标定
一、目的要求
1. 掌握减量法准确称取基准物的方法。
2. 掌握滴定操作并学会正确判断滴定终点的方法。
3. 学会配制和标定盐酸标准溶液的方法。
二、原理
由于浓盐酸容易挥发,不能用它们来直接配制具有准确浓度的标准溶液,因此,配制HCl标准溶液时,只能先配制成近似浓度的溶液,然后用基准物质标定它们的准确浓度,或者用另一已知准确浓度的标准溶液滴定该溶液,再根据它们的体积比计算该溶液的准确浓度。
标定HCl溶液的基准物质常用的是无水Na2CO3,其反应式如下:
 Na2CO3 + 2HCl 2NaCl + CO2 + H2O
Na2CO3 + 2HCl 2NaCl + CO2 + H2O
滴定至反应完全时,溶液pH为3.89,通常选用溴甲酚绿-甲基红混合液作指示剂。
三、试剂
1.浓盐酸(密度1.19)
2.溴甲酚绿-甲基红混合液指示剂:量取30mL溴甲酚绿乙醇溶液(2g/L),加入20mL甲基红乙醇溶液(1g/L),混匀。
四、步骤
1.0.1mol·L-1HCl溶液的配制
用量筒量取浓盐酸9mL,倒入预先盛有适量水的试剂瓶中,加水稀释至1000mL,摇匀,贴上标签。
2.盐酸溶液浓度的标定
用减量法准确称取约0.15g在270~300℃干燥至恒量的基准无水碳酸钠,置于250mL锥形瓶,加50mL水使之溶解,再加10滴溴甲酚绿-甲基红混合液指示剂,用配制好的HCl溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色。由Na2CO3的重量及实际消耗的HCl溶液的体积,计算HCl溶液的准确浓度。
五、注意事项
1. 干燥至恒重的无水碳酸钠有吸湿性,因此在标定中精密称取基准无水碳酸钠时,宜采用“减量法”称取,并应迅速将称量瓶加盖密闭。
2. 在滴定过程中产生的二氧化碳,使终点变色不够敏锐。因此,在溶液滴定进行至临近终点时,应将溶液加热煮沸,以除去二氧化碳,待冷至室温后,再继续滴定。
思 考 题
1. 作为标定的基准物质应具备哪些条件?
2. 欲溶解Na2CO3基准物质时,加水50mL应以量筒量取还是用移液管吸取?为什么?
3. 本实验中所使用的称量瓶、烧杯、锥形瓶是否必须都烘干?为什么?
4. 标定HCl溶液时为什么要称0.15g左右Na2CO3基准物?称得过多或过少有何不好?
