乙酸乙酯皂化反应速率常数的测定——酸碱滴定法
一、实验目的:
1、掌握酸碱滴定的一般方法;
2、了解二级反应的特点;
3、学会用图解法求二级反应的反应速率常数以及活化能的求算。
二、实验原理:
1、对于二级反应: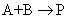 ,如果A与B的起始浓度相等,记为
,如果A与B的起始浓度相等,记为 ,通过积分可以得到二级反应的反应速率常数
,通过积分可以得到二级反应的反应速率常数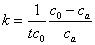 ,其中
,其中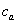 是A的当前浓度(即[A])。若
是A的当前浓度(即[A])。若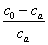 ~t作图为直线,即可说明反应为二级反应,速率常数
~t作图为直线,即可说明反应为二级反应,速率常数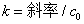 。
。
如果测得两个不同温度下的速率常数k,在温度范围不大的情况下可以用阿伦尼乌斯公式计算反应的活化能: 。
。
2、乙酸乙酯皂化反应是二级反应:
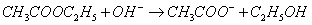
反应过程中,氢氧根离子的浓度逐渐减低,如前所述,只要测得氢氧根离子的浓度与时间的关系,即可求得反应速率常数。(这里的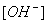 即为前面所说的
即为前面所说的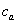 )
)
3、本实验以酸碱滴定的方式来测量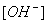 ,产生了两个问题:
,产生了两个问题:
(1)从反应液中移取溶液导致原反应液浓度改变;
(2)移取反应液到滴定的这段时间,反应仍在进行,产生较大的误差。
为了克服这两个问题,我们用以下方案:
(1)采用较大的双管式混合反应器,加入原料的总量提高为100mL,而移取溶液时只从中移取0.5mL,尽管会移取溶液数次,但是由于移取的体积远小于溶液总体积,我们认为该误差可以忽略;
(2)用移液管移出的反应液立即放入事先准备好的加入了30mL冰水的100mL锥形瓶中,通过稀释和降温双重手段,是反应的进行基本上处于停滞状态来进行滴定。
三、仪器与药品:
计时器一只;恒温槽一套;双管式混合反应器两个;25mL胖杜移液管两只;1mL刻度移液管1只;25mL小烧杯一只;100mL容量瓶一只;100mL锥形瓶9个;50mL酸式滴定管一只。。
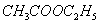 (AR),NaOH标准溶液(
(AR),NaOH标准溶液(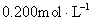 ),HCl标准溶液(
),HCl标准溶液(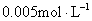 ),甲基橙指示剂,蒸馏水。
),甲基橙指示剂,蒸馏水。
四、实验步骤:
1、配制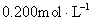 的乙酸乙酯溶液于100mL容量瓶中:按其摩尔质量计算配制100mL
的乙酸乙酯溶液于100mL容量瓶中:按其摩尔质量计算配制100mL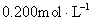 所需乙酸乙酯的质量,用小烧杯称取,转移至100mL容量瓶中定容。
所需乙酸乙酯的质量,用小烧杯称取,转移至100mL容量瓶中定容。
2、准备好9个加有30mL蒸馏水与2滴甲基橙指示剂的锥形瓶(分别标号1~9),放在冰浴中冷却。
3、调节恒温槽温度为20摄氏度,分别移取50mL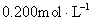 NaOH溶液与
NaOH溶液与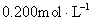
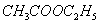 溶液于双管式混合反应器的AB管中(移取50mL溶液用25mL胖杜移液管移取两次即可),于恒温槽恒温5min。
溶液于双管式混合反应器的AB管中(移取50mL溶液用25mL胖杜移液管移取两次即可),于恒温槽恒温5min。
4、用洗耳球混合两溶液并多次挤压使其混合均匀,同时开始计时,并插入一根洗净并晾干的1mL刻度移液管(该移液管每次移完液体后再插回反应液中,相当于润洗)。于4、6、8、10、12、14、16、18、20分钟时移取反应液0.5mL至1~9号锥形瓶中。(时间的记录以溶液放入锥形瓶的时刻为准,要准确记录)
5、用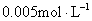 的HCl标准溶液滴定9份溶液并记录到达终点时分别用去了VmL的HCl标准溶液。
的HCl标准溶液滴定9份溶液并记录到达终点时分别用去了VmL的HCl标准溶液。
6、将实验条件改为30摄氏度,重复上述实验步骤。
五、注意事项:
1、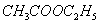 必须准确称取,因为需要保证
必须准确称取,因为需要保证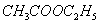 与NaOH溶液的浓度相等;
与NaOH溶液的浓度相等;
2、反应过程中,由于要从反应液中移取溶液,但是又不能带入太多的水使得反应液浓度改变,所以这里只用一根1mL移液管,每次移取完液体就把它插回反应液中免去润洗;
3、为了使反应溶液混合均匀,要多次挤压混合;
4、记录时间可以以移液管中液体降到刻度为0.25mL的时刻为准。
六、数据处理:
1、将上述所有的用去HCl的体积VmL转化为反应液中氢氧化钠的浓度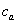 :
:
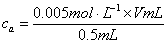
列出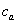 与反应时间t的关系表;
与反应时间t的关系表;
2、以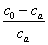 ~t作图,由斜率计算反应速率常数k;
~t作图,由斜率计算反应速率常数k;
3、以293.2K与303.2K下的反应速率常数计算该反应的活化能
七、讨论:
1、实验中,反应液浓度的选择要满足以下条件:
(1)浓度不能太高,以防反应速率过快,来不及在指定时间移取溶液;
(2)浓度不能太低,氢氧根离子的浓度要远大于水电离出的氢氧根离子的浓度(一般认为100倍相当于远大于,即滴定时的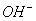 浓度要大于
浓度要大于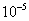
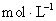 ),则反应液初始NaOH的浓度要大于
),则反应液初始NaOH的浓度要大于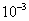
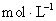 。(因为随着反应的进行,
。(因为随着反应的进行,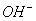 浓度会降低,而且滴定时还稀释了60倍,综合看来,大约为
浓度会降低,而且滴定时还稀释了60倍,综合看来,大约为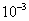
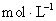 。
。
2、盐酸标准溶液浓度的选择:为了让滴定消耗的HCl溶液的体积大约在20mL左右,但又不能从反应液中移取太多溶液(会改变反应液浓度而产生误差),同时HCl的浓度又不能太低(难以配制)。综合考虑,将其定在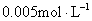 。
。
XX XXXXXXXX
化学化工学院
第二篇:乙酸乙酯皂化反应速率常数的测定的实验报告
实验七乙酸乙酯皂化反应速率常数的测定
乙酸乙酯皂化反应速率常数的测定
一、目的及要求
1、测定皂化反应中电导的变化,计算反应速率常数。
2、了解二级反应的特点,学会用图解法求二级反应的速率常数。
3、熟悉电导率仪的使用。
二、原理
乙酸乙酯的皂化反应为二级反应:
CH3COOC2H5+NaOH=CH3COONa+C2H5OH
在这个实验中,将CH3COOC2H5和NaOH采用相同的浓度,设a为起始浓度,同时设反应时间为t时,反应所生成的CH3COONa和C2H5OH的浓度为x,那么CH3COOC2H5和NaOH的浓度为(a-x),即
CH3COOC2H5+NaOH= CH3COONa+ C2H5OH
t=0时, a a 0 0
t=t时, a-x a-x x x
t→∞时, 0 0 a a
其反应速度的表达式为:
dx/dt=k(a-x)2
k—反应速率常数,将上式积分,可得
kt=x/[a(a-x)] *
乙酸乙酯皂化反应的全部过程是在稀溶液中进行的,可以认为生成的CH3COONa是全部电离的,因此对体系电导值有影响的有Na+、OH-和CH3COO-,而Na+、在反应的过程中浓度保持不变,因此其电导值不发生改变,可以不考虑,而OH-的减少量和CH3COO-的增加量又恰好相等,又因为OH-的导电能力要大于CH3COO-的导电能力,所以体系的电导值随着反应的进行是减少的,并且减少的量与CH3COO-的浓度成正比,设L0—反应开始时体系的电导值,L∞—反应完全结束时体系的电导值,Lt—反应时间为t时体系的电导值,则有
t=t时, x=k'(L0-Lt)
t→∞时, a=k'(L0-L∞)
k'为比例系数。
代入*式得
Lt=1/ka×[(L0-Lt)/t]+ L∞
以Lt对(L0-Lt)/t作图,得一直线,其斜率为1/ka,由此求得k值。
三、实验仪器和试剂
恒温水浴一套,电导率仪一台,秒表一只,羊角型电导池一支,移液管一支,试管一只,移液管(10mL)二只,移液管(2mL带刻度)一只,容量瓶(50mL)一只,容量瓶(1000mL)一只,0.1mol NaOH溶液,乙酸乙酯(A.R)分子量88.11,密度0.9002L/ml)。
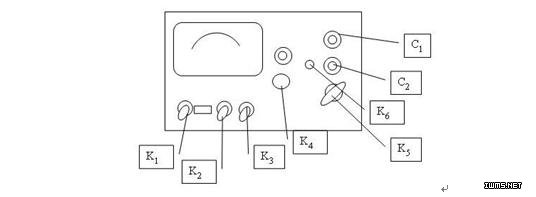
K1:电源开关 K4:校正调节 K7:电极常数调节
K2:高周、低周开关 K5 :量程选择开关 C1:电极插口
K3:校正、测量开关 K6:电容补偿调节 C2:10毫伏输出
四、实验步骤
1. 溶液的配制
1. 1氢氧化钠溶液的配制
用移液管吸取10 mL NaOH标准溶液于50mL容量瓶中稀释至刻度,摇匀。
1. 2乙酸乙酯的配制(4组配1瓶)
乙酸乙酯的毫升数=[(NaOH标准溶液浓度/5)×88.11]/0.9
先取500mL蒸馏水加入1000mL容量瓶中,加入计算所得的乙酸乙酯的毫升数,加水稀释至刻度摇匀。
2. 将恒温槽的温度调至25℃
2.1 打开恒温槽电源,看设定温度的黄字如果是25℃可不调,直接打开电源即可(如果不是25℃按功能键,使红色数字变成SP,这时按△升温,▽降温键,使黄字变为25.00)。然后按功能键使其显示温度。
3. L0的测定
用移液管量取NaOH和蒸馏水各10mL加入试管中,置于恒温槽中恒温。待恒温10分钟测电导率。
测定方法:
打开数显电导率仪,仪器自动显示标准。将电极插入试管中,将温度补偿调至25℃。将电导池常数调到对应位置(如常数为0.98,常数调为9.8)。按动“标准/测量”键,进行测量,此时电导率仪显示数字就是L0的值(用蒸馏水冲洗电极后擦干备用)。
4. Lt的测定
将10mLNaOH和10mL乙酸乙酯分别加入羊角型电导池中(两种溶液不能混合)。恒温十分钟后将两种溶液混合,同时用秒表记录下反应时间。并在两管中混合3次。把电极插入立管中,并在2、4、6、9、12、15、20、25、30、40、50、60分钟读取电导率Lt。12组数读完后关闭恒温槽电源,关闭电导率仪。实验结束。
实验完毕后,洗净电导池。用蒸馏水淋洗电导电极,并用蒸馏水浸泡好。
五、数据处理
1、将t、Lt、L0-Lt及(L0-Lt)/t等数据列于下表:
实验温度:25℃ 气压:98.39kPa L0:1.934 ms/cm
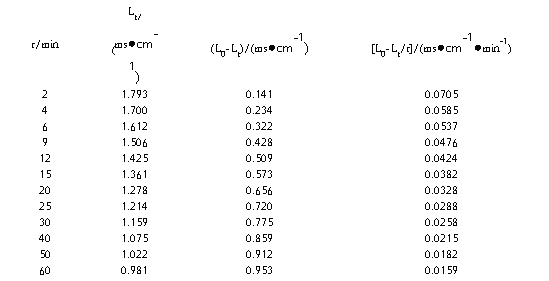
2、以Lt对(L0-Lt)/t作图,由所得直线斜率,求出反应速率常数k。

随手盖上瓶塞殊为重要。
4、乙酸乙酯溶液要重新配制,因放置过久,能自行缓慢水解而影响结果。
七、思考题
1、若需测定L∞值,可如何进行?
答:干燥大试管中加入约5毫升0.01 mol·dm-3 乙酸钠,恒温后(约15分钟)读数。
2、若欲计算本反应的活化能,作何种测定?
 答:若由实验求得两个不同温度下得速率常数k,则可利用公式:
答:若由实验求得两个不同温度下得速率常数k,则可利用公式:
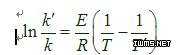
计算出反应的活化能E。
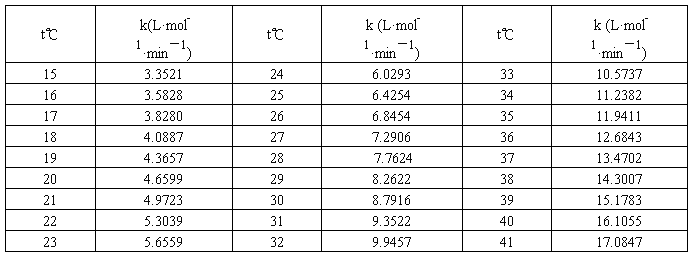
不同温度下乙酸乙酯皂化反应速率常数文献值