实验八乙酸乙酯皂化反应速率常数的测定
乙酸乙酯皂化反应速率常数的测定
一、目的及要求
1、测定皂化反应中电导的变化,计算反应速率常数。
2、了解二级反应的特点,学会用图解法求二级反应的速率常数。
3、熟悉电导率仪的使用。
二、原理
乙酸乙酯的皂化反应为二级反应:
CH3COOC2H5+NaOH=CH3COONa+C2H5OH
在这个实验中,将CH3COOC2H5和NaOH采用相同的浓度,设a为起始浓度,同时设反应时间为t时,反应所生成的CH3COONa和C2H5OH的浓度为x,那么CH3COOC2H5和NaOH的浓度为(a-x),即
CH3COOC2H5+NaOH= CH3COONa+ C2H5OH
t=0时, a a 0 0
t=t时, a-x a-x x x
t→∞时, 0 0 a a
其反应速度的表达式为:
dx/dt=k(a-x)2
k—反应速率常数,将上式积分,可得
kt=x/[a(a-x)] *
乙酸乙酯皂化反应的全部过程是在稀溶液中进行的,可以认为生成的CH3COONa是全部电离的,因此对体系电导值有影响的有Na+、OH-和CH3COO-,而Na+、在反应的过程中浓度保持不变,因此其电导值不发生改变,可以不考虑,而OH-的减少量和CH3COO-的增加量又恰好相等,又因为OH-的导电能力要大于CH3COO-的导电能力,所以体系的电导值随着反应的进行是减少的,并且减少的量与CH3COO-的浓度成正比,设L0—反应开始时体系的电导值,L∞—反应完全结束时体系的电导值,Lt—反应时间为t时体系的电导值,则有
t=t时, x=k'(L0-Lt)
t→∞时, a=k'(L0-L∞)
k'为比例系数。
代入*式得
Lt=1/ka×[(L0-Lt)/t]+ L∞
以Lt对(L0-Lt)/t作图,得一直线,其斜率为1/ka,由此求得k值。
三、实验仪器和试剂
恒温水浴一套,电导率仪一台,秒表一只,羊角型电导池一支,移液管一支,试管一只,移液管(10mL)二只,移液管(2mL带刻度)一只,容量瓶(50mL)一只,容量瓶(1000mL)一只,0.1mol NaOH溶液,乙酸乙酯(A.R)分子量88.11,密度0.9002L/ml)。
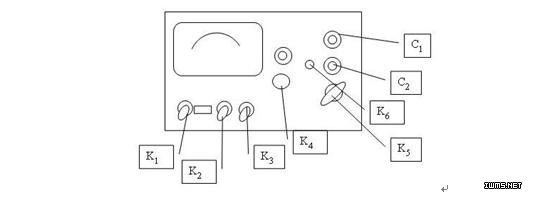
K1:电源开关 K4:校正调节 K7:电极常数调节
K2:高周、低周开关 K5 :量程选择开关 C1:电极插口
K3:校正、测量开关 K6:电容补偿调节 C2:10毫伏输出
四、实验步骤
1. 溶液的配制
1. 1氢氧化钠溶液的配制
用移液管吸取10 mL NaOH标准溶液于50mL容量瓶中稀释至刻度,摇匀。
1. 2乙酸乙酯的配制(4组配1瓶)
乙酸乙酯的毫升数=[(NaOH标准溶液浓度/5)×88.11]/0.9
先取500mL蒸馏水加入1000mL容量瓶中,加入计算所得的乙酸乙酯的毫升数,加水稀释至刻度摇匀。
2. 将恒温槽的温度调至25℃
2.1 打开恒温槽电源,看设定温度的黄字如果是25℃可不调,直接打开电源即可(如果不是25℃按功能键,使红色数字变成SP,这时按△升温,▽降温键,使黄字变为25.00)。然后按功能键使其显示温度。
3. L0的测定
用移液管量取NaOH和蒸馏水各10mL加入试管中,置于恒温槽中恒温。待恒温10分钟测电导率。
测定方法:
打开数显电导率仪,仪器自动显示标准。将电极插入试管中,将温度补偿调至25℃。将电导池常数调到对应位置(如常数为0.98,常数调为9.8)。按动“标准/测量”键,进行测量,此时电导率仪显示数字就是L0的值(用蒸馏水冲洗电极后擦干备用)。
4. Lt的测定
将10mLNaOH和10mL乙酸乙酯分别加入羊角型电导池中(两种溶液不能混合)。恒温十分钟后将两种溶液混合,同时用秒表记录下反应时间。并在两管中混合3次。把电极插入立管中,并在2、4、6、9、12、15、20、25、30、40、50、60分钟读取电导率Lt。12组数读完后关闭恒温槽电源,关闭电导率仪。实验结束。
实验完毕后,洗净电导池。用蒸馏水淋洗电导电极,并用蒸馏水浸泡好。
五、数据处理
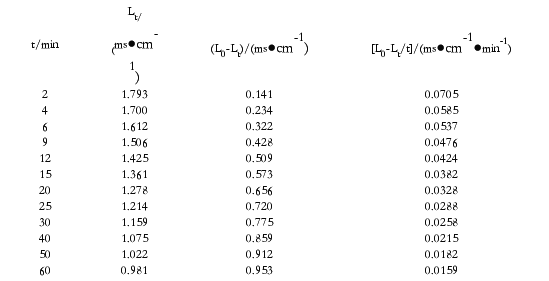
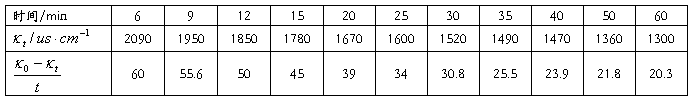
1、将t、Lt、L0-Lt及(L0-Lt)/t等数据列于下表:
实验温度:25℃ 气压:98.39kPa L0:1.934 ms/cm
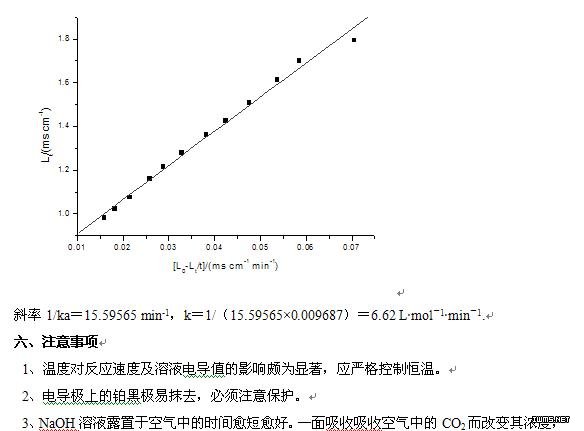
2、以Lt对(L0-Lt)/t作图,由所得直线斜率,求出反应速率常数k。
随手盖上瓶塞殊为重要。
4、乙酸乙酯溶液要重新配制,因放置过久,能自行缓慢水解而影响结果。
七、思考题
1、若需测定L∞值,可如何进行?
答:干燥大试管中加入约5毫升0.01 mol·dm-3 乙酸钠,恒温后(约15分钟)读数。
2、若欲计算本反应的活化能,作何种测定?
 答:若由实验求得两个不同温度下得速率常数k,则可利用公式:
答:若由实验求得两个不同温度下得速率常数k,则可利用公式:
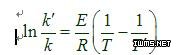
计算出反应的活化能E。
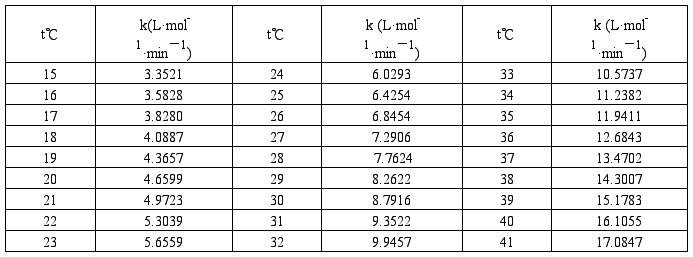
不同温度下乙酸乙酯皂化反应速率常数文献值
第二篇:乙酸乙酯皂化反应速率常数的测定1
乙酸乙酯皂化反应速率常数的测定
电导率的物理意义是表示物质导电的性能。电导率越大则导电性能越强,反之越小。
一、预习提问
1.为什么可用电导法测定乙酸乙酯皂化反应的速率常数?
2.二级反应有什么特点?
3.怎样使用DDS-307型电导率仪?
4.
 各代表什么?如何测定?
各代表什么?如何测定?
二、实验目的及要求
1.了解测定化学反应速率常数的一种物理方法----电导法。
2.了解二级反应的特点,学会用图解法求二级反应的速率常数。
3.掌握DDS-307 型数字电导率仪和控温仪使用方法。
三、实验原理
1.二级反应的动力学方程
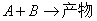
t=0 a a
t=t a-x a-x
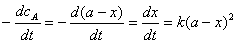 (1)
(1)
定积分得: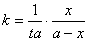 (2)
(2)
以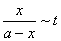 作图若所得为直线,证明是二级反应,并从直线的斜率求出
作图若所得为直线,证明是二级反应,并从直线的斜率求出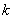 。
。
如果知道不同温度下的速率常数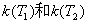 ,按阿仑尼乌斯方程计算出该反应的活化能
,按阿仑尼乌斯方程计算出该反应的活化能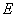 。
。
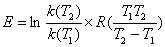 (3)
(3)
2.乙酸乙酯皂化反应是二级反应,反应式为:
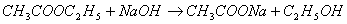
t=0 a a 0 0
t=t a-x a-x x x
t=∞ 0 0 a a
反应前后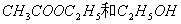 对电导率的影响不大,可忽略。故反应前只考虑
对电导率的影响不大,可忽略。故反应前只考虑 的电导率
的电导率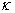 ,反应后只考虑
,反应后只考虑 的电导率
的电导率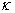 。对稀溶液而言,强电解质的电导率
。对稀溶液而言,强电解质的电导率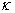 与其浓度成正比,而且溶液的总电导率就等于组成该溶液的电解质电导率之和。
与其浓度成正比,而且溶液的总电导率就等于组成该溶液的电解质电导率之和。
故存在如下关系式:
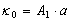
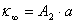
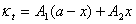
由上三式得: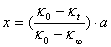 ,代入(2)式得
,代入(2)式得 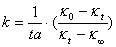
重新排列得: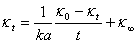
因此,以 作图为一直线即为二级反应,并从直线的斜率求出
作图为一直线即为二级反应,并从直线的斜率求出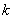 。
。
四、仪器与药品
DDS-307型数字电导率仪(附铂黑电极)1台,恒温水槽1套,停表1只,
叉形电导管2只,直试管1只,移液管(10ml,胖肚)2根,吸液管(5ml 1根,10ml 2根),
烧杯(50ml)1只,容量瓶(100ml)2个,称量瓶(25mmΧ23mm)1只。
乙酸乙酯(分析纯),氢氧化钠(教师预先配制的大浓度0.2mol/l)
五、实验步骤
1.恒温槽调节及溶液的配制
调节恒温槽温度为298.2K(25℃)。同时电导率仪提前打开预热。
先用称量法配制乙酸乙酯溶液100ml,浓度在0.02mol/l左右。
再据所配乙酸乙酯溶液的浓度,配同等浓度的氢氧化钠溶液(由所给大浓度稀释即可)。
2.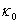 的测定
的测定
分别取10ml蒸馏水和10ml所配 溶液,加到洁净、干燥的叉形管中充分混匀,置于恒温槽中恒温5min。用DDS-307型数字电导率仪测定已恒温好的
溶液,加到洁净、干燥的叉形管中充分混匀,置于恒温槽中恒温5min。用DDS-307型数字电导率仪测定已恒温好的 溶液的电导率
溶液的电导率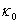 。
。
3.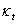 的测定
的测定
在另一只叉形管的直支管中加10ml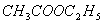 溶液,侧支管中加10ml
溶液,侧支管中加10ml 溶液。恒温后,混合两溶液,同时开启停表,记录反应时间,并把电导电极插入直支管中。当反应进行6min,9min,12min,15min,,20min,25min,30min,35min,40min时各测电导率一次,记录电导率
溶液。恒温后,混合两溶液,同时开启停表,记录反应时间,并把电导电极插入直支管中。当反应进行6min,9min,12min,15min,,20min,25min,30min,35min,40min时各测电导率一次,记录电导率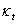 及时间t。
及时间t。
4.调节恒温槽温度为308.2K(35℃),重复上述步骤测定其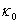 和
和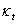 ,但在测定
,但在测定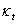 时是按反应进行4min,6min,8min,10min,,12min,15min,18min,21min,24min,27min,30min时测其电导率。
时是按反应进行4min,6min,8min,10min,,12min,15min,18min,21min,24min,27min,30min时测其电导率。
六、结果要求
1. 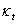 ~
~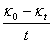 作图应为一线性较好的直线。
作图应为一线性较好的直线。
2. 25℃(24.3℃ )时乙酸乙酯皂化反应速率常数的标准值(摘自I.C.T Vol Ⅶ p.129)为:

其平均活化能为11 kcal.mol-1(摘自“化学便览”基础篇(修订二版)p.1075)。
实验要求k为6±1 (mol/l)-1.min-1,E为11±3 kcal.mol-1。
七、影响结果的一些因素
1.乙酸乙酯皂化反应系吸热反应,混合后体系温度降低,故在混合后的开始几分钟内所测溶液电导偏低。因此最好在反应6分钟后开始测定,否则所得结果呈抛物线形。
2.如NaOH溶液和CH3COOC2H5溶液浓度不等,而所得结果仍用两者浓度相等的公式计算,则作图所得直线也将缺乏线性。
3.温度对速率常数影响较大,需在恒温条件下测定。在水浴温度达到所要的温度后,不急于马上进行测定,须待欲测体系恒温10分钟,否则会因起始时温度的不恒定而使电导偏低或偏高,以致所得直线线性不佳。
4. 测定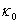 时,所用的蒸馏水最好先煮沸,否则蒸馏水溶有CO2,降低了NaOH的浓度,而使
时,所用的蒸馏水最好先煮沸,否则蒸馏水溶有CO2,降低了NaOH的浓度,而使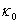 偏低。
偏低。
5.测35℃的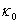 时,如仍用25℃的溶液而不调换,由于放置时间过长,溶液会吸收空气中的CO2,而降低NaOH的浓度,使
时,如仍用25℃的溶液而不调换,由于放置时间过长,溶液会吸收空气中的CO2,而降低NaOH的浓度,使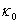 偏低,结果导致k值偏低。
偏低,结果导致k值偏低。
八、实验数据及处理

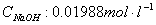
恒温温度:25℃ 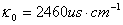 (微西门子每厘米)
(微西门子每厘米)
恒温温度:35℃ 

分别以25℃、35℃所测结果作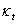 ~
~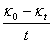 图的二条直线
图的二条直线
25℃直线斜率: ,
,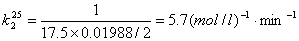
35℃直线斜率: ,
,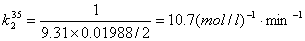
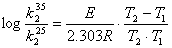

九、思考题
1.为何本实验要在恒温条件下进行,而且NaOH溶液和CH3COOC2H5溶液混合前还要预先恒温?
答:因反应速度与温度有关,温度每升高10℃,反应速度约增加2~4倍,同时电导率也与温度有关,所以实验过程中须恒温。且NaOH溶液和CH3COOC2H5溶液混合前要预先恒温,以保证反应在实验温度下进行。
2.如果NaOH溶液和CH3COOC2H5溶液的起始浓度不相等,试问应怎样计算?
答:要按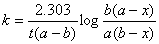 ,
,
式中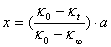 (a为两溶液中浓度较低的一个溶液浓度)
(a为两溶液中浓度较低的一个溶液浓度)
以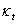 ~t作图,可得到
~t作图,可得到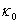 和
和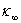 的值,解出不同t时的x值,然后,就可求出k。
的值,解出不同t时的x值,然后,就可求出k。
3.如果NaOH溶液和CH3COOC2H5溶液为浓溶液,能否用此法求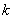 值?为什么?
值?为什么?
答:不能。因为只有对稀溶液,强电解质的电导率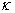 与其浓度成正比,才会推倒得到
与其浓度成正比,才会推倒得到
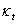 ~
~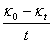 作图为一直线,进而求得
作图为一直线,进而求得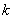 值。
值。
十、实验注意事项:
1.用书中的公式计算速率常数(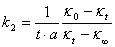 )时,要求所用的NaOH溶液和CH3COOC2H5溶液两者的浓度要相同。
)时,要求所用的NaOH溶液和CH3COOC2H5溶液两者的浓度要相同。
2.由于CH3COOC2H5易挥发,故称量时应在称量瓶中准确称取,并需动作迅速。
3. 由于CH3COOC2H5在稀溶液中能缓慢水解,会影响CH3COOC2H5的浓度,且水解产物CH3COOH又会消耗NaOH。所以CH3COOC2H5水溶液应在使用时临时配制。
4.在测定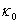 时,所用的蒸馏水最好先煮沸,以除去CO2;25℃和35℃的
时,所用的蒸馏水最好先煮沸,以除去CO2;25℃和35℃的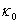 测定中,溶液须更换。
测定中,溶液须更换。
5.测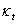 时,叉型管中的NaOH溶液和CH3COOC2H5溶液必须在叉型管中的侧、直支管间多次来回反复混合,以确保混合均匀。
时,叉型管中的NaOH溶液和CH3COOC2H5溶液必须在叉型管中的侧、直支管间多次来回反复混合,以确保混合均匀。
6.注意不可用纸擦电导电极上的铂黑。
