《物理化学》教学大纲
课程名称: 物理化学
英文名称: Physical Chemistry
课程编号: 01000211
课程类别: 专业课
课程要求: 必修课
课程属性: 独立授课
课程总学时:102 学时,总学分6
实验学时: 34 学时 (单独设课)
应开学期:第4、5 学期
适用专业: 化工、应用化学
先修课程: 高等数学(微分、积分)、物理、无机化学、有机化学
一、课程的性质与任务
物理化学主要研究化学变化和相变化的平衡规律和变化速率规律,是化学工程与工艺、应用化学、生物工程、食品、材料、制药、生物技术等专业的必修基础课,它包括理论教学及实验教学。实验教学单独开课。 通过本门课程的学习,学生应比较牢固地掌握物理化学基本概念及计算方法,同时还应得到一般科学方法的训练和逻辑思维能力的培养。这种训练和培养应贯穿在课堂教学的整个过程中,使学生体会和掌握怎样由实验结果出发进行归纳和演绎,或由假设和模型上升为理论,并结合具体条件用理论解决实际问题的方法。
二、课程的内容与基本要求
物理化学的理论研究方法有热力学方法、统计力学方法和量子力学方法。从研究内容来说包括宏观上的、微观上的、以及亚微观上的,对工科学生来说,热力学方法及宏观上的内容是主要的、基本的,后两种方法和内容的重要性正在日益增加。对工科专业,量子力学方法一般不作要求或另设课程。
下面按各章列出基本要求和内容。基本要求按深入的程度分“了解”、“理解”和“掌握”三个层次。对于理论教学时数少于85学时的专业,△号标明的内容,不属基本要求。
第一章 物质的pVT性质
一、本章基本要求
?掌握理想气体状态方程。
?掌握理想气体的宏观定义及微观模型
?掌握分压、分体积概念及计算。
?理解真实气体与理想气体的偏差、临界现象。
?掌握饱和蒸气压概念。
?理解范德华状态方程、对应状态原理和压缩因子图,了解对比状态方程及其它真实气体方程。
二、教学内容
1.理想气体及状态方程、分压定律、分体积定律。
2.真实气体
真实气体与理想气体的偏差、范德华方程.真实气体的液化(C02的p-V图)、临界现象、临界参数。
3. △对应状态原理及压缩因子图
对比参数、对应状态原理,用压缩因子图进行普遍化计算。
第二章 热力学第一定律
一、本章基本要求
?理解系统与环境、状态、过程、状态函数与途径函数等基本概念,了解可逆过程的概念。
?掌握热力学第一定律文字表述和数学表达式。
?理解功、热、热力学能、焓、热容、摩尔相变焓、标准摩尔反应焓、标准摩尔生成焓、标准摩尔燃烧焓等概念。
?掌握热力学第一定律在纯 P V T 变化、相变化及化学变化中的应用,掌握计算各种过程的功、热、热力学能变、焓变的方法。
二、教学内容
1、基本概念及术语
系统、环境、性质、状态、状态函数、平衡态、过程、途径。
2、热力学第一定律
功、热、热力学能,热力学第一定律。恒容热、恒压热、焓。
3、可逆过程体积功的计算
可逆过程、恒温可逆过程与绝热可逆过程功的计算。
4、热容
平均热容、真热容。定压摩尔热容、定容摩尔热容。Cp,m与Cv,m的关系。
5、热力学第一定律对理想气体的应用
焦耳实验,理想气体的热力学能与焓,理想气体的热容差,理想气体的恒温、恒压、恒容与绝热过程。
6、相变焓
*7、溶解熔与稀释焓
8、标准摩尔反应焓
反应进度,标准态,标准摩尔反应焓,标准摩尔生成焓及标准摩尔燃烧焓.标准摩尔反应焓与温度的关系。
9、热力学第一定律对实际气体的应用
实际气体的热性能与焓
焦耳--汤姆生效应、节流系数。
第三章 热力学第二定律
一、本章基本要求
?理解自发过程、卡诺循环、卡诺定理。
?掌握热力学第二定律的文字表述和数学表达式。
?理解熵、亥姆霍兹函数、吉布斯函数定义;掌握熵增原理、熵判据、亥姆霍兹函数判据、吉布斯函数判据。
?掌握物质在PVT变化、相变化中熵、亥姆霍兹函数、吉布斯函数的计算及热力学第二定律的应用。
?了解热力学第三定律,规定熵、标准熵,理解标准摩尔反应熵定义及计算。
?掌握主要热力学公式的推导和适用条件。
?掌握热力学基本方程和麦克斯韦关系式;理解推导热力学公式的演绎方法。
?理解克拉佩龙方程、克劳修斯――克拉佩龙方程,掌握其计算。
二、教学内容
1.热力学第二定律
自发过程的共同特征,热力学第二定律的文字表述。
卡诺循环及卡诺定理,热力学第二定律的数学表达式,熵增原理及熵判据。
2.熵变计算
简单PVT变化过程的熵变。
可逆相变与不可逆相变,相变过程的熵变。
3.热力学第三定律
热力学第三定律,规定熵、标准熵。化学反应熵变的计算。
4.亥姆霍兹函数与吉布斯函数的定义,恒温恒容过程与恒温恒压过程方向的判据,亥姆霍兹函数与吉布斯函数变化的计算。
5.热力学基本方程和麦克斯韦关系式
热力学基本方程,麦克斯韦关系式。
*了解用它们推导重要热力学公式的演绎方法。
6.热力学第二定律应用举例
克拉佩龙方程和克劳修斯-克拉佩龙方程。
第四章 多组分系统热力学
一、本章基本要求
?了解混合物与溶液的区别,会各种组成表示之间的换算。
?理解拉乌尔定律、享利定律,掌握其有关计算。
?了解稀溶液的依数性,并理解其应用。
?理解偏摩尔量及化学势的概念。了解化学势判据的使用。
?理解理想液态混合物的定义,理解混合性质。
?了解理想气体、真实气体、理想液态混合物、理想稀溶液中各组分化学势的表达式。
?理解逸度的定义,了解逸度的计算。
?理解活度及活度系数的概念。了解真实理想液态混合物、真实溶液中各组分化学势的表达式。
二、教学内容
1.拉乌尔定律与享利定律
2.偏摩尔量与化学势
偏摩尔体积及其它偏摩尔量.吉布斯--杜亥姆方程。
化学势,理想气体化学势,真实气体的化学势。
3.理想液态混合物
理想液态混合物中任一组分的化学势,理想液态混合物的混合性质。
4.理想稀溶液
溶剂、溶质的化学势。分配定律。
稀溶液的依数性(蒸气压下降,凝固点降低,沸点升高,渗透压)。
5.逸度与活度
逸度及活度的概念、
*了解逸度和活度的标准态和对组份的活度系数的简单计算方法。
第五章 化学平衡
一、本章基本要求
?理解摩尔反应吉布斯函数、标准摩尔反应吉布斯函数、标准摩尔生成吉布斯函数定义及应用。
?掌握标准平衡常数的定义。理解等温方程和范特霍夫方程的推导及应用。
?掌握用热力学数据计算平衡常数及平衡组成的方法判断在一定条件下化学反应可能进行的方向,会分析温度、压力、组成等因素对平衡的影响。
?了解真实气体化学平衡及溶液中的化学平衡。
二、教学内容
1.化学反应的方向和限度
反应的吉布斯函数变化,化学反应平衡的条件.标准平衡常数的导出,化学反应等温方程式。
2.理想气体反应的平衡常数
标准平衡常数的性质,Kq、Kp、Kcq、Ky、Kn的关系,平衡常数及平衡组成的计算。
3.有纯态凝聚相参加的理想气体反应
标准平衡常数的表示式,分解压力与分解温度。
4.标准摩尔反应吉布斯函数ΔrGmq, ΔrGmq= - RTlnKq, 标准摩尔生成吉布斯函数ΔfGmq、ΔrGmq的计算。
5.温度对标准平衡常数的影响
吉布斯一亥姆霍兹方程,范特霍夫方程,不同温度下平衡常数的求算。
6.其它因素(浓度、压力、惰性组分)对平衡的影响
*7.同时平衡
*8.真实气体的化学平衡
**9.混合物及溶液中的化学平衡
第六章 相平衡
一、本章基本要求
?理解相律的意义、推导,掌握其应用。
?掌握单组分系统、二组分气――液平衡系统和二组分凝聚系统典型相图的分析和应用。
?掌握用杠杆规则进行分析与计算。
?了解由实验数据绘制简单相图的方法。
二、教学内容
1.相律
相、组分数、自由度数,相律的推导。
2.单组分系统相平衡
水的相图。
3.两组分液态完全互溶系统的气-液平衡
理想液态混合物的p-X图、T-X图。
真实液态混合物的p-X图、T-X图,恒沸混合物,精馏原理。
4.两组分液态部分互溶系统气-液平衡
部分互溶系统的温度-溶解度图。
部分互溶系统的气-液平衡相图(T-X图)。
*5.两组分液态完全不互溶系统的气-液平衡T-X图,p-T图,水蒸汽蒸馏
6.两组分系统的液一固平衡
两组分固态不互溶凝聚系统相图
生成化合物(稳定、不稳定)的凝聚系统相图。
两组分固态互溶(完全互溶、部分互溶)系统的相图。
热分析法及步冷曲线、溶解度法。
D能用杠杆规则进行计算。
第七章 电化学
一、本章基本要求
?了解表征电解质溶液导电性质的物理量(电导、电导率、摩尔电导率、电迁移率,迁移数)。
?理解离子平均活度及平均活度系数定义并掌握其计算。了解离子强度的定义。
?了解德拜-休格尔极限公式计算离子平均活度系数的方法。
?理解可逆电池的概念,理解能斯特方程的推导掌握其应用。
?掌握电池电动势与热力学函数的关系及其计算。
?掌握常用电极符号、电极反应及其电极电势的计算,掌握电池电动势的计算及其应用。
?理解原电池的设计原理。
?了解极化作用和超电势的概念。
二、教学内容
1.电解质溶液导电机理及导电能力
电解质溶液的导电机理,法拉弟定律。
离子的迁移现象、迁移数、迁移数的实验测定(希托夫法)。
电导、电导率、摩尔电导率,影响电导的因素。
离子独立运动定律。
电迁移率。
电导的实验测定及应用(计算弱电解质的电离度和电离常数、计算难溶盐的溶解度、电导滴定)。
2.电解质的平均活度和平均活度系数
*3.德拜-休格尔极限公式
4.原电池的电动势
金属与溶液间电势差的产生,原电池的电动势。
5.可逆电极与可逆电池
电池的充电与放电,可逆电池的条件。第一、二类电极、氧化-还原电极。
6.原电池热力学
电池的电动势与电池反应的ΔrGm, ΔrHm,ΔrSm之间的关系。
能斯特方程
7.电极电势
标准氢电极、参比电极,电极电势及其计算。
电池电动势与电极电势的关系.电极反应的ΔrGm。
8.浓差电池
电极浓差电池与电解质浓差电池。
液体接界电势的产生及计算。
盐桥的作用.
9.电池设计
将反应设计成电池的一般方法。
*10.极化作用
分解电压、极化与超电势、极化曲线、析出电势。
电解时的电极反应。
第九章 统计热力学初步
一、本章基本要求
?了解统计热力学的基本假设。
?了解粒子的运动形式、能级分布与状态分布了解分布的微态数及系统的总微态数。
?了解最概然分布及平恒分布
?理解玻尔兹曼能量分布及其适用条件。
?理解粒子配分函数的意义及计算
?理解独立子系统的能量和熵与配分函数的关系。
二、教学内容
1、基本概念
统计系统分类、粒子的运动形式各种运动形式的能级公式。能级分布与状态分布。
2.分布的微态数及系统的总微态数
分布微态数的计算,系统的总微态数。
3.最可几分布与平衡分布
等概率假设,最概然分布。
波尔兹曼分布(拉格朗日待定乘数法)。
最概然分布与平衡分布的关系。
4粒子配分函数的计算
配分函数的析因子性质,能量零点对配函数的影响。平动配分函数的计算,双原子分子转动,振动配分函数的计算。
5.粒子配分函数与系统热力学性质的关系
理想气体的热力学性质
理想气体的统计热力学模型
理想气体的全配分函数
理想气体的状态方程式
理想气体的热力学与热容
理想气体的统计熵
理想气体的化学平衡常数
平衡常数的统计表达式。
第十章 表面现象
一、本章基本要求
?理解表面张力及表面吉布斯函数的概念。
?理解接触角、润湿、附加压力的概念及其与表面张力的关系。
?理解拉普拉斯公式及开尔文公式的应用。
?理解亚稳状态与新相生成的关系。
?理解物理吸附与化学吸附的含义和区别。
?了解兰格缪尔单分子层吸附理论,理解兰格缪尔吸附等温式。
?了解溶液界面的吸附及表面活性物质的作用与应用。
?了解吉布斯吸附公式的含义和应用。
二、教学内容
1.表面吉布斯函数与表面张力
2.润湿现象
接触角,杨氏(Yong)方程,润湿与辅展。
3.弯曲液面的附加压力,饱和蒸汽压,拉普拉斯(Laplace)方程,开尔文(Kelvin)方程和毛细现象
4.亚稳状态和新相的生成
过饱和蒸气、过热液体、过冷液体、过饱和溶液。
5.固体表面上的吸附作用
物理吸附与化学吸附
等温吸附,弗仑德利希经验式。
兰格谬尔单分子层吸附理论.及兰格谬尔吸附等温式
BET吸附公式及固体表面积的测定。
6.液体表面吸附作用
吉布斯吸附公式,表面活性物质。
第十一章 化学动力学
一、本章基本要求
?理解化学反应速率、基元反应及反应分子数的概念。
?理解反应速率常数以及反应级数的概念。
?掌握通过实验确立速率方程的方法。
?掌握一级、二级反应的速率方程及其应用。
?了解典型复杂反应的特征。
?了解处理对行反应、平行反应和连串反应的动力学方法。
?理解定态近似法、平衡态近似法及速率决定步骤等处理复杂反应的近似方法。
?理解阿累尼乌斯方程的意义,并掌握其应用。理解活化能及指前因子的意义。
?了解基元反应速率理论的基本思想。理解气相双分子碰撞理论和过渡状态理论的基本公式及有关概念。
?了解链反应动力学的特点。
?了解多相反应的基本步骤。
?了解催化作用、光化学反应及溶液中反应的特征。
二、教学内容
1.化学反应的速率
反应速率的表示方法及实验测定。
2.化学反应的速率方程(微分式)
基元反应,基元反应的速率方程--质量作用定律,反应分子数。
速率方程的一般形式、反应级数、速率常数。
3.速率方程的积分式
零级、一级、二级及n级反应的特点、半衰期。
4.速率方程的确定
微分方法,积分法,半衰期法。
5.温度对反应速率的影响
阿累尼乌斯公式,活化能。
6.复杂反应
对行反应,平行反应、连串反应、链反应的反应机理及速率方程。
△复杂反应速率的近似处理法。
7.链反应
链反应机理,直链反应的动力学方程,链反应与爆炸
△8.反应速度理论
气相双分子简单碰撞理论,过渡状态理论。
△9.溶液中的反应
△10.光化学,光化反应的基本定律,量子效率,光化反应的机理与速率方程。
△11.催化反应
催化作用的通性:催化剂的作用、活性和选择性。
催化反应的一般机理。
*均相催化反应:酸碱催化、络合催化、酶化学。
气-固相催化反应:催化剂在固体表面上的吸附,气-固相催化反应的步骤,气-固相表面反应控制步骤催化反应动力学。
第十一章 胶体化学
一、本章基本要求
?了解分散体系的分类及胶体的定义
?理解溶胶的光学性质、动力性质和电学性质。
?理解胶团的结构和胶体稳定性与聚沉作用。
二、教学内容
1.胶体及分散物系概述
分散物系的基本性质与分类。
2.胶体的光学性质
丁达尔效应,雷利公式。
3.胶体的动力性质
布朗运动,扩散,沉降与沉降平衡。
4.胶体的电学性质
电泳、电渗现象
双电层结构,沉降电势,流动电势。
胶团结构。
5.憎液溶胶的稳定和聚沉
胶粒带电的稳定作用,憎液溶胶的聚沉,聚沉值。
三、教学方法与教学手段说明
以课堂教学为主,结合PowerPoint电子教案与物化CAI课件等电化教学手段
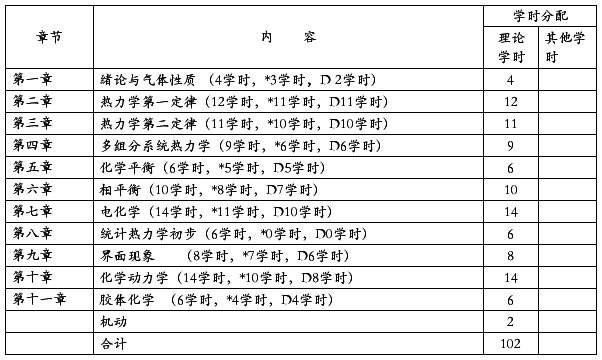
四、课程内容安排及学时分配
五、教材与主要参考书目
教 材:天津大学物理化学教研室编,《物理化学》(第四版). 北京:高等教育出版社出版.2001
参考书目:
1、付献彩主编,《物理化学》上、下册. 第三版.北京:高等教育出版社出版.2001
2、胡英主编,《物理化学》上、中、下册. 第一版,北京:高等教育出版社出版.2001
3、宋世谟主编,《物理化学》上、下册,第四版.北京:高等教育出版社出版.2001
六、说明
1、无标注表示总学时为102的学时分配,全部内容作为教学要求;
2、标注*号表示总学时为85的学时分配,标注*号的内容不作教学要求;
3、标注D表示总学时为68以下的学时分配,标注D和*号的内容不作教学要求
4、物理化学原理应用实例根据专业特点有所侧重,相平衡在化学工程精流中的应用,对化学工程与工艺专业注意与后续专业课的联系。表面化学、胶体化学注意对材料专业后续课的联系。
第二篇:物理化学B教学大纲
422.010.1 物理化学(B)教学大纲
学分数4 周学时4
总学数72
教学目的与要求
课程性质:
物理化学(B)是生物类各专业本科学生的一门基础课程,学生在修读完普通化学B、高等数学、普通物理和有机化学课程后可修读本课程。
基本内容:
物理化学是用物理的理论及实验方法来研究化学变化规律的科学,而生命过程总是与化学反应和物理过程密切相关的,每个生物科学工作者都需要应用物理化学的知识来解决工作中的问题。本课程基本内容有热力学第一、第二、第三定律,溶液,化学平衡和相平衡,电化学,表面现象与胶体及大分子溶液,化学动力学。
基本要求:
通过本课程的学习,要求学生理解和掌握物理化学中的基本概念和基本原理,解决物理化学等实验中的实际问题,并能在生物系统中作一些应用,提高学生分析问题和解决问题的能力。
教学内容及学时分配:
绪论(1学时)
了解:物理化学的研究对象 物理化学对生物研究的应用。
讲课要点:
§0-1物理化学的内容与作用
§0-2物理化学在生命科学中的应用
第一章 热力学第一定律(9学时)
掌握:全微分和状态函数,功,热,内能,可逆过程和最大体积功,焓和热容,绝热过程等基本概念,及热力学第一定律的应用和反应焓变的计算方法。
理解:理想气体的卡诺循环
了解:溶解热与稀释热
讲课要点:
§1-1热力学的研究
§1-2热力学第一定律
§1-3可逆过程与最大功
§1-4焓和热容
§1-5热力学第一定律的应用
§1-6绝热过程
§1-7热化学
第二章 热力学第二定律和第三定律(14学时)
掌握:热力学第二定律和第三定律的各种表述及应用;封闭体系热力学的基本方程和 Maxwell关系式及其应用;各种过程熵变和吉布斯自由能变化的计算方法;掌握各种判据的条件和使用方法和Clausius-Clapeyron方程的物理意义及其应用。
理解:化学势在相变化和化学变化中的应用,气体的化学势及逸度的求法,统计热力学的基础。 了解:物质的标准熵和标准摩尔生成焓的由来及牛顿图的由来
讲课要点:
§2-1热力学第二定律
§2-2熵的概念和熵变计算
§2-3亥姆霍兹自由能和吉布斯自由能
§2-4封闭体系的基本方程式
§2-5热力学第三定律和规定熵
§2-6吉布斯自由能变化的计算
§2-7统计热力学基础
§2-8纯物质两相间的平衡
§2-9气体化学势
第三章 溶液(8学时)
掌握:理想溶液和稀溶液的定义,稀溶液的依数性及其用途,唐南平衡,活度测定的方法和超额函数的概念。
理解:集合公式和吉布斯-杜亥姆公式的推导和应用
了解:渗透系数
讲课要点:
§3-1偏摩尔量
§3-2理想溶液和稀溶液
§3-3稀溶液的依数性
§3-4实际溶液
§3-5在水溶液中生物化学物质的标准生成自由能
第四章 化学平衡与相平衡(10学时)
掌握:化学反应等温式、化学反应亲和势的作用,温度、压力、惰性气体等对理想气体化学反应平衡的影响;溶液中平衡常数的计算;理想气体同时平衡时,平衡常数的表示式。Gibbs相律;二元相图及其应用。
理解:化学反应的耦合,水蒸汽蒸馏,萃取的原理
了解:敞开体系熵变 dS=diS+deS;三元盐水相图。
讲课要点:
§4-1平衡常数及化学反应等温方程式
§4-2复相化学平衡
§4-3溶液中的平衡常数
§4-4影响化学平衡的因素
§4-5同时平衡
§4-6反应的耦合
§4-7相律
§4-8单组分体系的相图
§4-9二组分体系的相图及其应用
§4-10三组分体系的相图
第五章 电化学(10学时)
掌握:摩尔电导的定义,电导测定的应用;电解质的活度和平均活度系数,离子强度。可逆电极的种类,电池的表示法和电池反应,电动势测定的应用;电池反应的热力学;生物膜电势。 理解:德拜-休格尔极限公式及其应用,淌度、迁移数的测定方法,极化作用;塔菲尔方程。 了解:浓差电池和液体接界电势
讲课要点:
§5-1法拉第定律
§5-2离子的淌度和迁移数
§5-3电导测定的应用
§5-4电解质溶液的活度和活度系数
§5-5可逆电池的电动势
§5-6电池反应的热力学
§5-7电动势测定的应用
§5-8浓差电池和液体接界电势
§5-9生物膜电势
§5-10极化作用
第六章 表面现象与胶体及大分子溶液(10学时)
掌握:表面张力与表面自由能;杨-拉普拉斯方程,开尔文方程;吉布斯吸附等温式和朗缪尔吸附等温式及其适用条件;粒子大小的分布。
理解:润湿与铺展;胶团的结构和溶胶稳定性的原因。
了解:表面膜;沉降和沉降平衡。
讲课要点:
§6-1表面张力和表面自由能
§6-2弯曲液面的现象
§6-3润湿与铺展
§6-4溶液表面吸附
§6-5不溶性表面膜
§6-6气体在固体表面的吸附
§6-7胶体及大分子溶液
第七章 化学动力学(10学时)
掌握:化学反应的速率、质量作用定律、反应级数和反应分子数的概念;典型复杂反应的速率常数计算方法;阿累尼乌斯公式,活化能的意义;稳态近似和平衡态近似的原理及其相互关系;酶的催化机理。
理解:微观可逆性原理和仔细平衡原理;理想活塞流和理想回混流的特点;化学弛豫,光化学反应的特点和机理。
了解:气体反应的碰撞理论和反应速率的活化络合物理论,分子束反应,酶抑制剂和抑制机理。
讲课要点:
§7-1化学动力学的任务和目的
§7-2化学反应的速率
§7-3化学反应的速率方程
§7-4由机理推导速率方程
§7-5速率方程的积分形式
§7-6仔细平衡原理
§7-7温度对速率常数的影响
§7-8复杂反应
§7-9化学弛豫
§7-10流动体系中的反应
§7-11反应速率理论
§7-12光化学反应
§7-13催化作用
教学方式:
本课程以课堂讲授为主,着重讲授重点、难点的章节,并根据学生的水平,适当安排学时让学生讨论。
考核方式:
评分以期末闭卷考试为主。
教材与参考书:
教材: 《基础物理化学》,江逢霖等译,
[美]WALTER J.MOORE著,复旦大学出版社,1992
年。
参考书: [1]《物理化学学习
指导》,范康年、邓景发主编,
复旦大学出版社,19xx年。
[2]《物理化学简明教程》(第
三版),印永嘉、奚正楷、李
大珍编,高等教育出版社,
19xx年。
[3]《物理化学》,周日新编,南京大学出版社,19xx年。
[4]《生物工作者的物理化学
计算》,张朝章编,安徽科学
技术出版社,19xx年。
[5]《物理化学》(第三版),
天津大学物理化学教研室编,
高等教育出版社,19xx年。
本课程历史沿革:
本课程是生物类学生修读的一门重要基础课,从19xx年起开设。先后有张志炳、朱京、叶秀贞、李全芝、周伟舫、陆寿蕴、李诚芳、李承瑞、冯安春、孔德俊、范嘉范和李宏珉等主讲本课程。其中张志炳、朱京、冯安春、范嘉范四位教师这门课长达五个学期之久。
从五十年代到八十年代,教材是各位教师自行编写的讲义,在内容上每学期均有所改进,主要参考书为印永嘉等编的《物理化学简明教程》。九十年代,使用的教材有江逢霖等译的《基础物理
化学》,还增加了张朝章编的《生物工作者的物理化学计算》,周日新编的《物理化学》等参考书,这对生物类学生更加适用。
19xx年学校进行按类教学改革,冯安春和范嘉范两位教师,根据生物类学生的实际情况,重新调整了课程结构,制定了教学大纲。现修订的教学大纲以此为依据重新编写。本大纲于19xx年已开始在生化、遗传专业试行。
编制者:范嘉范
审定者:孔德俊,吴性良
教研室主任:王怀明
系主任:范康年
制定日期:19xx年12月
