武汉大学20##—20##学年第二学期
《分析化学实验》试卷(B)
学号: 姓名: 院系: 专业: 得分:
一、填空(20分,每空1分)
1.标定NaOH溶液的邻苯二甲酸氢钾中含有邻苯二甲酸,对测定结果的影响是 ;标定HCl溶液的浓度时,可用Na2CO3或硼砂(Na2B4O7·10H2O)为基准物质,若Na2CO3吸水,则标定结果 ;若硼砂结晶水部分失去,则标定结果 。
2.邻二氮菲吸光光度法测定蜂蜜中微量铁实验中,盐酸羟胺作 ;醋酸钠的作用是 ;制作吸收光谱的目的是 。将含铁试样稀释时,其最大吸收峰的波长 ;
3.欲配制 1000ml 0.1mol/L HCl 溶液,应取浓盐酸 ml;欲配制(1+1)H2SO4应将 。
4.测定胆矾含量时,用Na2S2O3滴定至浅黄色才加入淀粉的原因是 ,再滴定至浅蓝色,加入NH4SCN的作用是使 。
5. 某基准物质A的摩尔质量为130g·mol-1,用它标定0.02mol·L-1的B溶液,假定反应为5A+2B=2P,则每份基准物质的范围是
6.在自来水总硬度的测定时为掩蔽少量的Fe3+,Al3+,应加入 ,以 为指示剂,测定终点的颜色为 。
 7.在滴定操作中 手控制滴定管, 手握锥形瓶;滴定接近终点时,控制半滴加入,加入半滴溶液的方法是 ;滴定完毕进行读数时,应将滴定管 ,视线应与 。
7.在滴定操作中 手控制滴定管, 手握锥形瓶;滴定接近终点时,控制半滴加入,加入半滴溶液的方法是 ;滴定完毕进行读数时,应将滴定管 ,视线应与 。
二、简答(40分)
1.为什么标定0.1mol/L NaOH溶液时称取的KHC8H4O4基准物质要在0.4~0.6g范围内? ( MKHC8H4O4=204.2) ,用NaOH作为标准溶液测定有机酸摩尔质量时选用什么指示剂?为什么?(10分)
2.下面实验操作中有哪些错误: (5分)
某人称取工业纯Na2CO3试样0.7502克,置于烧杯中,用水溶解后,定量转移至250ml容量瓶中,然后直接用蒸馏水荡洗过的25ml移液管吸取试液三份,置于预先用试液荡洗过的三角烧瓶中,加入甲基红指示剂2滴,用标准HCl溶液滴定至终点颜色,消耗HCl溶液的平均体积10.1ml。(10分)
3.络和滴定中返滴定法与置换法所使用的EDTA有何不同(是否标准溶液)?用EDTA直接滴定金属离子,终点所呈的颜色是游离指示剂的颜色还是指示剂-金属离子络合物的颜色?(10分)
4.用碘量法测定胆矾中铜含量时, 加入NH4SCN的作用是什么?为什么NH4SCN溶液要在接近终点时加入?如加得过早,会对分析结果造成什么影响?
(10分)
三、设计:(40分)
用滴定分析法测定HCl-MgCl2(浓度0.1 mol·L-1-0.01mol·L-1)的混合溶液中各组分的含量。(要求:原理、主要试剂及步骤)
指示剂及常数: 甲基橙(变色范围pH=3.1~4.4)
酚酞(变色范围pH=8.0~10.0)
铬黑T(使用最佳酸度pH=9~10.5)
MZn =65.39 (g/mol)
MMg =24.30 (g/mol)
MEDTA =372.2 (g/mol)
MCl =35.45 (g/mol)
lgK’MgY =8.70
lgK’MgIn =7.00
武汉大学20##—20##学年第二学期
《分析化学实验》试卷(B)
参考答案
一、填空(20分,每空1分)
1.标定NaOH溶液的邻苯二甲酸氢钾中含有邻苯二甲酸,对测定结果的影响是 偏低 ;标定HCl溶液的浓度时,可用Na2CO3或硼砂(Na2B4O7·10H2O)为基准物质,若Na2CO3吸水,则标定结果 偏高 ;若硼砂结晶水部分失去,则标定结果 偏低 。
2.邻二氮菲吸光光度法测定蜂蜜中微量铁实验中,盐酸羟胺作 还原剂 ;醋酸钠的作用是 调节酸度 ;制作吸收光谱的目的是 选择最佳吸收波长 。将含铁试样稀释时,其最大吸收峰的波长 保持不变;
3.欲配制 1000ml 0.1mol/L HCl 溶液,应取浓盐酸 8.4 ml;欲配制(1+1)H2SO4应将 1体积的浓硫酸倒入1体积的水中 。
4.测定胆矾含量时,用Na2S2O3滴定至浅黄色才加入淀粉的原因是 防止淀粉与I2过早形成兰色络合物,大量I3—被CuI吸附,终点呈较深灰色,不好观察。再滴定至浅蓝色,加入NH4SCN的作用是 将CuI转化成溶解度更小的CuSCN,释放出被吸附的碘吸附,使反应更完全。
5. 某基准物质A的摩尔质量为130g·mol-1,用它标定0.02mol·L-1的B溶液,假定反应为5A+2B=2P,则每份基准物质的范围是 0.13~0.19g
6.在自来水总硬度的测定时,为掩蔽少量的Fe3+,Al3+,应加入 三乙醇胺 ,以 EBT 为指示剂,测定终点的颜色为纯兰色 。
7.在滴定操作中 左 手控制滴定管, 右 手握锥形瓶;滴定接近终点时,控制半滴加入,加入半滴溶液的方法是轻轻转动旋塞,使溶液悬挂在出口管嘴上,形成半滴,用锥瓶内壁将其沾落,再用洗瓶吹洗;滴定完毕进行读数时,应将滴定管 取下 ,视线应与 欲读刻度线平行。
二、简答(40分)
1.为什么标定0.1mol/L NaOH溶液时称取的KHC8H4O4基准物质要在0.4~0.6g范围内? ( MKHC8H4O4=204.2) ,用NaOH作为标准溶液测定有机酸摩尔质量时选用什么指示剂?为什么?(10分)
根据①0.1mol/L 、②滴定所消耗滴定剂一般在20—30ml间,③ 反应方程式计算而得。选用弱碱性范围变色酚酞指示剂。因为,有机酸一般为弱酸,与NaOH反应的化学计量点在弱碱性范围。
2.下面实验操作中有哪些错误:
某人称取工业纯Na2CO3试样0.7502克,置于烧杯中,用水溶解后,定量转移至250ml容量瓶中,然后直接用蒸馏水荡洗过的25ml移液管吸取试液三份,置于预先用试液荡洗过的三角烧瓶中,加入甲基红指示剂2滴,用标准HCl溶液滴定至终点颜色,消耗HCl溶液的平均体积10.1ml。(10分)
1:直接用蒸馏水荡洗过的25ml移液管吸取试液。(要用待测液润洗)
2:预先用试液荡洗过的三角烧瓶中。(三角烧瓶不能用试液荡洗)
3:甲基红(甲基橙)
4:滴定至终点颜色(什么颜色?)
5: 消耗HCl溶液的平均体积10.1ml(应记为10.10)
3.络和滴定中返滴定法与置换法所使用的EDTA有何不同(是否标准溶液)?用EDTA直接滴定金属离子,终点所呈的颜色是游离指示剂的颜色还是指示剂-金属离子络合物的颜色?(10分)
返滴定法所使用的EDTA是标准溶液,置换法所使用的EDTA不是标准溶液。
游离指示剂的颜色
4.用碘量法测定胆矾中铜含量时, 加入NH4SCN的作用是什么?为什么NH4SCN溶液要在接近终点时加入?如加得过早,会对分析结果造成什么影响?
(10分)
加入NH4SCN的作用是生成溶解度更小的CuSCN,以释放被吸附的I2,加得过早SCN——会还原I2使结果偏低。
三、设计:
1 原理
HCL+NaOH NaCl+H2O
NaCl+H2O
酸碱滴定法测HCL,指示剂:甲基红.
Mg2++Y2- MgY
MgY
络合滴定法测Mg2+,pH9—10,指示剂:铬黑T
计算:C HCLV HCL=C NaOHV NaOH
C MgCl2V MgCl2=C EDTAV EDTA
2 试剂: KHC8H4O4(固)、纯Zn、 NaOH、EDTA、NH3H2O、HCL、
铬黑T指示剂、甲基红指示剂。酚酞指示剂, NH3H2O—NH4Cl缓冲溶液。
3 操作步骤:
① NaOH标准溶液的配制与标定:称取2g NaOH固体于烧杯中,加水溶解,稀释至500ml混匀,待标定.准确称取0.4—0.6g基准KHC8H4O4于250ml锥形瓶,加50ml水溶解,加酚酞指示剂1—2滴,用待标定的NaOH溶液滴定至微红色30s不退色即为终点,记录消耗NaOH溶液的体积。平行三份。计算NaOH标准溶液的浓度。
② EDTA标准溶液的配制与标定:称取2g EDTA固体于烧杯中,加水溶解,稀释至500ml混匀,待标定。准确称取纯Zn片0.17克于100ml小烧杯中,加6ml(1+1)HCL溶解,定量转移至250ml容量瓶中,水稀释刻度,摇匀。准确吸取25.00mlZn标准溶液于250ml锥形瓶中,加甲基红指示剂1滴,用(1+2)NH3H2O调到恰变微黄色,加入10mlNH3H2O—NH4Cl缓冲溶液,加铬黑T指示剂3滴,混匀,用EDTA溶液滴定至溶液由紫红色变为蓝色即为终点,记录消耗EDTA溶液的体积,平行三份。计算EDTA标准溶液的浓度。
③ HCL含量的测定:准确移取25.00ml待测液于250ml锥形瓶中,加30—40ml水,加1—2滴酚酞指示剂,用NaOH标准溶液滴定至微红色30s不退色即为终点,记录消耗NaOH标准溶液的体积,平行三份。计算混合液中HCL含量。
④ MgCl2含量的测定:准确移取25.00ml待测液于250ml锥形瓶中,加30—40ml水,加甲基红指示剂1滴,用(1+2)NH3H2O调到恰变微黄色,加入10mlNH3H2O—NH4Cl缓冲溶液,加铬黑T指示剂3滴,混匀,用EDTA标准溶液滴定至溶液由紫红色变为蓝色即为终点,记录消耗EDTA标准溶液的体积,平行三份。计算混合液中MgCl2含量
第二篇:分析化学实验教案-容量瓶的相对校准20xx,11,1
分析化学实验教案
实验七:容量瓶的相对校准
教学目标及基本要求
1、掌握容量瓶、移液管的操作使用方法。
2、学习容量瓶、移液管的校准方法。
3、了解容量器皿校准的意义。
教学内容及学时分配
1、评前次实验报告,提问检查预习落实情况,0.1学时。
2、讲解实验内容,0.4学时。
3、演示容量瓶、移液管的操作使用,0.3学时。
4、开始实验操作,在操作中发现和纠正错误,2.2学时。
实验内容
1、容量瓶、移液管的操作使用练习。
2、容量瓶与移液管的相对校准。
重点和难点
相对校准和绝对校准的概念和计算,移液管的正确使用。
教学方式及注意问题
以提问的方式了解预习内容落实情况,以讲授法讲解实验内容;以现场指导法纠正和规范实验操作。
参考书目及网络资源
基础化学实验(I)------无机及分析化学部分,山东大学、山东师范大学等高校合编,化学工业出版社教材出版中心,20##年7月第一版。
讲授内容
1. 实验目的
1、掌握容量瓶、移液管和吸量管的操作使用方法。
2、学习容量瓶、移液管的校准方法。
3、了解容量器皿校准的意义。
2. 实验原理
容量瓶、移液管和吸量管是滴定分析法所用的主要量器。容量器皿的容积与其所标出的体积并非完全相符合。因此,在准确度要求较高的分析工作中,必须对容量器皿进行校准。
由于玻璃具有热胀冷缩的特性,在不同的温度下容量器皿的体积也有所不同。因此,校准玻璃容量器皿时,必须规定一个共同的温度值,这一规定温度值为标准温度。国际上规定玻璃容量器皿的标准温度为20℃。既在校准时都将玻璃容量器皿的容积校准到20℃时的实际容积。
容量器皿常采用两种校准方法。
1、相对校准
要求两种容器体积之间有一定的比例关系时,常采用相对校准的方法。例如,25mL移液管量取液体的体积应等于250mL容量瓶量取体积的10 %。
2、绝对校准
绝对校准是测定容量器皿的实际容积。常用的校准方法为衡量法,又叫称量法。即用天平称得容量器皿容纳或放出纯水的质量,然后根据水的密度,计算出该容量器皿在标准温度20℃时的实际体积。由质量换算成容积时,需考虑三方面的影响:
(1)水的密度随温度的变化
(2)温度对玻璃器皿容积胀缩的影响
(3)在空气中称量时空气浮力的影响
为了方便计算,将上述三种因素综合考虑,得到一个总校准值。经总校准后的纯水密度列于表3-2。
实际应用时,只要称出被校准的容量器皿容纳和放出纯水的质量,再除以该温度时纯水的密度值,便是该容量器皿在20℃时的实际容积。
实验内容
1. 容量瓶、吸量管和移液管的操作使用方法
见PPT文件
移液管和吸量管
移液管为精密转移一定体积溶液时用的。转移溶液
移液管和吸量管是用来准确量取一定体积溶液的仪器,其中移液管全称“单标线吸量管”,形状如图所示,只能量取某一体积(如10.00mL,25.00mL 等)的溶液,中间膨大,上下两端为细管状,在上管有标线,表明移液管移取的液体的体积。吸量管全称“分度吸量管”,形状如图所示,是带有分刻度的玻璃管,用于吸取不同体积的液体,最小分刻度为0.1mL,0.02mL 等,每只移液管和吸量管上都标有使用温度和它的容量。洗涤:用移液管和吸量管吸取液体之前,首先应该用洗液洗净量器内壁,经自来水冲洗和蒸馏水洗涤三次后,还必须用少量待吸取的溶液润洗内壁三次,以保证溶液吸取后浓度不变。
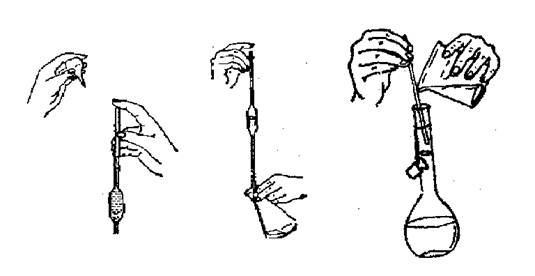
吸取和放出溶液:用移液管吸取溶液时,一般应先将待吸取溶液转移到已用该溶液润洗过的烧杯中,然后再吸取,而不是将移液管直接深入到试剂瓶中取液。吸取溶液,左手拿洗耳球,右手拇指及中指拿住管颈标线以上的地方,管尖插入液面以下,防止吸空。当溶液上升到标线以上时,迅速用右手食指紧按管口,将管取出液面。左手改拿盛溶液的烧杯,使烧杯倾斜约45o,右手垂直地拿住移液管使管尖紧靠液面以上的烧杯壁,微微松开右手食指,或用拇指和中指轻轻转动移液管,直到液面缓缓下降到与标线相切时,再次按紧管口,使液体不再流出。把移液管慢慢地垂直移入准备接受溶液的容器内壁上方。倾斜容器使它的内壁与移液管的尖端相接触,松开食指让溶液自由流下。待溶液流尽后,再停15s 取出移液管。
不要把管尖的液体吹出,因为在校准移液管体积时,没把这部分液体算在内(如管上标有“吹”字的移液管,则要将管尖的液体吹出)。
吸量管的使用方法同移液管只是带有分刻度。
移液管和吸量管使用三步
1. 洗净、润洗
使用时,应先将移液管洗净,自然沥干,并用待量取的溶液少许荡洗3次。
2.吸取溶液
(1)手法:左手拿洗耳球,右手拇指及中指拿住管颈标线以上的地方,然后以右手拇指及中指捏住管颈标线以上的地方,当溶液上升到标线以上时,迅速用右手食指紧按管口,将管取出液面。
取出移液管,用滤纸条拭干移液管下端外壁,
(2)注意 管尖位置 和视线
(3)放液至刻度
并使与地面垂直,稍微松开右手食指,使液面缓缓下降,此时视线应平视标线,直到弯月面与标线相切,立即按紧食指,使液体不再流出,并使出口尖端接触容器外壁,以除去尖端外残留溶液。
3. 移转溶液
再将移液管移入准备接受溶液的容器中,使其出口尖端接触器壁,使容器微倾斜,而使移液管直立,然后放松右手食指,使溶液自由地顺壁流下,待溶液停止流出后,一般等待15秒钟拿出。
*移液管尖端仍残留有一滴液体
注意此时移液管尖端仍残留有一滴液体,不可吹出。
为了保证一次移液的准确性,必须做到以下几点,
一、移液管必须正确选择 由于移液管自身的局限性,我们必须选择大于实际移取量的移液管;二、移液管必须清洗干净 移液管的清洗必须做到不挂壁、不聚滴;
三、移液管必须充分润洗 移液管必须先用蒸馏水润洗2-3次,然后用样夜润洗2-3次;四、移液指法要正确 拿移液管的时候,拇指和中指捏住移液管,食指和拇指尽量分开,食指太干燥不行,但是太湿润的话更不行;
五、熟能生巧是正确的 理论再扎实还需实践作支撑,有些东西只可意会不可言传,多加练习总是没错的。
2. 容量瓶与移液管的相对校准
用25mL移液管吸取去离子水注入洁净并干燥的250mL容量瓶中(操作时切勿让水碰到容量瓶的磨口)。重复10次,然后观察溶液弯月面下缘是否与刻度线相切,若不相切,另做新标记,经相互校准后的容量瓶与移液管均做上相同记号,可配套使用。
1.本次实验因时间关系,只对25mL 移液管做绝对校准以及25mL 移液管与100m量瓶之间的相对校准。
2.提醒学生首先检查100mL 容量瓶是否干燥,否则用4-5ml乙醇润洗后,晾干。
【思考题】
1. 为什么要进行容器器皿的校准?影响容量器皿体积刻度不准确的主要因素有哪些?
2. 使用移液管的操作要领是什么?为何要垂直流下液体?为何放完液体后要停一定时间?最后留于管尖的液体如何处理?为什么?
4、容量瓶、吸量管和移液管在使用中的应注意事项是什么?
5、如何判断容量瓶、吸量管和移液管是否清洗干净?
6、吸量管和移液管有什么区别?
