深圳市深福源信息咨询有限公司
一直以来,眼科用药市场就是一个利润较高的领域,但由于市场规模较小,跨国制药巨头很少将重心放在此处,因此,眼科处方药市场长期被爱尔康、眼力健和参天等专业眼科公司占据,品种方面以抗炎抗感染用药为主。
近年来眼科用药研究取得了一系列突破,但目前对于视神经萎缩、新生血管性青光眼、黄斑萎缩性变性等一些疑难疾病还缺乏治疗方案,尤其还需要大量基础研究为药品研究提供支持。此外,面对各种屈光不正,尤其是近视,还没有任何有确切疗效的药物问世,因此,我们期待更安全、疗效确切的治疗近视眼的用药早日用于临床,而且相信这一时间并不遥远。
第一章眼药行业相关概述
第一节眼药产业链分析
一、在医药行业中的地位
二、眼药发展史
三、中国眼药发展概况
第二节眼科疾病概述
一、眼科疾病的发病情况
二、中国眼病患者状况分析
三、眼病患者一般情况
四、白内障患者一般情况
五、青光眼患者情况分析
六、角膜病与沙眼病患者情况
第二章2012-20xx年全球眼药市场运行形势分析
第一节2012-20xx年全球眼药产业发展综述
一、全球眼药发展特点分析
二、全球眼药研发领域分析
三、全球眼药市场规模分析
第二节2012-20xx年世界部分地区和国家眼药发展分析
一、美国眼药发展分析
二、欧洲眼药发展分析
三、韩国眼药发展分析
四、日本眼药发展分析
第三章2012-20xx年中国眼药行业运行环境分析
第一节国内宏观经济环境分析
第二节2012-20xx年中国眼药政策法规环境分析
一、2012-20xx年眼药行业政策环境分析
二、2012-20xx年国内宏观政策对其影响
三、2012-20xx年行业产业政策对其影响
第四章2012-20xx年中国眼药行业发展走势分析
第一节2012-20xx年全国眼药市场分析
文档由立木信息咨询提供 更多内容可登陆公司网站查询:

深圳市深福源信息咨询有限公司
一、全国眼药市场规模分析
二、中国眼药市场特点分析
三、2012-20xx年全国眼药市场变化趋势
第二节2012-20xx年中国眼药市场需求分析
一、眼药市场销量分析
二、眼药零售市场分析
第三节2012-20xx年相关眼药市场价格分析
一、眼药市场价格影响因素
二、眼药市场价格走势
三、2012-20xx年眼药市场价格走势
第四节2012-20xx年对中国眼药市场的分析及思考
一、眼药市场特点
二、眼药市场分析
三、眼药市场变化的方向
四、中国眼药产业发展的新思路
五、对中国眼药产业发展的思考
第五章2012-20xx年中国眼药消费市场动态分析
第一节2012-20xx年中国眼药市场特征分析
一、眼药市场消费特征
二、眼药消费者行为分析
三、眼药市场特征分析
第二节2012-20xx年中国消费行为及心理分析
一、主要城市眼药市场调查
二、消费者治疗眼疾的方法
三、消费者治疗眼疾的花费
四、消费者青睐主流眼药品牌
第三节2012-20xx年中国连锁药店市场分析
一、连锁药店市场分析
二、重庆和平药房连锁有限公司
三、天津中新药业连锁药店
四、重庆桐君阁大药房连锁
五、深圳一致
六、青岛国风大药房连锁
七、四川天诚大药房
八、中联大药房
九、辽宁成大方圆
十、黄庆仁栈药店
十一、海王星辰
第六章2012-20xx年中国眼药细分产业市场走势分析
第一节白内障用药市场
一、中国白内障治疗药物市场需求分析
二、白内障治疗药物市场竞争格局分析
文档由立木信息咨询提供 更多内容可登陆公司网站查询:

深圳市深福源信息咨询有限公司
三、白内障治疗药物市场发展趋势分析
第二节抗青光眼制剂和缩瞳药市场分析
第三节其他用药市场
一、眼用抗感染药市场分析
二、人工泪液及润眼剂市场分析
三、青光眼治疗用药市场分析
四、改善视疲劳药物市场分析
五、眼用激素及其复方制剂市场分析
第四节2012-20xx年眼科用药物市场主要品种分析
一、泰利必妥滴眼液(氧氟沙星)
二、异帕米星
三、典必殊(妥布霉素/地塞米松滴眼液)
四、透明质酸钠
五、托百士(妥布霉素滴眼液)
六、卡林优(吡诺克辛钠滴眼液)
七、左旋氧氟沙星
八、普拉洛芬
九、碱性成纤维细胞生长因子
十、氟美童(醋酸氟米龙滴眼液)
十一、沃丽汀(卵磷脂络合碘糖衣片)
十二、爱丽滴眼液(玻璃酸钠滴眼液)
十三、润舒(氯霉素滴眼液)
十四、贝复舒(重组牛碱性成纤维细胞生长因子滴眼液) 十五、迪可罗(氧氟沙星滴眼液)
第五节2012-20xx年主要眼药产品零售市场分析
一、珍珠明目滴眼液
二、珍视明滴眼液
三、十五味萝蒂明目丸
四、麝珠明目滴眼液
五、明目地黄丸
六、熊胆滴眼液
七、石斛夜光丸
八、海珠神珍珠明目滴眼液
九、复明片
十、障眼明片
十一、明目羊肝片
十二、熊胆黄苓滴眼液
十三、拨云退翳丸
十四、清目片、障翳散及复方熊胆滴眼液
十五、其他
第七章2012-20xx年中国眼药行业市场竞争格局分析
第一节2012-20xx年中国眼药行业竞争现状分析
文档由立木信息咨询提供 更多内容可登陆公司网站查询:

深圳市深福源信息咨询有限公司
一、眼药品牌竞争分析
二、眼药价格竞争分析
三、营销渠道及策略竞争分析
第二节2012-20xx年中国眼药行业集中度分析
一、市场集中度分析
二、区域集中度分析
第三节2012-20xx年中国眼药企业提升竞争力策略分析
第八章2012-20xx年中国眼药优势企业竞争竞争性财务数据分析
第一节、桂林集琦药业股份有限公司
一、企业介绍
二、企业经营业绩分析
三、企业市场份额
四、企业未来发展策略
第二节、杭州天目山药业股份有限公司
一、企业介绍
二、企业经营业绩分析
三、企业市场份额
四、企业未来发展策略
第三节、山东鲁抗医药股份有限公司
一、企业介绍
二、企业经营业绩分析
三、企业市场份额
四、企业未来发展策略
第四节、中珠控股股份有限公司
一、企业介绍
二、企业经营业绩分析
三、企业市场份额
四、企业未来发展策略
第五节、江西天施康中药股份有限公司珍视明药业分公司
一、企业介绍
二、企业经营业绩分析
三、企业市场份额
四、企业未来发展策略
第九章2013-20xx年中国眼药行业发展前景与投资预测分析
第一节2013-20xx年中国眼科用药市场前景分析
一、眼药市场特点
二、抗感染类品种多用量大
三、各大类药销售趋势
第二节2013-20xx年中国眼科用药趋势分析
一、市场规模独占鳌头
二、氧氟沙星高居榜首
三、跨国药企分享市场
文档由立木信息咨询提供 更多内容可登陆公司网站查询:

深圳市深福源信息咨询有限公司
第三节2013-20xx年主要产品发展前景分析
一、白内障用药市场前景分析
二、抗青光眼制剂和缩瞳药市场前景分析
三、缩瞳药市场前景分析
四、眼用抗感染药市场前景分析
五、人工泪液及润眼剂市场前景分析
六、改善视疲劳药物市场前景分析
七、眼用激素及其复方制剂市场前景分析
第四节2013-20xx年中国眼药行业投资机会分析
第五节2013-20xx年中国眼药行业投资风险分析
第六节专家投资建议
文档由立木信息咨询提供 更多内容可登陆公司网站查询:
第二篇:20xx年度药品审评报告
20xx年度药品审评报告
国家食品药品监督管理总局药品审评中心
国家食品药品监督管理总局药品审评中心是国家食品药品监督管理总局药品注册技术审评机构,负责对药品注册申请进行技术审评。根据国家食品药品监督管理总局相关工作要求,现将《20xx年度药品审评报告》呈现给公众。
一、20xx年主要工作措施及进展
为更好地维护和促进公众健康,药品审评中心在20xx年度深入总结既往经验,继续加强审评管理,不断提升审评效率和质量,保证审评的科学性,着力解决未被满足的临床需求及公众用药的可及性与可支付性问题。20xx年主要的工作措施及进展包括:
(一)进一步加强创新药的审评管理
遵循创新药研发规律,对申请临床的创新药审评进行了合理优化,制定了《创新药临床申请的综合审评要点》,加强此类注册申请审评的规范化管理,严格安全性评价,提高审评效率,推进创新药尽快进入临床试验,以切实鼓励创新。
制定了《新药上市申请临床评价指南(草案)》,在临床审评部门试行并推广,以规范申请上市新药品种的审评,有效控制新药“市场准入”环节的风险,提高新药上市申请审评的质量和效率。
建立了“特殊审批品种管理库”,对依据《药品注册管理办法》纳入特殊审批程序的品种进行定时梳理和督导,做到精细化管理。
在既往交流协作的基础上,今年与国家重大新药创制专项实施管理办公室建立了协调机制。并与该办公室化药组的相关负责人召开了专题会议,就如何对在审的“国家重大新药创制专项”立项的化药新药注册申请合理投入审评资源问题进行了讨论,以鼓励新药创制,努力满足公众健康用药需求。
(二)继续探索仿制药的审评管理机制
在既往诊断分析国内化药仿制药研发和审评现状的基础上,继续探索改革仿制药的审评管理机制。着力解决低水平、高重复的仿制药占用审评资源而临床亟需的仿制药得不到及时审评的问题。今年,药品审评中心积极配合国家总局推进临床亟需仿制药优先审评制度建设。
鉴于专利到期药品的仿制对公众用药的重要意义,对20xx年至20xx年药品专利即将到期的品种进行了调研和梳理分析,共计89个品种,对其中已申报至药品审评中心的62个品种,研究确定了相应的审评策略。 将有限的审评资源向有较高临床治疗价值,且临床亟需的仿制药倾斜,以解决公众用药的可及性和可支付性问题。
(三)进一步加强信息公开和沟通交流,接受监督,促进审评效率和质量提升
今年公开了既往没有公开的生物制品审评计划,并通过申请人之窗向申请人公开审评结论和不批准品种的审评报告,接受申请人对审评结论的申诉。
今年开始全面实施网上提交与药品审评中心沟通交流的申请,以提高申请沟通交流的效率,更好地服务审评决策。今年共组织实施了72次针对研发和审评过程中重大技术问题的沟通交流。
召开灭活脊髓灰质炎疫苗(IPV)审评国际专家研讨会,就Sabin株IPV临床试验和上市后研究的相关议题进行了充分交流和讨论,并形成了共识,保障了此类疫苗审评的质量,为在中国实现20xx年全面使用脊髓灰质炎灭活疫苗奠定了基础。
与“千人计划”专家召开专题交流会,讨论了双方合作的途径和方法,有效地拓宽了药品审评中心借助外部资源以加强专业化审评的渠道。
(四)不断完善审评质量保障体系
完善审评信息架构体系,形成以药理分类、药品、审评任务为主线的架构,构建全新数据标准化体系,以提高信息的利用效率,保障审评质量。
试点开展药品注册全套申报资料电子提交工作,积极探索药品注册申报资料电子化管理机制,以提升审评的质量和效率。
继续深化临床试验登记和信息公示平台工作。在既往工作基础上,改进了平台设计并进一步完善了功能,实现了独立网站的改版。同时,积极配合国家总局发布强制登记的公告要求,已公示试验600多项。这一网站平台有效保障了公众对药物临床研究的知情权,促进了对受试者的保护。
进一步规范国内临床试验的数据管理工作。在前期调研和工作的基础上,总结制定了《规范药物临床试验数据管理工作的实施方案》,并予以公布实施。同时,在统计审评试点中开展数据质量审评工作。上述工作从技术审评角度为提升国内临床试验数据的质量水平提出了明确的总体规划和时间安排,对改善我国临床试验数据管理现状,保证依赖可靠研究数据进行审评决策,具有积极意义。
继续实施并完善专家咨询制度。20xx年全年共集中召开专家咨询会议11次,单独品种召开专家咨询会27次,涉及200个品种,邀请专家1964人次。专家咨询制度对于保证审评质量具有重要意义,在咨询会议组织过程中,着力关注利益冲突和保密的问题,力争会议的公平公正和会议质量。
强化疫苗审评质量管理体系建设,继续推进ISO-9001评估和认证工作。今年通过了世界卫生组织的疫苗技术审评质量体系认证。
继续完善药物研究和评价技术指导原则体系。今年共启动起草或增修订39项指导原则,其中有12项已报国家食品药品监督管理总局审核,有9项上网公开征求意见,有4项已完成专家讨论,有8项已形成初稿。 继续探索借助外部资源提高审评效率和质量。在任务量居高不下而审评人员较少的情况下,对借助外部资源提高审评效率和质量进行了探索。以药理毒理审评为试点,在无利益冲突的前提下,继续探索购买外部审评服务。另外,药品审评中心今年还尝试邀请外部专家参加专业审评,以提高专业审评的质量。
积极探索符合中药特点的审评管理策略。如按中药质量控制规律,固化生产全过程中影响药品质量的关键因素,努力提高中药质量的稳定性和均一性;结合工艺路线的特点,增加质量标准的全面性;积极推动濒危野生药材的可持续利用等。
加强中药注射剂品种的审评管理。针对中药注射剂高风险品种,组织召开了专题会,并将专家共识“关于中药注射剂临床安全性研究与评价关键问题的考虑”等上网公布,明确了中药注射剂的有效性、安全性研究评价的关键点,以降低和控制中药注射剂品种的研发风险。
二、20xx年批准重要治疗领域药品情况
20xx年,经过药品审评中心的审评,提出建议批准以下多个重要治疗领域的药品,为患者获得最新治疗手段提供了可能性,为患者用药可及性与可支付性提供了重要保障。
(一)抗感染用药
1.帕拉米韦氯化钠注射液,是重度甲型或乙型流感病毒感染的治疗药物,是我国具有自主知识产权的化合物。药品审评中心采用早期介入、多渠道交流、动态补充资料等特殊审批程序和措施,在20xx年春季甲流疫情出现时,完成了这一药品生产上市审评,及时为甲流治疗和疫情防控提供了新的有效手段。
2.环丝氨酸胶囊,是合成的广谱抗菌药品,对耐药结核有效并不易产生耐药。世界卫生组织推广的DOTS-Plus的治疗策略中就包括本药品和卷曲霉素。我国依据其多剂量药代动力学研究和生物等效性研究数据,以及我国结核病治疗需要,批准其生产上市。首个环丝氨酸仿制药品的批准生产上市,符合我国二线抗结核病药物储备的需要,是抗击“耐多药结核病”重大公共卫生事件的重要药物基础。
3.吗啉硝唑氯化钠注射液,是我国自主研发和创制的全新抗厌氧菌药品。其针对的目标适应症,即厌氧菌导致的妇科盆腔炎和化脓性阑尾炎、坏疽性阑尾炎一直是临床治疗难点。该品上市后将为我国患者提供新的治疗手段,拓展用药选择空间。
(二)抗肿瘤用药
1.甲磺酸伊马替尼片和胶囊,是目前国际公认治疗慢性髓性白血病的一线治疗药物。由于进口原研的伊马替尼价格昂贵,我国仅少数患者能够使用。我国结合该治疗领域的临床用药实际,依据相关法规,对国内企业的首仿申请采取了特殊审批程序,保证了该产品在专利到期后及时上市,为白血病患者提供了有效、价廉的药品,大幅降低了患者用药费用。
2.达沙替尼片,是一种强效的酪氨酸激酶抑制剂,对5种关键性致癌酪氨酸蛋白激酶均有作用,为目前治疗慢性白血病的主流药物。该品于20xx年6月在美国获准上市,随后20xx年11月在欧盟上市。在我国
于20xx年9月获得进口批件。本品尚无国内企业生产,国产仿制药上市为患者用药可及性和可支付性提供了重要保证。
3.阿瑞匹坦胶囊,是高选择性P物质神经激肽1(NK1)受体拮抗剂,可通过对P物质的拮抗,抑制NK1受体参与的急性呕吐和延迟性呕吐。批准本品的进口上市和国内分包装,可为我国肿瘤患者在高度呕吐性化疗中,预防和治疗急性或迟发性恶心和呕吐带来更多选择手段,尤其针对迟发性恶心和呕吐将带来更好的治疗效果。
4.依维莫司片,是雷帕霉素的大环内酯类衍生物,是一种信号转导抑制剂(STI),早期国外批准用于预防移植术后器官排斥反应,近年来开发了抗肿瘤作用。本品的批准进口上市,将使现有治疗手段失败的晚期肾癌患者获得新的治疗机会和选择。
(三)内分泌系统用药
1.帕立骨化醇注射液,是一种合成的、选择性、第三代维生素D受体激活剂,用于预防和治疗与慢性肾病(现在指接受血液透析的慢性肾病患者)相关的继发性甲状旁腺功能亢进症,于20xx年9月在欧盟国家获得上市许可。目前我国尚无批准用于治疗该疾病的药品。批准本品的进口上市,将为我国该疾病患者提供一个新的有效治疗手段。
2.苯甲酸阿格列汀片,是用于2型糖尿病患者的血糖控制药品。批准本品的进口上市,可以为我国2型糖尿病患者提供更多的治疗用药选择。
3.利格列汀片,是用于2型糖尿病患者的血糖控制药品。批准本品进口上市和分包装,在我国用于“与二甲双胍和磺脲类药物联合使用,配合饮食控制和运动,用于成年2型糖尿病(T2DM)患者的血糖控制”,增加了我国2型糖尿病患者的治疗手段。
(四)循环系统用药
1.达比加群酯胶囊,为口服的直接凝血酶抑制剂前药,用于预防非瓣膜性房颤患者的卒中和全身性栓塞。本品具有不需要频繁抽血监测以及随之调整剂量的特点。批准本品进口和分包装,可为中国房颤患者防治卒中和全身血栓栓塞提供最新治疗手段。
2.曲前列尼尔注射液,是肺动脉高压治疗药物。肺动脉高压是一种预后很差的心血管疾病,为罕见病。目前已有的治疗药物存在半衰期短的问题,须通过放置在大静脉中的永久性导管,采用给药泵持续静脉输注,存在可能导致输注中断和血流感染等风险。本品稳定性较好,半衰期长,主要采用皮下持续输注方式给药,也可持续静脉输注给药,皮下给药途径相对较为安全,可减少严重感染败血症的风险。批准本品进口上市,可以让我国肺动脉高压患者获得最新治疗手段。
(五)生殖系统用药
醋酸加尼瑞克注射液,用于预防过早出现促黄体激素(LH)峰。不孕症在全世界的发病率达到9%,在体外受精与胚胎移植过程控制超排卵方案(COH)中使用促性腺激素释放激素(GnRH)激动剂降调节已被常规采用。本品为第三代GnRH拮抗剂,能通过与垂体前叶的GnRH受体的竞争性结合,快速而可逆地抑制体内促卵泡激素(FSH)和促黄体激素(LH)的释放。批准本品在我国的进口上市,为预防接受辅助生殖技术(ART)控制性超排卵(COH)方案的不孕症患者过早出现促黄体激素(LH)峰提供了最新的药物选择。
榆栀止血颗粒,用于排卵性功能失调性子宫出血所致的月经量多且中医辨证属于血热证者,可伴见口干心烦,尿赤便结,舌红、苔黄,脉滑数等。“功能失调性子宫出血”为中医具有传统治疗优势的适应症,目前西医药仍缺乏有效治疗药物。本品的批准上市,为该疾病的患者增加了新的治疗手段。
(六)消化系统用药
缓痛止泻软胶囊,用于肝郁脾虚所致的肠鸣腹痛、腹痛即泻、泻后痛缓,常因情志不畅而发或加重,脉弦、苔薄白;肠易激综合征(腹泻型)见上述证候者。该药处方来源于明代《景岳全书》中经典名方“痛泻要方”,经临床研究证明对于肠易激综合征(腹泻型)患者症状改善、疾病缓解具有确切的疗效,体现了中医药发展中继承与创新相结合的成果。该药品批准为肠易激综合征(腹泻型)患者增加了新的用药选择。
(七)眼科用药
康柏西普眼用注射液,是我国自主研发的、首个治疗年龄相关性黄斑变性的治疗用生物制品药物。随着我国老龄化步伐的加快,年龄相关性黄斑变性并导致失明的发病人数呈急速上升趋势。针对这种情况,采取特殊审批程序,对康柏西普眼用注射液进行了审评。这个产品的批准生产上市,为解决我国对此病症的临床用药可及性具有积极意义。
三、20xx年受理与审评情况
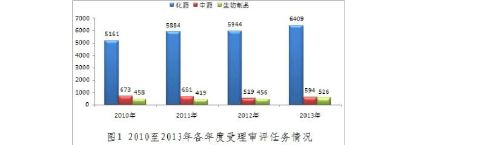
20xx年,药品审评中心全年受理新注册申请7529个(以受理号计,不含复审,下同)。与既往年度受理审评任务的比较情况见图1。
图1显示,各年度总体受理量在7000个左右波动,而近两年略有增加,其中化药受理量增加较为明显。几年来,化药的受理量基本保持在各年度受理总量的80%至85%。
20xx年,药品审评中心完成审评并呈送国家总局审批的审评任务4491个,其中批准2767个,不批准1384个,另有企业撤回和非中心审评任务340个。20xx年药品审评中心受理量和完成量比较相差3038个,主要集中在化学药品。
截止到20xx年底,国家总局已批准情况见表1、表2(不包括补充申请)。
表1 20xx年批准药品上市情况
表2 20xx年批准药物临床研究情况
以下,分别为本年度化药、中药和生物制品的年度受理和审评数据。
(一)20xx年化药受理和审评情况
1.化药新申请的受理情况
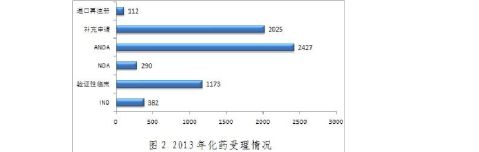
20xx年,化药各个序列受理情况如图2:
20xx年,化药新申请以受理号计共6409个。其中新药临床试验申请(IND)包括注册分类1、注册分类2和国际多中心临床试验申请;验证性临床为注册分类3和4的临床试验申请;新药生产上市申请(NDA)为完成临床试验后的生产上市申请;仿制及改剂型申请(ANDA)为注册分类5和6的生物等效试验申请和生产上市申请。
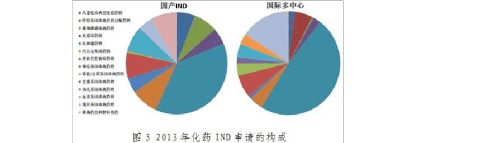
2.IND申请的治疗领域构成
无论国际多中心临床试验申请还是国内IND申请,比例最大的均为肿瘤治疗领域药物。
3.仿制药重复申报的情况
图4显示,20xx年新申报的ANDA申请共2427个(按受理号计)。已有批准文号20个以上的药品有1039个申请,占20xx年ANDA申报量的42.8%(20xx年为60.7%);已有批准文号10个以内的ANDA申请932个,占20xx年ANDA申报量的38.4%(20xx年为20.6%)。
4.审评完成情况
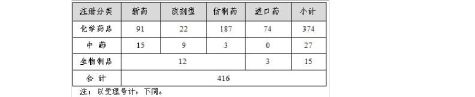
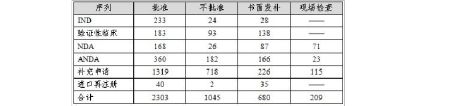
20xx年中心完成化药审评4237个(以受理号计,未计申请人撤回和非中心审评的200个申请,不计复审任务),具体情况见表3。
表3 20xx年化药审评完成情况
化药审评结束并送局审批的3348个品种中,不批准结论占31.2%,总体不批准率已连续四年保持在30%左右。
图5显示,IND和NDA两个通道的完成量相对平稳且稳中有升,其余各个通道20xx年较之2012

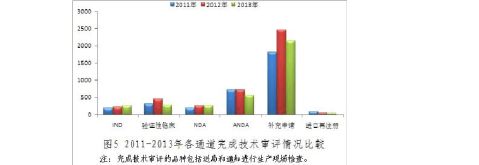
年均有
所下降。
5.审评时限情况
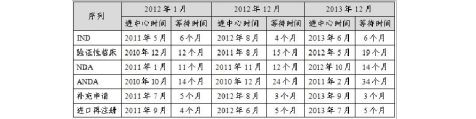
表4 化药各审评通道启动审评情况
表4显示,近三年来,IND、补充申请和进口再注册三个通道的审评等待时间相对平稳,而验证性临床、NDA、ANDA三个通道的审评等待时间在逐步延长,反映了此三类任务的积压现象。
(二)20xx年中药受理和审评情况
1.新申请的受理情况
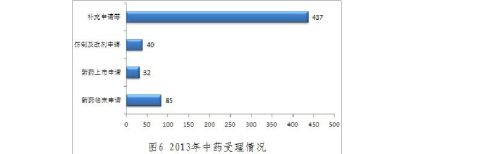
中药新申请共594个(以受理号计)。
2.审评完成情况
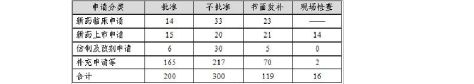
20xx年中心完成中药审评635个(以受理号计,未计申请人撤回和非中心审评的91个申请,不计复审任务),具体情况见表5。
表5 20xx年中药审评完成情况
3.审评时限情况
目前中药审评排队等待时间不是主要矛盾。
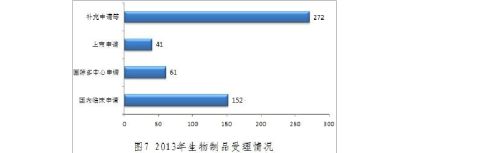
(三)20xx年生物制品受理和审评情况
1.新申请受理情况
生物制品新申请共526个(以受理号计)。
2.审评完成情况
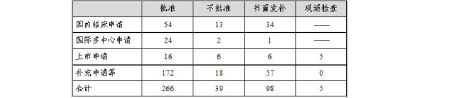
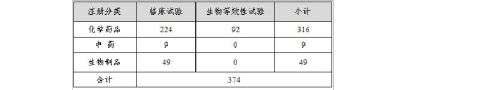
20xx年中心完成生物制品审评408个(以受理号计,未计申请人撤回和非中心审评的49个申请,不计复审任务),具体情况见表6。
表6 20xx年生物制品审评完成情况
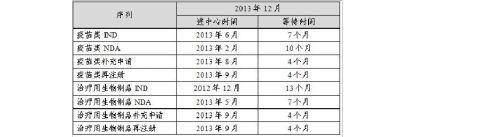
3.审评时限情况
表7 生物制品各审评通道启动审评情况
四、结语
在党的十八届三中全会精神指引下,在国家食品药品监督管理总局的坚强领导下,药品审评中心将继续认真履行职责,依法规、按程序、照标准开展药品技术审评工作,切实保护和促进公众健康。