第五章 氧化还原反应与电化学
教学内容
1. 氧化数;2.原电池与原电池电动势;3. 金属的腐蚀与防护;4.电解的基本原理及应用。
教学要求
了解氧化数的概念及确定方法;掌握原电池的组成、结构、符号表示、电极反应及电池反应的表示方法;了解电极电势的产生原因和测求方法;掌握浓度对电极电势的影响及Nernst方程的有关计算;了解电解池的结构特点;理解理论分解电压、实际分解电压的概念及产生原因;了解电解的应用;熟悉金属电化学腐蚀的产生原因及析氢腐蚀、吸氧腐蚀的主要特点;了解电化学腐蚀的主要防护方法。
知识点与考核点
1.氧化数
某元素的一个原子在化合状态时的形式电荷数(可以为分数)。
2.电对
同一元素氧化数高的状态(氧化态)与其氧化数低的状态(还原态)构成
一个电对。 通常表述为氧化态/还原态,例如,Cu2+/Cu、Zn2+/Zn、 Fe3+/Fe2+、Fe2+/Fe、O2/H2O2、H2O2/OH– 等。
3.原电池
借助氧化还原反应直接产生电流的装置。
4.原电池装置的符号表示:(以铜锌原电池为例)
(-)Zn | Zn2+(c1)|| Cu2+(c2)| Cu(+)
负极反应:Zn(s)→Zn2+(aq)+2e –
正极反应: Cu2+(aq)+2e–→Cu(s)
电池总反应: Cu2+(aq)+ Zn(s)= Cu(s) + Zn2+(aq)
5.原电池装置的符号表示书写规则
(1)负极在左侧,正极在右侧,
(2)两个半电池的中间用盐桥“||”连接,
(3)盐桥两侧分别是正、负极的离子“Zn2+(c1)||Cu2+(c2)”,溶液需标
出离子的浓度。
例:将下列氧化还原反应组成原电池,写出电极反应。
(1)Sn2+(aq)+2Fe3+(aq)= Sn4+(aq)+2Fe2+ (aq)
解:原电池符号表示式为
(-)Pt | Sn2+ (c1), Sn4+ (c2) || Fe3+ (c3), Fe2+ (c4) | Pt(+)
负极反应:Sn2+(aq) → Sn4+ (aq)+2e –
正极反应:2Fe3+(aq)+ 2e– →2Fe2+(aq)
说明:① 反应物中氧化剂的还原反应为正极反应,还原剂的氧化反应为负极反应。
② 没有金属作为电极,故选用不参与反应、只起导电作用的Pt或石墨等惰性电机作为辅助电极。
(2)2HCl(aq) + Zn(s)= H2(g)+ ZnCl2(aq)
解:原电池符号表示式为
(-)Zn| Zn2+ (c1) || H+ (c2) | H2(p),(Pt)(+)
正极反应:2H+(aq) + 2e – → H2 g)
负极反应:Zn(s)→ Zn2+(aq)+ 2e –
(3)2MnO–4(aq)+16H+(aq)+10Cl–(aq)+10Hg(l) = 2Mn2+(aq)+5Hg2Cl2(s) +8H2O
解:原电池符号表示式为
(-)Pt,Hg(l)| Hg2Cl2(s),Cl– (c1) || Mn2+ (c2), H+ (c3),MnO–4(c4)| Pt(+)
正极反应:2MnO–4(aq)+ 16H+(aq)+10e – = 2Mn2+(aq)+ 8H2O
负极反应:10Cl– (aq)+ 10Hg(l)= 5Hg2Cl2(s)+10e –
6.电极电势(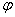 )的概念
)的概念
金属(或非金属)与溶液中自身离子达到平衡时双电层的电势差。每
个电对都有电极电势,电极电势是强度性质。
因电极电势的绝对值无法测得,为比较方便,人为规定标准氢电极的电极电势 
7.参比电极
作为对比参考的电极,其电极电势要求相对稳定。
例如甘汞电极: (Pt)Hg(l) | Hg2Cl2(s), KCl(c)
电极反应式为 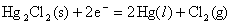
25℃, c(KCl)=1mol?L–1时,
25℃, c(KCl)为饱和浓度时,
8.原电池电动势
 (
(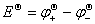 )
)
9.浓度(分压)对电极电势的影响(Nernst方程)
对电极反应 a氧化态 + ze– = b还原态
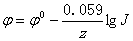 (298.15K)
(298.15K)
J 为半反应的“浓度商”,
z为反应转移的电子数。
例如: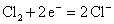
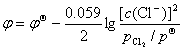
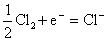

可以看出:Nernst方程表达式与化学方程书写方式有关,但是计算结果与方程书写方式无关,因同一反应写法不同,z 也不同。这也表现出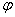 之强度性质的特性。
之强度性质的特性。
例:写出下列电池半反应的Nernst方程表达式
(1)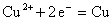 ;
;
答: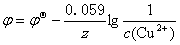
(2)MnO2 + 4H+ + 2e– = Mn2+ + 2H2O;
答: 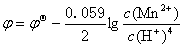
利用上式可求出不同c(H+)和c(Mn2+)时的电极电势值。
(3)参比甘汞电极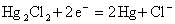 ;
;
答: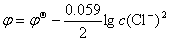 ;
;
例: 计算半反应 O2 + 2H2O + 4e– = 4OH– 的电极电势(25℃)
已知 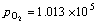 Pa,c(OH–) = 0.010mol·L–1,
Pa,c(OH–) = 0.010mol·L–1,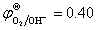 (V)
(V)
解 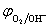 = 0.40 +
= 0.40 +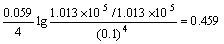 (V)
(V)
例: 求电对MnO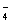 /Mn2+在下述条件下的电极电势(25℃),
/Mn2+在下述条件下的电极电势(25℃),
已知: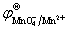 =1.51V,pH=2.0,c(Mn2+)=c(MnO
=1.51V,pH=2.0,c(Mn2+)=c(MnO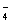 )=1.0 mol·L–1
)=1.0 mol·L–1
解 此电极反应为MnO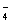 + 8H+ + 5e– = Mn2+ + 4H2O
+ 8H+ + 5e– = Mn2+ + 4H2O

= 1.51 + 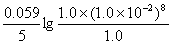 = 1.51 – 0.19 = 1.32(V)
= 1.51 – 0.19 = 1.32(V)
10.电极电势的应用
(1)判断氧化剂、还原剂的相对强弱
电极电势大的氧化态物质的氧化能力强;
电极电势小的还原态物质的还原能力强。
例如: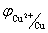 >
> 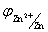 所以其氧化性Cu2+ > Zn2+ ; 还原性 Zn > Cu
所以其氧化性Cu2+ > Zn2+ ; 还原性 Zn > Cu
(2)判断氧化还原反应进行的方向
判据:电极电势大的氧化态和电极电势小的还原态能自发反应
∵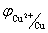 >
> 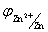 ∴自发反应为
∴自发反应为 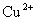 +
+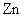 →
→ 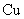 +
+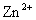
(3)判断氧化还原反应进行的程度
 (z为总反应转移的电子数)
(z为总反应转移的电子数)
例:(1)判断MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O在标准状态下反应自发进行的方向;
(2)判断c(HCl) =10 mol?L–1,c(Mn2+)=1.0mol?L–1,p(Cl2)=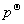 时的反
时的反
应方向;
(3)写出该条件下的电池符号,并求其反应的标准平衡常数。
解:(1)查表 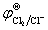 = 1.36 V >
= 1.36 V > 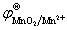 = 1.23 V
= 1.23 V
∴标准条件下反应自发向左进行
(2)用浓HCl(10mol·L–1)(其它物质的浓度或压强为标准态)
 =
= 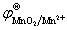 +
+
= 1.23 + 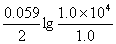 = 1.34 (V)
= 1.34 (V)
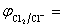
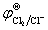 +
+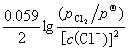
= 1.36 + 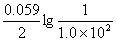 = 1.30(V)
= 1.30(V)
∵ >
>  ,∴反应自发向右进行,实验室可以用浓盐酸与二氧化锰反应制备氯气。
,∴反应自发向右进行,实验室可以用浓盐酸与二氧化锰反应制备氯气。
(3)原电池符号表示式为
(–)Pt,Cl2(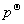 )|Cl–(10 mol?L–1)||Mn2+ (1mol?L–1),H+(10mol?L–1)|MnO2(s),Pt(+)
)|Cl–(10 mol?L–1)||Mn2+ (1mol?L–1),H+(10mol?L–1)|MnO2(s),Pt(+)
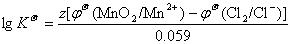
=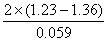
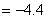 ;
;
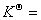
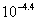 = 3.9×10–5 (其平衡常数很小,所以不能在标准状态下制取氯气)
= 3.9×10–5 (其平衡常数很小,所以不能在标准状态下制取氯气)
例:反应MnO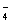 + 8H+ + 5Fe2+ = Mn2+ + 4H2O + 5Fe3+
+ 8H+ + 5Fe2+ = Mn2+ + 4H2O + 5Fe3+
(1)判断标准状态时,反应进行的方向。
(2)上述反应进行的限度(或 )。
)。
(3)用符号表示相应的原电池。
解 (1)查表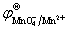 =1.51V,
=1.51V,  = 0.77V。
= 0.77V。
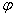 大的氧化态能与
大的氧化态能与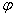 小的还原态自发反应, 所以标准状态下自发向右进行。
小的还原态自发反应, 所以标准状态下自发向右进行。
(2)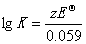 =
=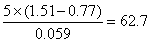 ; K值非常大,反应很完全。
; K值非常大,反应很完全。
(3)(–)Pt | Fe3+ (cΘ),Fe2+(cΘ)|| H+(cΘ),Mn2+(cΘ),MnO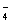 (cΘ) | Pt(+)
(cΘ) | Pt(+)
11.原电池电动势与吉布斯函数变
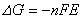 (
(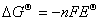 )
)
F(法拉第常数)= 96485C·mol–1,其意义是1mol 电子的电量。
例 :计算(–)Zn|Zn2+(1mol·L–1)||H+(1mol·L–1)|H2(100kPa)Pt (+)的吉布斯函数变(25℃)。
解: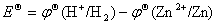
= 0 – (– 0.7618) = 0.7618(V)
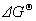 = –
= – 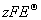 = –2×96485 C·mol–1 ×0.7618V–1
= –2×96485 C·mol–1 ×0.7618V–1
= –147004 (J·mol–1)
显见该反应的推动力较大。
12.化学腐蚀
金属与干燥气体或非电解质直接发生反应而引起的腐蚀。
13.电化学腐蚀
金属在水溶液或潮湿的空气中发生氧化还原反应引起的腐蚀。(腐蚀电流为
短路、杂散电流,不可利用)
14.析氢腐蚀
在酸性介质中,由阴极以反应 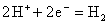 引起的腐蚀。 金属越活泼、酸性越强、湿度越大,金属的析氢腐蚀速度就越快。
引起的腐蚀。 金属越活泼、酸性越强、湿度越大,金属的析氢腐蚀速度就越快。
15.吸氧腐蚀
在中性或碱性介质中,由阴极以反应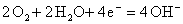 引起的腐蚀。
引起的腐蚀。
16.差异充气腐蚀
金属表面因氧气浓度分布不均匀而引起的电化学腐蚀,是吸氧腐蚀的一种。
17.牺牲阳极保护法
将较活泼的金属或合金与被保护的金属形成原电池,活泼金属作为电池的
阳极被腐蚀,而阴极“器件”则被保护。
18.外加电源保护法
将被保护的金属(阴极)与另一附加电极(阳极)形成原电池,在外电源
的作用下,阴极受到保护。
19.放电
得、失电子的过程。
20.电解池
将电能转变为化学能的装置。(例如,以惰性电极电解Na2SO4水溶液)
阳极:与外电源正极相连(发生氧化反应), 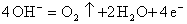
阴极:与外电源负极相连(发生还原反应), 
注意电解池与原电池的不同
(原电池:由氧化还原反应直接产生电流的装置 )
正极、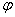 高、 发生还原反应;
高、 发生还原反应;
负极、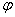 低、 发生氧化反应。
低、 发生氧化反应。
21.极化
电极电势偏离平衡电势的现象。
22.浓差极化
由于电极表面的放电速度大于溶液本体向电极表面扩散的速度,使得电极
附近的离子浓度与溶液本体浓度不同所引起的极化。
23.电化学极化
电解产物析出过程中的某个步骤的速度迟缓所引起的极化。
24.超电势
实际放电的电势与平衡电势之差。
阳极极化后使电极电势升高: 
阴极极化后使电极电势降低: 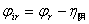
25.理论分解电压
在电解时,克服理论反向反向电动势所需的电压,用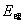 表示。
表示。
26.实际分解电压
使电解反应得以顺利进行的最低电压,用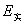 表示。
表示。
27.电解产物影响因素
(1)放电物质的标准电极电势;
(2)离子浓度;
(3)放电物质在电极上的超电势(金属离子的超电势较小,一般可以忽略,而生成气体时的超电势较大,应充分考虑)。
28.电解产物的规律
阳极发生氧化反应, 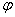 小的还原态物质容易被氧化,所以阳极先放电的是电极电势小的还原态物质;;
小的还原态物质容易被氧化,所以阳极先放电的是电极电势小的还原态物质;;
阴极发生还原反应, 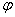 大的氧化态容易被还原,所以阴极先放电的是电极电势大的氧化态物质。
大的氧化态容易被还原,所以阴极先放电的是电极电势大的氧化态物质。
在实际应用此判据时,要考虑超电势。
一般分析:用惰性电极时,在阳极析出Cl2、O2, 阴极析出H2。
若阳极为可溶性(较活泼)金属,如Cu、Zn、Ni等时,则阳极溶解或腐蚀,而产生的金属离子如Cu2+、Zn2+、Ni2+等常移向阴极放电、形成电镀层。
29.法拉第(Faraday)电解定律
Q = n F; Q = It; 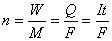 ;放电物质质量
;放电物质质量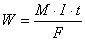
思考题与习题解答
1.下列说法是否正确?如不正确,请说明原因。
(1).氧化数就是某元素的一个原子在化合态时的电荷数。
答:不确切,氧化数是某元素的一个原子在化合态时的形式电荷数。
(2).所有参比电极的电极电势皆为零。
答:错,参比电极(也称为二级标准电极,例如甘汞电极等)的电极电势不为零。
(3).因为ΔrGm的值与化学反应计量方程式的写法(即参与反应物质的化学计量数)有关,因此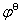 也是如此。
也是如此。
答:错,因电极电势的数值反映物种得失电子的倾向,这种性质应当与物质的
量无关,因此与电极反应式的写法无关。对电极反应:a氧化态 + z e– = b还原态
则有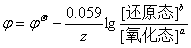 ;
;
如果电极反应为 na氧化态 + nze– = nb还原态,则有
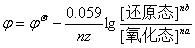 =
= 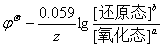 ,与上式相同。
,与上式相同。
而 是指氧化态与还原态的浓度或压强都为标准态时的
是指氧化态与还原态的浓度或压强都为标准态时的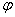 ,因此与电极反应
,因此与电极反应
方程式写法无关,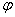 也是如此。
也是如此。
因ΔrGm = 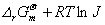 ,而
,而 ,所以ΔrGm与化
,所以ΔrGm与化
学计量数有关,故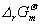 也是如此,与化学反应方程式写法有关。
也是如此,与化学反应方程式写法有关。
(4).插入水中的铁棒,易被腐蚀的部位是水面以下较深部位。
答:错,按差充气腐蚀理论,水面下的接近水线处的铁棒容易被腐蚀。
(5).凡是电极电势偏离平衡电极电势的现象,都称之为极化现象。
答:对。
2.选择题(将正确答案的标号填入空格内,正确答案可以不止一个)
(1)为了提高Fe2(SO4)3的氧化能力,可采用下列那些措施( )。
①.增加Fe3+的浓度,降低Fe2+的浓度;
②.增加Fe2+的浓度,降低Fe3+的浓度;
③.增加溶液的pH值;
④.降低溶液的pH值。
(1)的正确答案是①。
(2)极化的结果总是使( )。
①.正极的电势升高,负极的电势降低;
②.原电池的实际工作电压小于其电动势;
③.电解池的实际分解电压大于其理论分解电压。
(2)的正确答案是② ③。
3.试比较下列情况下铜电极电位的高低,并说明依据。
(1)铜在0.01mol·L–1CuSO4溶液中;
(2)铜在加有Na2S的0.01mol·L–1CuSO4溶液中。
解:电极电势与Cu2+ 的关系可表示为
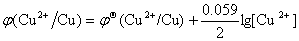 ,而S2—+Cu2+ = CuS↓,使c(Cu2+)降低,进而导致
,而S2—+Cu2+ = CuS↓,使c(Cu2+)降低,进而导致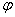 降低。所以(2)中的电极电势较低。
降低。所以(2)中的电极电势较低。
4.试说明下列现象产生的原因。
(1)硝酸能将铜氧化,而盐酸却不能;
答:因为 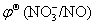 >
>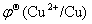 >
>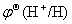 (
(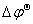 >0.2V)
>0.2V)
说明:由Nernst方程 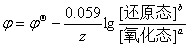 可以看出,浓度的影响在对数项中;影响不太大,一般情况下
可以看出,浓度的影响在对数项中;影响不太大,一般情况下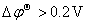 时即可以根据
时即可以根据
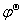 的相对大小判断反应方向。
的相对大小判断反应方向。
(2)Sn2+与Fe3+不能在同一溶液中共存;
答:因为 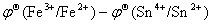 >0.2V,Fe3++Sn2+= Fe2++Sn4+,
>0.2V,Fe3++Sn2+= Fe2++Sn4+,
所以Sn2+与Fe3+不能在同一溶液中共存。
(3)氟不能用电解含氟化合物的水溶液制得。
答: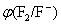 很高,氟的氧化性非常强,能将水分解,释放氧气,同时生成氟化氢。
很高,氟的氧化性非常强,能将水分解,释放氧气,同时生成氟化氢。
5.利用电极电势的概念解释下列现象。
(1)配好的Fe2+溶液要加入一些铁钉;
答:( ;
;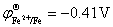 ;)因发生归一反应(歧化反应
;)因发生归一反应(歧化反应
的逆反应),即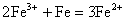 ,加入铁钉可以减缓Fe2+被氧化为Fe3+的速度,(即使加入铁钉也不能完全防止Fe2+被氧化为Fe3+)。
,加入铁钉可以减缓Fe2+被氧化为Fe3+的速度,(即使加入铁钉也不能完全防止Fe2+被氧化为Fe3+)。
(2)H2SO3溶液不易保存,只能在使用时临时配制;
答: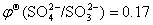 V,
V, 可以看出,
可以看出, 很容易被空气中的氧气所氧化,难以保存。
很容易被空气中的氧气所氧化,难以保存。
(3)海上船舰常镶嵌镁块、锌块或铝合金块,防止船壳体的腐蚀。
答:被镶嵌的镁、锌、铝合金都比较活泼,电势都较低,与船体相连后作为腐蚀电池的阳极被腐蚀,而将作为阴极的船体保护起来。
6.铜制水龙头与铁制水管接头处,哪个部位容易遭受腐蚀?这种腐蚀现象与钉入木头的铁钉的腐蚀在机理上有什么不同?试简要说明之。
答:铜与铁在水中能形成腐蚀原电池,铁作为阳极被腐蚀,铜为阴极促进了铁的腐蚀,发生析氢腐蚀或吸氧腐蚀,使其与铜接触的部位首先被腐蚀。而钉入木材的铁钉的腐蚀是差异充气腐蚀(??)。
7.填充题
(1)由标准氢电极和标准镍电极组成原电池,测得其电动势为 0.23V,则该原电池的正极为标准氢电极 ,负极为标准镍电极(查表) ,此电池的反应方向为 2H+ + Ni = H2 + Ni2+,镍电极的标准电极电势为–0.23 ,当c(Ni2+)降到0.01mol·L–1时,原电池电动势降低 。
答案为(标准氢电极)(负极为标准镍电极)(2H+ + Ni = H2 + Ni2+)(–0.23)
(降低)。
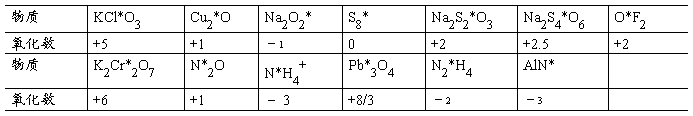
8.写出下列物质中元素符号右上角标 * 元素的氧化数。
KCl*O3 Cu2*O Na2O2* S8* Na2S2*O3 Na2S4*O6 O*F2 K2Cr2*O7
N2*O N*H Pb*3O4 N2*H4(肼) AlN*(氮化铝)
Pb*3O4 N2*H4(肼) AlN*(氮化铝)
答:
9.如果将下列氧化还原反应装配成电池,试用符号表示所组成的原电池。
(1)Zn(s)+ Ag+(aq) = Zn2+(aq)+ Ag(s)
(2)Cu(s)+FeCl3(aq) = CuCl(aq)+ FeCl2(aq)
(3)Sn2+(aq)+2Fe3+(aq) = Sn4+(aq)+ 2Fe2+(aq)
(4)Zn(s)+2HCl(aq) = ZnCl2(aq)+ H2(g)
(5)MnO4–(0.1mol·L–1)+8H+(10–4mol·L–1)+ 5Fe2+(0.1mol·L–1) =
Mn2+(0.1mol·L–1)+ 5Fe(0.1mol·L–1)+ 4H2O(l)
解:(1) (–) Zn | Zn2+ (C1) || Ag+ (C2) | Ag (+)
(2) (–) Cu | Cu+ (c1) || Fe3+ (c 2), Fe2+ (c 3) | Pt (+)
(3) (–) Pt | Sn2+ (c 1), Sn4+ (c 2) || Fe3+ (c 3), Fe2+ (c 4) | Pt (+)
(4) (–) Zn | Zn2+ (c 1) || H+ (c 2) | H2 (p),(Pt) (+)
(5) (–) Pt | Fe2+ (0.1 mol·L–1), Fe3+ ( 0.1mol·L–1) ||
MnO–4 (0.1mol·L–1), Mn2+ (0.1mo1·L–1), H+ (10–4 mo1·L–1) | Pt (+)
10.下列物质SnCl2、FeCl2、KI、Zn、H2、Mg、Al、HS– 在一定条件下都可以做还原剂。试根据标准电极电势数据,把这些物质按其还原能力递增顺序重新排列,并写出它们对应的氧化产物。
解:还原能力由低到高的排列顺序(氧化产物写在括号中)是:
FeCl2 (Fe3+), KI (I2), SnCl2 (Sn4+), H2 (H+),S2–(S),Zn (Zn2+), Al (Al3+),Mg (Mg2+)。
11..判断下列反应在标准态时进行的方向,如能正向进行,试估计进行的程度大小。
已知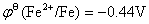
(1)Fe(s)+ 2Fe3+(aq) = 3Fe2+(aq)
(2)Sn4+(aq)+2Fe2+(aq) = Sn2+(aq)+ 2Fe3+(aq)
解:(1) 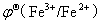 >
> 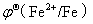 ∴反应正向进行。
∴反应正向进行。
1gK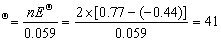
KΘ=1041 ; ∴反应进行程度很大。
(2)∵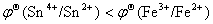 ; ∴反应逆向进行。
; ∴反应逆向进行。
12.在pH分别为3和6时,KMnO4能否氧化I–和Br– [假设MnO4–被还原成Mn2+,且c(MnO4–)= c(Mn2+)= c(I–)=c(Br–)=1mol·L–1]。
解: ① pH=3时,反应式为
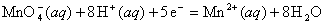
 (MnO4 / Mn2+) = 1.507+
(MnO4 / Mn2+) = 1.507+ 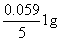
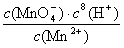
= 1.507 +
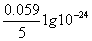 = 1.507 + 0.283 = 1.224V
= 1.507 + 0.283 = 1.224V
( 已知: (Br2 / Br–)=1.066V,
(Br2 / Br–)=1.066V,  (I2 / I– ) = 0.536V )
(I2 / I– ) = 0.536V )
∵1.224V >  ( Br2 / Br–) >
( Br2 / Br–) >  (I2 / I–); ∴可以氧化溴离子和碘离子。
(I2 / I–); ∴可以氧化溴离子和碘离子。
② pH = 6 中性应该还原成MnO2,
反应式为 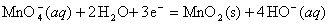
 (
( ) = 0.509 +
) = 0.509 + 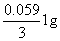

若设还原产物为Mn2+,可按①中的关系式算出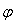 (MnO4 / Mn2+) = 0.941
(MnO4 / Mn2+) = 0.941
 (Br2 / Br– ) > 0.941 >
(Br2 / Br– ) > 0.941 >  (I2 / I– ) ∴可氧化碘离子,不能氧化溴离子。
(I2 / I– ) ∴可氧化碘离子,不能氧化溴离子。
13.今有一种含有Cl–、Br–、I–三种离子的混合溶液,欲使I–氧化成I2,又不使Br–、Cl–离子氧化,在常用氧化剂Fe2(SO4)3和KMnO4中应选哪一种?
解:查表: ( Br2 / Br–) =1.066V,
( Br2 / Br–) =1.066V,  ( I2 / I–)=0.535V,
( I2 / I–)=0.535V,
 (C12 / C1–)=1.358V;
(C12 / C1–)=1.358V;  (Fe3+/ Fe2+) = 0.77V,
(Fe3+/ Fe2+) = 0.77V,
 (MnO4– / Mn2+) = 1.507V; ∵
(MnO4– / Mn2+) = 1.507V; ∵ (MnO4 / Mn2+) >
(MnO4 / Mn2+) >  (C12 / C1–) >
(C12 / C1–) >  (Br2 / Br –) >
(Br2 / Br –) >  (Fe3+/ Fe2+) >
(Fe3+/ Fe2+) > 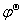 (I2 / I–), ∴标态下, 只能选用硫酸铁。
(I2 / I–), ∴标态下, 只能选用硫酸铁。
14.由标准钴电极和标准氯电极组成原电池,测得其电动势为1.63V,此时钴为负极,现知氯的标准电极电势为+1.36V,问:
(1)此电池的反应方向?
(2)钴的电极电势为多少?
(3)当氯气的分压增大时,电池电动势将如何变化?
(4)当c(Co2+)降到0.01mol·L–1时,通过计算说明电动势又将如何变化?
解:(1)电池总反应:Co + C12 = Co2+ + 2C1–
∵E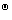 =1.63V > 0 ∴正向进行。
=1.63V > 0 ∴正向进行。
(2)E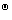 =
=  (C12 / C1– ) –
(C12 / C1– ) – (Co2+ / Co)
(Co2+ / Co)
 (Co2+ / Co) = 1.36 ― 1.63 = – 0.27 V
(Co2+ / Co) = 1.36 ― 1.63 = – 0.27 V
(3) 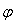 (C12 / C1– )=
(C12 / C1– )= (C12 / C1– ) +
(C12 / C1– ) + 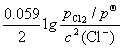
E =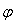 (C12 / C1– ) ―
(C12 / C1– ) ―  (Co2+ / Co)
(Co2+ / Co)
∴若氯气分压增大,则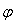 (C12 / C1– )增加, 电动势将增大。
(C12 / C1– )增加, 电动势将增大。
(4)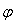 (Co2+ / Co) =
(Co2+ / Co) =  (Co2+ / Co) +
(Co2+ / Co) + 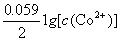
= – 0.27 + 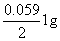 0.01 = 0.329 V,
0.01 = 0.329 V,
若c (Co2+)降低,则 (Co2+ / Co)降低, ∴ 电动势升高。
(Co2+ / Co)降低, ∴ 电动势升高。
15.由两个氢半电池
Pt,H2(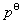 )∣H+(0.1mol·L–1)和Pt,H2(
)∣H+(0.1mol·L–1)和Pt,H2(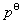 )∣H+(xmol·L–1)组成一原电池,测得该原电池的电动势为0.016V,若Pt,H2(
)∣H+(xmol·L–1)组成一原电池,测得该原电池的电动势为0.016V,若Pt,H2(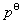 )∣H+(xmol·L–1)作为该原电池的正极,问组成该半电池的溶液中H+浓度是多少?
)∣H+(xmol·L–1)作为该原电池的正极,问组成该半电池的溶液中H+浓度是多少?
解: E = 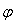 (H+ / H2)正 –
(H+ / H2)正 – 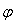 (H+ / H2)负
(H+ / H2)负
0.016=[ (H+/H2)+
(H+/H2)+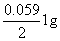 c2(H+)]正―[
c2(H+)]正―[ (H+/H2)+
(H+/H2)+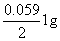 c2(H+)]负
c2(H+)]负
0.016 = 0 + 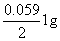 0.12 – 0 +
0.12 – 0 + 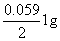 c2(H+)
c2(H+)
―0.043 = 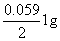 c2(H+)
c2(H+)
1g c (H+) = 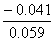 = ―0.729 ;
= ―0.729 ;
c (H+) = 0.187 mol·L–1
16.根据下列反应(假设离子浓度均为1mol·L–1)
Ni(s)+ Sn2+(aq) = Ni2+(aq)+ Sn(s)
Cl2(g)+2Br–(aq) = Br2(g)+ 2Cl–(aq)
试分别计算:
(1)它们组成原电池的电动势,并指出正负极;
(2)25℃时的平衡常数;
(3)反应的标准吉布斯函数变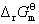 。
。
解:(1)反应方程式: Ni(s) + Sn2+ (aq) = Ni2+ (aq) + Sn(s)
E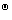 =
= (Sn2+ / Sn) ―
(Sn2+ / Sn) ― ( Ni2+ / Ni) = ―0.1375 ―(― 0.257) = 0.1195 (V) > 0
( Ni2+ / Ni) = ―0.1375 ―(― 0.257) = 0.1195 (V) > 0
∴ 锡电极为正极:镍电极为负极。
1gK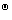 =
=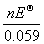 =
= = 4.05 K
= 4.05 K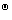 =1.122×104
=1.122×104
ΔrGm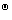 = ―RT InK
= ―RT InK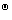 = ―8.314×10 – 3×298×In(1.122×104) = ―23.1 kJ?mol–1
= ―8.314×10 – 3×298×In(1.122×104) = ―23.1 kJ?mol–1
(2)反应方程式:C12 + 2Br– = Br2 + 2C1–
E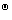 =
= (C12 / C1–) ―
(C12 / C1–) ―  (Br2 / Br– ) = 1.358 ― 1.066 = 0.292 (V)
(Br2 / Br– ) = 1.358 ― 1.066 = 0.292 (V)
∴正极:(Pt)C12, 负极:(Pt)Br2
1gK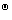 =
=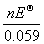 =
=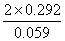 = 9.90
= 9.90
K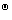 = 7.9×10 9
= 7.9×10 9
ΔrGm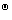 = – RTInK
= – RTInK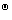 = –8.314 ×10– 3× 298× In (7.9×10 9) = – 56.5 kJ?mol—1
= –8.314 ×10– 3× 298× In (7.9×10 9) = – 56.5 kJ?mol—1
17.对于由电对MnO–4/Mn2+与Zn2+/Zn组成的原电池
(1)计算298K下,当c(MnO–4) = c(Mn2+) = c(Zn2+) =1mol·L–1,c(H+) = 0.1mol·L–1时,该电池的电动势,该氧化还原反应的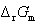 ,并说明该氧化还原反应进行的方向。
,并说明该氧化还原反应进行的方向。
(2)求该氧化还原反应在298K时的lgK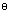
 。
。
(3)当温度升高时,该反应的K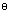 是增大还是减小?为什么?
是增大还是减小?为什么?
解;(1)反应方程式:
2MnO4–(aq)+16H+(aq)+5Zn(s)=5Zn2+(aq)+2Mn2+(aq)+8H2O(l)
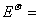
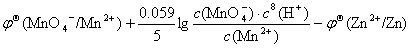
=1.507+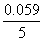 lg (0.1)8 ―(―0.7618) = 2.1744V
lg (0.1)8 ―(―0.7618) = 2.1744V
△rGm = ―nFE= ―10×96485×2.1744 = – 20## kJ·mol—1反应正向进行
(2) 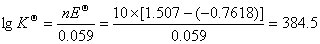 ;
;
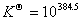
(3) 
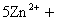
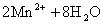
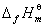 /(kJ?mol–1)–541 0 0 –153.9 –220.8 –285.8
/(kJ?mol–1)–541 0 0 –153.9 –220.8 –285.8
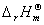
 <0放热
<0放热
(也可以根据△rGm = ―2099 kJ·mol—1 << 0, 推论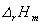 <0
<0
∵ 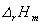 <0, 是放热反应, ∴ T升高时, K减小。
<0, 是放热反应, ∴ T升高时, K减小。
