有机酸摩尔质量的测定
伍登磴
一、 实验目的
1 . 学习有机酸摩尔质量的测定方法;
2 . 熟悉微量滴定操作;
3 . 了解基准物质KHP性质及应用。
二、 实验原理
1 . 大多数有机酸是弱酸,在水中有一定溶解性;
2 . 若浓度0.1mol/L左右且cKa≥10-8 ,可用烧碱液滴定,滴定突跃范围弱碱性,选用酚酞指示剂,滴定终点为溶液显微红色;
3 . 多元酸应根据每级能否准确滴定及相邻两级能否分级滴定判别式判断计量关系;
4 . KHP纯度高、稳定、不吸水、摩尔质量大,干燥温度过高会脱水,可作为基准物质标定烧碱液。
三、 试剂仪器
1 . 约0.1mol/L烧碱液;
2 . 100~125℃干燥后KHP;
3 . 2g/L酚酞乙醇溶液;
4 . 有机酸试剂;
5 . 常量滴定用仪器(50.00mL滴定管、25.00mL移液管、250mL容量瓶、250mL锥形瓶);
6 . 微型滴定用仪器(3.000mL滴定管、2.00mL移液管、50.00mL容量瓶、25mL锥形瓶)。
四、实验步骤
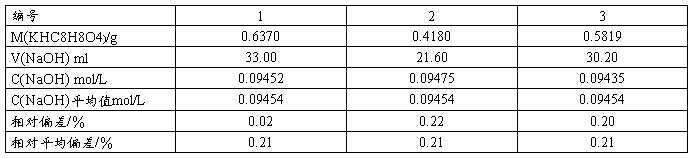
1 . NaOH溶液的标定(常量法)
差减法称取KHP于250mL锥形瓶,加约50mL水溶解,加入2滴酚酞,用烧碱液滴定至溶液显微红色且30s不退色,记录所用KHP质量及烧碱液体积。
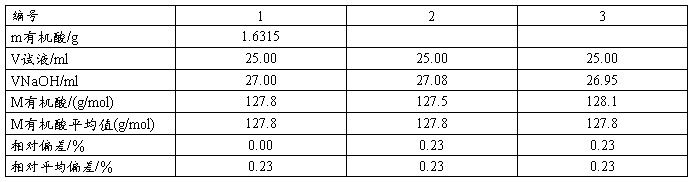
2 . 有机酸摩尔质量的测定(常量法)
准确称取有机酸样品于干燥小烧杯加水溶解,定量转入250mL容量瓶,定容。用25.00mL移液管平行移取三份,分别放入250mL锥形瓶,加2滴酚酞,用烧碱液滴定至溶液刚好变粉红色且30s不退色,记录所用有机酸及烧碱液体积。
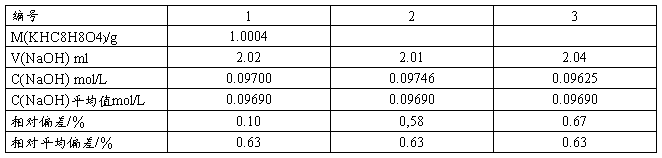
3 . NaOH溶液的标定(微型滴定)
准确称取KHP于干燥烧杯加水溶解,定量转入50mL容量瓶,定容。用2.00mL移液管平行移取三份,分别放入25mL锥形瓶,加1滴酚酞,用烧碱液滴定至溶液显微红色且30s不退色,记录所用KHP质量及烧碱液体积。
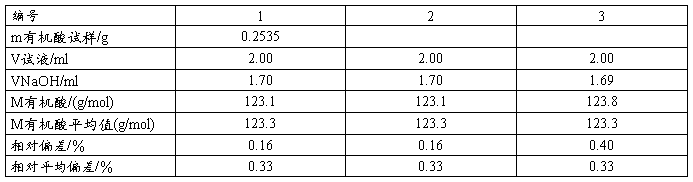
4 . 有机酸摩尔质量的测定(微型滴定)
准确称取有机酸样品于干燥小烧杯加水溶解,定量转入50mL容量瓶,定容。用2.00mL移液管平行移取三份,分别放入25mL锥形瓶,加1滴酚酞,用烧碱液滴定至溶液刚好变粉红色且30s不退色,记录所用有机酸及烧碱液体积。
五、数据记录
1 . NaOH溶液的标定(常量法)
2 . 有机酸摩尔质量的测定(常量法)
3 . NaOH溶液的标定(微型滴定)
4 . 有机酸摩尔质量的测定(微型滴定)
六、问题与讨论
1.为什么微型滴定的误差要远高于常量滴定?
在微型滴定中整个体系中的溶液体积非常小,然而我们所加的酚酞指示剂又很多(1滴相对于常量滴定来说很多了),在滴定终点附近,很少量的碱液(1滴或者半滴)就可以使溶液发生突变,而指示剂显示的颜色又非常深,这让我们不好判断,这就增大了误差。还有就是微型滴定管的使用,这种微型滴定管是酸管类型,放液不如碱管可以灵活控制,尤其在装上毛细管时,可能会发生延迟效应(比如说你提前关闭滴定管或者调小了液滴下落速率,在有一段时间内,液体依旧会按照原来的下落速率下落一段时间之后停止或减速下落),这对我们在滴定过程中造成了很大的影响,让我们很容易错过终点,之后只能重新再次进行滴定,这不仅浪费了我们的时间,也增大了实验的误差。
2.在使用微型滴定管时,若出现气泡,该如何处理?
在润洗过程中,若出现气泡,则应该用洗耳球将溶液吸至滴定管顶部的圆形小玻璃球中,确认气泡被除去后缓缓放液,再次润洗。在滴定过程中,若发现有气泡混入,则应该立即停止滴定,重新用碱液润洗滴定管并除去气泡。若不除去,则会对溶液体积产生影响,直接影响本次滴定的准确度。
3.能否设计一种微型的碱式滴定管进行此类微型滴定?
理论上是可以的,此类微型碱式滴定管完全可以模仿常量的碱式滴定管,只不过要把滴定管管径做细,再套一个橡胶管,橡胶管中装一个合适的玻璃珠,然后再在尖嘴处同样套上聚四氟乙烯的微型滴定尖嘴,使用时同常量碱式滴定管,通过控制玻璃珠来控制滴定速率,此类滴定管相较于微型酸式滴定管更加好操作并且容易控制滴定反应的进行,相对误差更小。
第二篇:实验八 凝固点降低法测定摩尔质量
实验八 凝固点降低法测定摩尔质量
一、实验目的
1. 用凝固点降低法测定萘的摩尔质量。
2. 掌握溶液凝固点的测量技术,加深对稀溶液依数性质的理解。
二、实验原理
当稀溶液凝固析出纯固体溶剂时,则溶液的凝固点低于纯溶剂的凝固点,其降低值与溶液的质量摩尔浓度成正比。即
ΔT=Tf* -Tf = Kf mB (1)
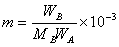
式中,MB为溶质的分子量。将该式代入(1)式,整理得:
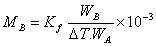 (2)
(2)
若已知某溶剂的凝固点降低常数Kf值,通过实验测定此溶液的凝固点降低值ΔT,即可计算溶质的分子量MB。通常测凝固点的方法是将溶液逐渐冷却,但冷却到凝固点,并不析出晶体,往往成为过冷溶液。然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升,当放热与散热达到平衡时,温度不再改变。此固液两相共存的平衡温度即为溶液的凝固点。
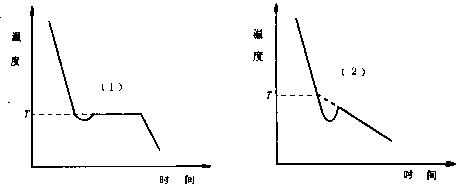
图1. 溶剂(1)与溶液(2)的冷却曲线
三、仪器药品
1. 仪器
凝固点测定仪1套; 烧杯2个;精密温差测量仪1台;放大镜1个;普通温度计(0℃~50℃)1支;压片机1台;移液管(25mL)1支。
 2. 药品
2. 药品
环已烷(或苯),萘,粗盐,冰。
四、实验步骤
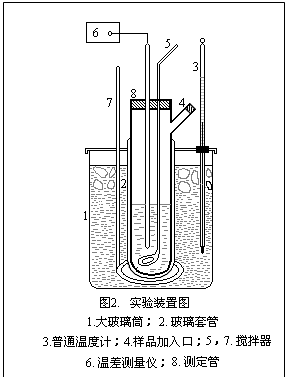
1.按图2所示安装凝固点测定仪,注意测定管、搅拌棒都须清洁、干燥,温差测量仪的探头,温度计都须与搅拌棒有一定空隙。防止搅拌时发生摩擦。
2. 调节寒剂的温度,使其低于溶剂凝固点温度2~3℃,并应经常搅拌,不断加入碎冰,使冰浴温度保持基本不变。
3. 调节温差测量仪,使探头在测量管中时,数字显示为“0”左右。
4. 准确移取25.00mL溶剂,小心加入测定管中,塞紧软木塞,防止溶剂挥发,记下溶剂的温度值。取出测定管,直接放入冰浴中,不断移动搅拌棒,使溶剂逐步冷却。当刚有固体析出时,迅速取出测定管,擦干管外冰水,插入空气套管中,缓慢均匀搅拌,观察精密温差测量仪的数显值,直至温度稳定,即为苯的凝固点参考温度。取出测定管,用手温热,同时搅拌,使管中固体完全熔化,再将测定管直接插入冰浴中,缓慢搅拌,使溶剂迅速冷却,当温度降至高于凝固点参考温度0.5℃时,迅速取出测定管,擦干,放入空气套管中,每秒搅拌一次,使溶剂温度均匀下降,当温度低于凝固点参考温度时,应迅速搅拌(防止过冷超过0.5℃),促使固体析出,温度开始上升,搅拌减慢,注意观察温差测量仪的数字变化,直至稳定,此即为溶剂的凝固点。重复测量三次。要求溶剂凝固点的绝对平均误差小于±0.003℃。
5. 溶液凝固点的测定,取出测定管,使管中的溶剂熔化,从测定管的支管中加入事先压成片状的0.2~0.3g的萘,待溶解后,用上述方法测定溶液的凝固点。先测凝固点的参考温度,再精确测之。溶液凝固点是取过冷后温度回升所达到的最高温度,重复三次,要求凝固点的绝对平均误差小于±0.003℃。
五、注意事项
1. 搅拌速度的控制是做好本实验的关键,每次测定应按要求的速度搅拌,并且测溶剂与溶液凝固点时搅拌条件要完全一致。
2. 寒剂温度对实验结果也有很大影响,过高会导致冷却太慢,过低则易出现过冷现象而测不出正确的凝固点。
3. 测定凝固点温度时,注意防止过冷温度超过0.5℃,为了减少过冷度,可加入少量溶剂的微小晶种,前后加入晶种大小应尽量一致。
六、数据记录及处理
表1. 凝固点降低法测定摩尔质量的实验数据 溶剂温度t=21.06℃

ρ环已烷(g·cm-3)=0.7971-0.8879×10-3t=0.7971-0.8879×10-3×21.06=0.7784g·cm-3
WA=ρAVA=25.00×0.7784=19.46g
萘的摩尔质量MB:128.17 g·mol-1(理论值)
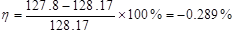 相对误差:
相对误差:
表1. 凝固点降低法测定摩尔质量的实验数据 溶剂温度t=26.96℃
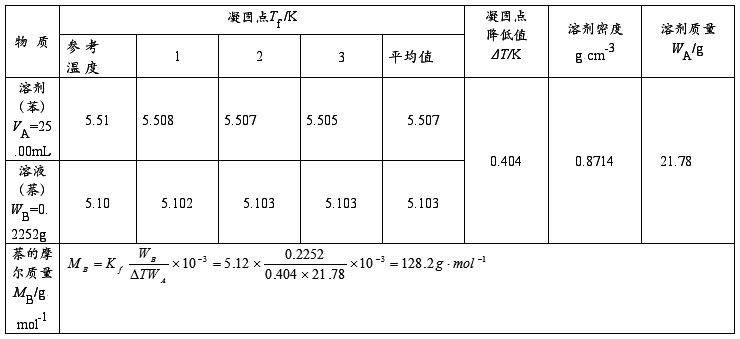
ρ苯(g·cm-3)=0.90005-1.0638×10-3t=0.90005-1.0638×10-3×26.96=0.8714g·cm-3
WA=ρAVA=25.00×0.8714=21.78g
萘的摩尔质量MB:128.17 g·mol-1(理论值)
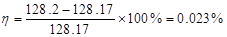 相对误差:
相对误差:
七、思考题
1. 为什么要先测近似凝固点?
答:主要是为了控制过冷程度。当温度冷却至凝固点时要通过急速搅拌,防止过冷超过要求,促使晶体析出。
2. 根据什么原则考虑加入溶质的量?太多或太少影响如何?
答:溶质的加入量应控制在凝固点降低0.3℃左右。过多,溶液的凝固点降低太多,析出溶剂晶体后,溶液的浓度变化大,凝固点也随之降低,不易准确测定其凝固点。过少,溶液的凝固点降低少,相对测定误差也大。
3. 为什么测定溶剂的凝固点时,过冷程度大一些对测定结果影响不大,而测定溶液凝固点时却必须尽量减少过冷现象?
答:对于纯溶剂,过冷现象存在时,析出大量晶体并不改变溶剂浓度,所以其凝固点不变。对于溶液,过冷现象存在时,析出大量晶体会改变溶液浓度,而溶液的凝固点随浓度增大而下降,所以溶液要尽量减少过冷现象,保持溶液浓度基本不变。
