标准曲线制作—考马斯亮蓝法测蛋白质含量
一、标准曲线
一般用分光光度法测物质的含量,先要制作标准曲线,然后根据标准曲线查出所测物质的含量。因此,制作标准曲线是生物检测分析的一项基本技术。
二、蛋白质含量测定方法
1、凯氏定氮法
2、双缩脲法
3、Folin-酚试剂法
4、紫外吸收法
5、考马斯亮蓝法
三、考马斯亮蓝法测定蛋白质含量—标准曲线制作
(一)、试剂:
1、考马斯亮蓝试剂:
考马斯亮蓝G—250 100mg溶于50ml 95%乙醇,加入100ml 85% H3PO4,雍蒸馏水稀释至1000ml,滤纸过滤。最终试剂中含0.01%(W/V)考马斯亮蓝G—250,4.7%(W/V)乙醇,8.5%(W/V)H3PO4。
2、标准蛋白质溶液:
纯的牛血清血蛋白,预先经微量凯氏定氮法测定蛋白氮含量,根据其纯度同0.15mol/LNaCl配制成100ug/ml蛋白溶液。
(二)、器材:
1、722S型分光光度计使用及原理()。
2、移液管使用()。
(三)、标准曲线制作:
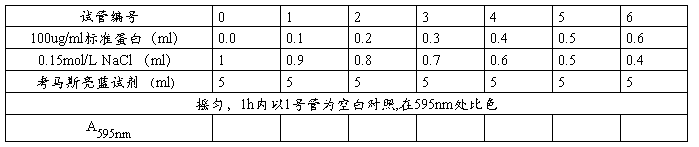
1、
2、以A595nm为纵坐标,标准蛋白含量为横坐标(六个点为10ug、20 ug、30 ug、40 ug、50 ug、60 ug),在坐标轴上绘制标准曲线。
1)、利用标准曲线查出回归方程。
2)、用公式计算回归方程。
3)、或用origin作图 ,测出回归线性方程。即A595nm=a×X( )+6
一般相关系数应过0.999以上,至少2个9以上。
4)、绘图时近两使点在一条直线上,在直线上的点应该在直线两侧。
(四)、蛋白质含量的测定:
样品即所测蛋白质含量样品(含量应处理在所测范围内),依照操作步骤1操作,测出样品的A595nm,然后利用标准曲线或回归方程求出样品蛋白质含量。
一般被测样品的A595nm值在0.1—0.05之间,所以上述样品如果A595nm值太大,可以稀释后再测A595nm值,然后再计算。
(五)、注意事项:
1、玻璃仪器要洗涤干净。
2、取量要准确。
3、玻璃仪器要干燥,避免温度变化。
4、对照:用被测物质以外的物质作空白对照。
药品的配制(磷酸缓冲液的配制)
一、药品的配制步骤
(一)、实验准备:
1、 准备所需的药品和玻璃仪器。
2、 洗涤。(怎样洗涤算干净?)
(二)、计算:
1、百分比浓度计算:
1)、G/V比
例如配1% NaCl,称1g NaCl溶于100ml 水。
2)、V/V比:
例如配75%乙醇100ml,75%×100%=100%×X, X=75ml。取75ml无水乙醇,加25ml蒸馏水。
乙醇:乙醚:丙酮=2:1:2配500ml,各取200 ml,100 ml,200 ml混合。
3)G/V比:用的较少,如计算灰分中某种元素如Fe的含量。
2、摩尔浓度计算:注:药品的分子量一般在标签中注明。
1)、0.1M或0.1mol/L NaCl配100ml。
M=质量/体积(L)称取NaCl0.1×0.1×40=0.4g 摩尔数=G(g)/摩尔质量
2)、0.1mMNaCl配100ml
mM=毫摩尔数/体积(L) 称取NaCl0.1×0.1×40=0.4g
毫摩尔数=G(mg)/摩尔质量
3)、0.1uNaCl配100ml
mM=微摩尔数/体积(L) 称取NaCl0.1×0.1×40=0.4mg
微摩尔数=G(ug)/摩尔质量 称取NaCl0.1×0.1×40=0.4ug
3、 混合溶液配制的计算:
如配3uMEDTA,2.25mM NBT以及60uM 溶液100ml,用50mM磷酸缓冲液配制。
注意:1、分别标定体积计算
2、分别配制再混合,但总体积不能 为100ml
(三)、标量:
1、根据需要选择不同量程的天平根据要求去不同精度的测量器,如量筒或移液管。
2、电子分析天平的使用。
(四)、溶解:
1、根据药品配置要求选择溶剂。蒸馏水,双蒸水,无离子水等。
2、只能用烧杯溶解。注意加入溶剂只能加入总体积的2/3左右,剩余溶剂洗涤烧杯三次左右,直到洗涤干净。
小常识:药品标签中一般标识有药品的溶解性能和分子式,可根据分子式和所学的常识判断药品的结构和性质特点(包括溶解性质)。
如酸碱两性物质的配制(AA、蛋白质、核苷酸等)如果溶解性能不好可以用稀酸或稀碱促进溶解,但pH应在被要求的范围内。
3、加热促进溶解,但注意应在配制的范围内有的药品还需水溶加热较好。如:配0.1%的淀粉,水裕加热(温度在80-90。C),过量会糊化。
(五)、定容:
1、用容量瓶定容;
2、用玻璃棒引流或用小漏斗;
3、用溶剂加入到接近刻度,然后用滴管加入到刻度。要求刻度与液体凹面相切为止(眼睛可视);
4、上下窑洞容量瓶几次,混合均匀即可。(注意不再定容了,防止溶液漏掉。)
(六)、装入试剂瓶,贴上标签。
标签应注明以下内容:药品浓度、名称、配制人、配制日期等。
(七)、清理实验场所。
二、磷酸缓冲液的配制。
(一)、配制0.2mol/L即0.2M pH=6.8的磷酸缓冲液。用磷酸氢二钠—磷酸二氢钠做缓冲液。
选用药品:Na2HPO4·12H2O(碱)和NaH2PO4·12H2O(酸)配缓冲液100ml。书中说明。
(二)、计算 :
1、注:书中有注明配置的量。
2、计算:Na2HPO4·12H2O称取71.64×0.1=7.164g
NaH2PO4·12H2O称取 31.21×0.1=3.121g
3、含有不同结晶水的换算。
书中配1/15mol/L的缓冲液配1L,书中用Na2HPO4·2H2O需要11.87g/L但用Na2HPO4·12H2O需多少g?
11.87=(178/358)×X,X=23.87g。
(三)、分别配制缓冲液各100ml(根据需要确定配制的量)。
即:0.2M Na2HPO4·2H2O和NaH2PO4·2H2O100ml。
(四)、按书中的量配制取量再混合。
如:pH=6.8,分别去缓冲对49ml和51ml。
(五)、用pH试纸ceni索赔的缓冲液的pH值,检测配置是否准确。
(六)如配50mM pH =6.8的缓冲液100ml ,以你配制的母液稀释即可。
计算:50×0.1=0.2×1000×X (L);X =0.025L;
取0.2M pH=7.2的缓冲液25ml,用蒸馏水定容至100ml即可。
第二篇:实验二 考马斯亮蓝法测定蛋白质含量
实验二 考马斯亮蓝法(Bradford法)测定蛋白质含量
一、目的与要求
1. 掌握考马斯亮蓝染色法定量测定蛋白质含量的原理与方法
2. 熟练分光光度计的使用和操作方法。
二、实验原理
考马斯亮蓝G250测定蛋白质含量属于染料结合法的一种,它与蛋白质的疏水微区相结合,这种结合具有高敏感性。它在酸性溶液中呈棕红色,最大光吸收峰在465nm,当它与蛋白质结合形成复合物时,其最大吸收峰改变为595nm。考马斯亮蓝G-250—蛋白质复合物呈蓝色,在一定范围内,595nm下光密度与蛋白质含量呈线性关系,故可以用于蛋白质含量的测定。
考马斯亮蓝结合法是近年来发展起来的蛋白质定量测定法,本方法具有操作方便、快速、干扰因素少的特点。
附:
(一)、分光光度法原理:
光的吸收定律(朗伯-比尔定律):一束单色光(强度为I0)通过某吸光物质的溶液时,其光能量的被吸收与该物质浓度的关系符合朗伯—比尔定律即当入射光波长、温度和溶液的厚度一定时,吸光度与溶液的浓度成正比。
用公式表示为:T = I/I0 则 A = lg(1/T) =Kbc
式中 T — 透光率 I — 透过光强度 I0 — 入射光强度 A — 吸光度 K — 比例常数 b — 溶液的厚度 c — 溶液的浓度
(二)、离心机的使用说明:
1.要离心的离心管和管套要称重,重量不等时将水加在管套里。
2.离心管的放置是对角线放置,要求必须对称。
3. 先将离心机转速旋钮恢复到零刻度后,再定时间,定好时间后缓慢旋转转速旋钮,使离心机均匀的提速到预定转速。
(三)、分光光度计的使用说明:
1.接通电源开关,预热20min后,再选择须用的单色光波长。
2.放入已加入溶液的比色皿,盖上样品室盖,推动试样架拉手,使对照比色皿(溶液装入4/5高度,置第一格)置于光路上,调节100%透射比按钮,使吸光度值A=0.00。
3.推动试样架拉手,使样品比色皿置于光路上,读出吸光度值。
4.测量完毕,取出比色皿,洗净后置于乙醇溶液中浸泡脱色。
5.电源开关置于“关”,拔下电源插头。
三、试剂与器材
试剂:
1、0.9%NaCl 9g NaCl溶解在1L的容量瓶中。
2、标准蛋白质:称取50mg结晶牛血清蛋白定溶于50ml容量瓶里。
3、染液:考马斯亮蓝G-250 0.5g,溶于250mL95%乙醇,再加入500mL85%(W/V)磷酸,保存于棕色瓶中,称为母液。取150 mL然后加蒸馏水定容到1000mL,保存于棕色瓶中,备用。
器材:
试管;吸管10mL、l5mL、lmL、0.1mL;721分光光度计 四、操作方法
标准比较法测定样品提取液中蛋白质的含量
1.待测样品制备:称取新鲜豆芽2根,取其下胚轴,称重后放入研钵中,加5mL蒸馏水研磨成匀浆,转移到离心管中,再用5mL蒸馏水分两次次洗涤研钵,洗涤液收集于同一离心管中,然后在2000r/min离心5min,弃去沉淀,上清液转入10mL离心管中,并以蒸馏水定容至刻度,即得待测样品提取液。
2.取三只试管按照下表操作:
样品提取液(mL) 标准蛋白质(mL) 0.9%生理盐水(mL) 考马斯亮蓝(mL)
A595 3.结果计算
U待测管 0.1 0 0 3 放置5min
S 标准管
0 0.1 0 3 放置5min
B对照管
0 0 0.1 3 放置5min 调零
样品蛋白质含量(μg/g)= AU×结晶牛血清蛋白的含量(μg/ml)×提取液总体积(ml)
/AS×测定所须提取液体积(ml)×样品鲜重(g)
要点提示:
1.Bradford法由于染色方法简单迅速,干扰物质少,灵敏度高,现已广泛应用于蛋白质含量的测定。
2.有些阳离子,如K+ 、Na+ 、Mg2+ 、(NH4)2SO4、乙醇等物质不干扰测定,但大量的去污剂如TritonX-100、SDS等严重干扰测定。
3.蛋白质与考马斯亮蓝G-250结合的反应十分迅速,在2min左右反应达到平衡;其结合物在室温下1h内保持稳定。因此测定时,不可放置太长时间,否则将使测定结果偏低。
