实验 量气法测定过氧化氢催化分解反应速率常数
一、实验目的
1. 学习使用量气法研究过氧化氢的分解反应
2. 了解一级反应的特点,掌握用图解计算法求反应速率常数。
二、实验原理
H2O2在室温下,没有催化剂存在时,分解反应进行得很慢,但加入催化剂(如Pt、Ag、MnO2、碘化物)时能促使其较快分解,分解反应按下式进行:
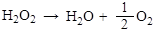 (C2-1)
(C2-1)
在催化剂KI作用下,H2O2分解反应的机理为:
 (C2-2)
(C2-2)
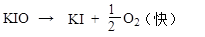 (C2-3)
(C2-3)
整个分解反应的速度由慢反应(C2-2)决定:
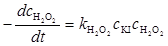 (C2-4)
(C2-4)
式中c表示各物质的浓度(mol?L-1),t为反应时间(s),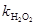 为反应速率常数,它的大小仅决定于温度。
为反应速率常数,它的大小仅决定于温度。
在反应中作为催化剂的KI的浓度保持不变,令 ,则
,则
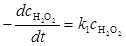 (C2-5)
(C2-5)
式中k1为表观反应速率常数。此式表明,反应速率与H2O2浓度的一次方成正比,故称为一级反应。将上式积分得:
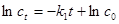 (C2-5)
(C2-5)
式中c0、ct分别为反应物过氧化氢在起始时刻和t时刻的浓度。反应半衰期为:
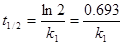 (C2-6)
(C2-6)
由反应方程式可知,在常温下,H2O2分解的反应速度与氧气析出的速度成正比。析出的氧气体积可由量气管测量。令V∞表示H2O2全部分解所放出的O2体积,Vt表示H2O2在t时刻放出的O2体积,则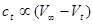 。将该关系式带入(C2-5),得到
。将该关系式带入(C2-5),得到
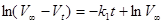 (C2-7)
(C2-7)
本实验采用静态法测定H2O2分解反应速率常数,实验装置见图C2-1。
三、仪器和试剂
1.试剂

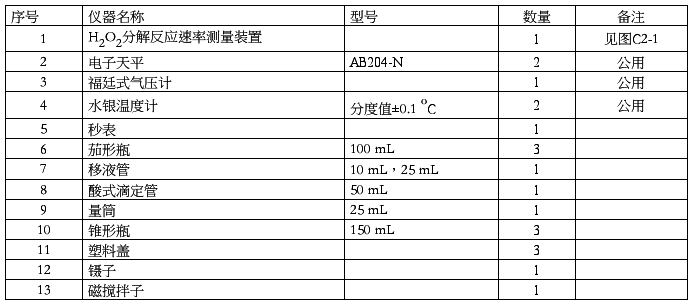
2.仪器

四.实验方法和实验条件的设计
1. 借助于实验装置和试剂,如何能获得用KI作催化剂时H2O2分解反应的表观反应速率常数k1?
2. 令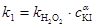 ,若要进一步验证该反应对KI确实为一级反应,即α=1,并要获得该反应的速率常数
,若要进一步验证该反应对KI确实为一级反应,即α=1,并要获得该反应的速率常数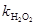 ,在目前的实验条件还要如何设计实验?请写出实验思路并完成实验。
,在目前的实验条件还要如何设计实验?请写出实验思路并完成实验。
3. 化学反应速率取决于许多因素,如反应物的浓度、搅拌速度、温度、催化剂等。除碘化物外,能加速H2O2分解的催化剂还有Pt、Ag、MnO2、Fe等等。在实验时间允许的范围内,可改变实验条件,考察其他条件对H2O2分解反应的表观反应速率常数k1的影响,进一步丰富该实验内容。
五、实验步骤
1.H2O2分解反应速率测量装置见图C2-1。用移液管移取25 mL浓度约为0.35 %的H2O2溶液放入茄形瓶中,加入磁搅拌子。用电子天平准确称量50 mg左右的KI(s)放入到小塑料盖内,再用镊子将其小心放入到盛有H2O2溶液的茄形瓶中,让盖子漂浮在液面上,不能让H2O2接触到KI(s)。
2.试漏。旋转活塞4使量气管与大气相通,举高水准瓶,使液体充满量气管。然后旋紧磨口塞3,通过反复调整水准瓶和活塞4到合适的位置,让反应体系和量气管相通而与大气隔绝的情况下,量气管内液面的位置在刻度1.00附近。读取量气管液面对应的读数。然后把水准瓶放在较低的位置,若量气管中的液面仅在初始有下降,而在随后2 min内保持不变,表示系统不漏气;否则应找出系统漏气的原因,并设法排除之。
注意:读取量气管读数时务必使水准瓶内液面和量气管内液面处于同一水平。
提示:系统漏气多发生在茄形瓶磨口塞处,可涂抹凡士林或真空脂。
3.用手摇动茄形瓶,使塑料盖中的KI(s)与H2O2充分混合,记录反应起始时间,同时开启电磁搅拌开关,调节搅拌速度至中档。
4.每隔一定时间读取量气管内液面所对应的刻度一次,直至反应进行到10 min ~12 min左右,记录的实验点有7~8个即可结束本次实验。为避免量气管内因气压增大而漏气,在液面下降的同时,应慢慢移动水准瓶,使两液面大致保持在同一水平面,直至反应结束。
5.改变催化剂KI(s)的量分别为100 mg和150 mg左右重复上面的实验。
6.过氧化氢的准确浓度的标定。移取H2O2溶液10 mL置于150 mL锥形瓶中,加入10 mL 3 mol·L-1 H2SO4溶液,用0.02260 mol·L-1 KMnO4标准溶液滴定至淡粉红色,读取消耗KMnO4标准溶液的体积。重复三次,取平均值。
六.数据处理
1.实验中V∞可用化学分析法测定。先在酸性溶液中用KMnO4标准溶液滴定求出过氧化氢的起始浓度,滴定反应为:
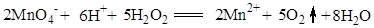
再求所用过氧化氢按式(C2-1)完全分解时产生O2的摩尔数,根据理想气体状态方程就可以计算出V∞,即
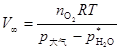 (C2-8)
(C2-8)
式中:p大气为大气压,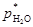 为实验温度下水的饱和蒸汽压;T为实验温度;R为气体常数。
为实验温度下水的饱和蒸汽压;T为实验温度;R为气体常数。
严格地讲,用含水量气管测量气体体积时,都包含着水蒸气的分体积。若在某温度时,水蒸气已达饱和,则Vt应按下式计算:
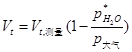
2.福廷式气压计读数的校正(压力计在218房间)
气压计的校正公式为:
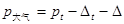 (C2-9)
(C2-9)
式中,pt为气压计的读数,Dt为温度校正项,D为重力加速度及气压计本身的误差校正项。本实验使用的福廷式气压计D = 0。温度校正项Dt为:

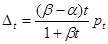 (C2-10)
(C2-10)
已知在0~35℃时,汞的平均体膨胀系数b=0.0001815 oC-1,黄铜的平均线膨胀系数为a=0.0000184 oC-1。
3.水的饱和蒸气压(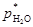 /Pa)与温度的关系
/Pa)与温度的关系
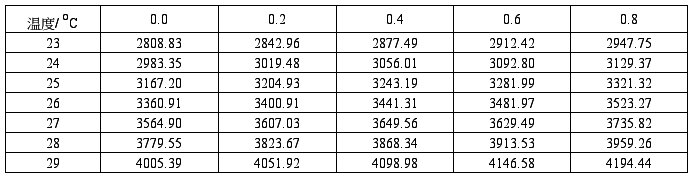
摘自:印永嘉主编. 物理化学简明手册. 北京:高等教育出版社,1988:132。
七.思考题
1.若实验在开始测量时,已经先放掉了一部分氧气,这样做对实验结果有没有影响?为什么?
2.读取O2体积时,为什么要使水准瓶内液面和量气管内液面处于同一水平?。
3.反应中KI起催化作用,它的浓度与实验测得的表观反应速率常数k1的关系如何?
第二篇:过氧化氢分解反应速率常数的测定
五、数据记录与处理
1、H2O2催化分解数据表
当催化剂KI的浓度为0.1mol/L时所得的数据如下:
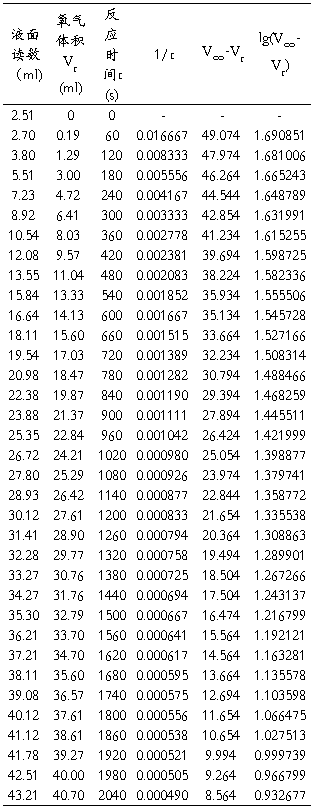
2、以Vt对1/t作图,将得到一条直线,将直线外推至1/t=0,由其截距得到 。
。
由于刚开始时,量气管中的气体暂时未充满,故所得的数据存在不准确性,舍掉前十组数据得到图如下:
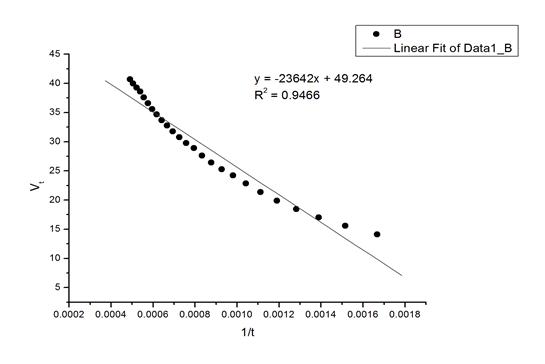
当1/t=0时,得到 =49.264。
=49.264。
3、以lg(V∞-Vt)对t作图,求直线斜率。
据以上数据得到图形如下
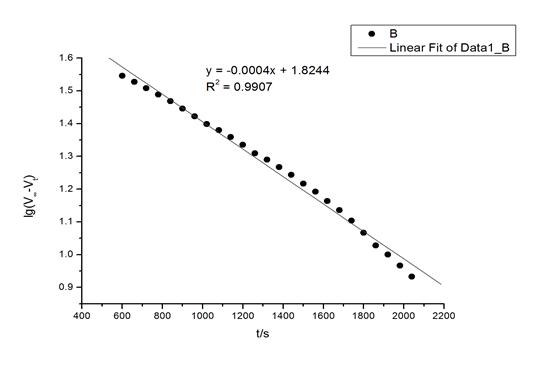
据公式
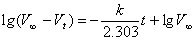
可得反应的速率
K=9.64*10-4s-1
4、根据t1/2=0.693/k计算半衰期。

同理,当催化剂KI的浓度为0.05mol/L时依据所得计算出的反应速率
K=4.606*10-4s-1
得半衰期

