实验蛋白质的基本性质
实验一蛋白质的沉淀、变性反应
实验二蛋白质和氨基酸的颜色反应
实验一蛋白质的沉淀、变性反应
一、目的和要求
1.了解蛋白质的沉淀反应、变性作用和凝固作用的原理及它们的相互关系。
2.学习盐析等生物化学操作技术。
二、基本原理
蛋白质分子在水溶液中,由于其表面形成了水化层和双电层而成为稳定的胶体颗粒,所以蛋白质溶液和其他亲水胶体溶液相似。但是,在一定的物理化学因素影响下,由于蛋白质胶体颗粒的稳定条件被破坏,如失去电荷、脱水,甚至变性,而以固态形式从溶液中析出,这个过程称为蛋白质的沉淀反应。这种反应可分为可逆沉淀反应和不可逆沉淀反应两种类型。
可逆沉淀反应——蛋白质虽已沉淀析出,但它的分子内部结构并未发生显著变化,如果把引起沉淀的因素去除后,沉淀的蛋白质能重新溶于原来的溶剂中,并保持其原有的天然结构和性质。利用蛋白质的盐析作用和等电点作用,以及在低温下,乙醇、丙酮短时间对蛋白质的作用等所产生的蛋白质沉淀都属于这一类沉淀反应。
不可逆沉淀反应——蛋白质发生沉淀时,其分子内部结构空间构象遭到破坏,蛋白质分子由规则性的结构变为无秩序的伸展肽链,使原有的天然性质丧失,这时蛋白质已发生变性。这种变性蛋白质的沉淀已不能再溶解于原来溶剂中。
引起蛋白质变性的因素有重金属盐、植物碱试剂、强酸、强碱、有机溶剂等化学因素,加热、振荡、超声波、紫外线、X-射线等物理因素。它们都能因破坏了蛋白质的氢键、离子键等次级键而使蛋白质发生不可逆沉淀反应。
天然蛋白质变性后,变性蛋白质分子互相凝聚或互相穿插缠绕在一起的现象称为蛋白质的凝固。凝固作用分两个阶段:首先是变性,其次是失去规律性的肽链聚集缠绕在一起而凝固或结絮。几乎所有的蛋白质都会因加热变性而凝固,变成不可逆的不溶状态。
三、材料与试剂
1.实验材料:鸡蛋或鸭蛋。
2.实验试剂:
(1)蛋白质溶液:取5mL鸡或鸭蛋清,用蒸馏水稀释至l00mL,搅拌均匀后用4~8层纱布过滤,新鲜配制。
(2)蛋白质氯化钠溶液:取20mL蛋清,加蒸馏水200mL和饱和氯化钠溶液l00mL,充分搅匀后,以纱布滤去不溶物(加入氯化钠的目的是溶解球蛋白)。
(3)其他试剂
①硫酸铵粉末 ②饱和硫酸铵溶液 ③0.5%乙酸铅溶液 ④10%三氯乙酸溶液 ⑤浓盐酸 ⑥浓硫酸 ⑦浓硝酸 ⑧ 0.1%硫酸铜溶液 ⑨饱和硫酸铜溶液 ⑩0.1%乙酸溶液 1110%乙酸溶液 12饱和氯化钠溶液 1310%氢氧化钠溶液 1495%乙醇
四、实验器材
①试管及试管架 ②小玻璃漏斗 ③滤纸 ④玻璃棒 ⑤烧杯 ⑥量筒 ⑦100℃恒温水浴箱
五、操作方法
1.蛋白质的盐析作用
用大量中性盐使蛋白质从溶液中沉淀析出的过程称为蛋白质的盐析作用。蛋白质是亲水胶体,蛋白质溶液在高浓度中性盐的影响下,蛋白质分子被中性盐脱去水化层,同时所带的电荷被中和,结果蛋白质的胶体稳定性遭到破坏而沉淀析出。析出的蛋白质仍保持其天然性质,当降低盐的浓度时,还能溶解。因此,蛋白质的盐析作用是可逆过程。
沉淀不同的蛋白质所需中性盐的浓度不同;而沉淀相同的蛋白质,因使用中性盐类不同所需的盐浓度也有差异。例如,向含有清蛋白和球蛋白的鸡蛋清溶液中加硫酸镁或氯化钠至饱和,则球蛋白沉淀析出;加硫酸铵至饱和,则清蛋白沉淀析出。另外,在等电点时,清蛋白可被饱和硫酸镁或氯化钠或半饱和的硫酸铵溶液沉淀析出。所以在不同条件下,用不同浓度的盐类可将各种蛋白质从混合溶液中分别沉淀析出,该法称为蛋白质的分级盐析,并在提纯蛋白质时常被应用。
取一支试管,加入3mL蛋白质氯化钠溶液和3mL饱和硫酸铵溶液,混匀,静置约10min,则球蛋白沉淀析出,过滤后向滤液中加入硫酸铵粉末,边加边用玻璃棒搅拌,直至粉末不再溶解,达到饱和为止,此时析出的沉淀为清蛋白。静置,倒去上部清液,取出部分清蛋白沉淀,加水稀释,观察它是否溶解。
2.重金属盐沉淀蛋白质
重金属盐类易与蛋白质结合成稳定的沉淀而析出。蛋白质在水溶液中是酸碱两性电解质,在碱性溶液中(对蛋白质的等电点而言),蛋白质分子带负电荷,能与带正电荷的金属离子结合成蛋白质盐,当加入汞、铅、铜、银等重金属的盐时,蛋白质形成不溶性的盐类而沉淀,并且这种蛋白质沉淀不再溶解于水中,说明它已发生了变性。
重金属盐类沉淀蛋白质的反应通常很完全,因此在生化分析中,常用重金属盐除去体液中的蛋白质;在临床上用蛋白质解除重金屑盐的食物性中毒。但应注意,使用乙酸铅或硫酸铜沉淀蛋白质时,试剂不可加过量,否则可使沉淀出的蛋白质重新溶解。
取3支试管,各加入约1ml蛋白质溶液,分别加入0.5%乙酸铅溶液1~3滴和0.1%硫酸铜溶液3~4滴,观察沉淀的生成。向第一、二支试管再分别加入过量的乙醋铅和饱和硫酸铜溶液,观察沉淀的再溶解。
3.无机酸沉淀蛋白质
浓无机酸(除磷酸外)都能使蛋白质发生不可逆沉淀反应。这种沉淀作用可能是蛋白质颗粒脱水的结果。过量的无机酸(硝酸除外)可使沉淀出的蛋白质重新溶解。临床诊断上,常利用硝酸沉淀蛋白质的反应,检查尿中蛋白质的存在。
取3支试管,分别加入浓盐酸15滴,浓硫酸、浓硝酸各10滴。小心地向3支试管中,沿管壁加入蛋白质溶液6滴,不要摇动,观察各管内两液面处有白色环状蛋白质沉淀出现。然后,摇动每个试管,蛋白质沉淀应在过量的盐酸及硫酸中溶解。在含硝酸的试管中,虽经振荡,蛋白质沉淀也不溶解。
4.有机酸沉淀蛋白质
有机酸能沉淀蛋白质。在酸性溶液中(对蛋白质的等电点而言),蛋白质分子带正电荷,能与带负电荷的酸根结合。生成不溶性蛋白质盐复合物而沉淀。三氯乙酸和磺基水杨酸是沉淀蛋白质最有效的两种有机酸。
取一支试管,加入蛋白质溶液约0.5mL,然后滴加10%三氯乙酸溶液数滴,观察蛋白质的沉淀。
5.有机溶剂沉淀蛋白质
乙醇、丙酮都是脱水剂,它能破坏蛋白质胶体颗粒的水化层,而使蛋白质沉淀。低温时,用乙醇(或丙酮)短时间对蛋白质的作用,还可保持蛋白质原有的生物活性;但用乙醇进行较长时间的脱水可使蛋白质变性沉淀。
取一支试管,加入蛋白质氯化钠溶液1ml再加入95%乙醇2ml并混匀,观察蛋白质的沉淀。
6.加热沉淀蛋白质
蛋白质可因加热变性沉淀而凝固,然而盐浓度和氢离子浓度对蛋白质加热凝固有着重要影响。少量盐类能促进蛋白质的加热凝固;当蛋白质处于等电点时,加热凝固最完全、最迅速;在酸性或碱性溶液中,蛋白质分子带有正电荷或负电荷,虽加热蛋白质也不会凝固;若同时有足量的中性盐存在,则蛋白质可因加热而凝固。
取5支试管,编号,按表2加入有关试剂。

将各管混匀,观察、记录各管现象后,放入100℃恒温水浴中保温10min.注意观察、比较管的沉淀情况。然后,将第3,4,5号管分别用10%NaOH溶液或10%乙酸溶液中和,观察并解释实验结果。
将第3,4,5号管继续分别加入过量的酸或碱,观察它们发生的现象。然后,用过量的酸或碱中和第3,5号管,100℃水浴保温10min,观察沉淀变化,检查这种沉淀是否溶于过量的酸或碱中,并解释实验结果。
思考题
1.在蛋白质可逆沉淀反应实验中,为何要用蛋白质氯化钠溶液?
2.高浓度的硫酸铵对蛋白质溶解度有何影响,为什么?
3.蛋白质分子中的哪些基团可以与重金属离子作用而使蛋白质沉淀?
4.鸡蛋清为什么可用作铅中毒或汞中毒的解毒剂?
5.蛋白质分子中的哪些基团可以与有机酸、无机酸作用而使蛋白质沉淀?
6.在加热沉淀蛋白质的实验过程中应注意哪些问题?
实验二蛋白质与氨基酸的颜色反应
一、实验原理
1.蛋白质和氨基酸鉴定的常用方法原理
蛋白质所含有的某些氨基酸及其特殊结构,能够与某些试剂反应,生成有色物质,这就是蛋白质和氨基酸的颜色反应。
(1)双缩脲反应:当脲(即尿素)加热至180℃时,两分子脲缩合,放出一分子氨形成双缩脲(biuret),双缩脲在碱性溶液中与铜离子(Cu2+)结合生成复杂的紫红色化合物。
蛋白质或二肽以上的多肽分子中,含有多个与双缩脲结构相似的肽键,因此也有双缩脲反应。但是含有一个-CS-NH2,-CH2-NH2,-CRH-NH2,-CH2-NH-CHNH2-CH2OH,-CHOH-CH2NH2等基团的物质,甚至过量的铵盐也干扰本反应。、
(2)Millon反应:单酚及双酚和吲哚衍生物能与Millon试剂(硝酸、亚硝酸、硝酸汞、亚硝酸汞的混合物)产生颜色反应。单酚衍生物(如酪氨酸)与Millon试剂反应呈粉红色至暗红色。双酚和吲哚衍生物,如色氨酸与Millon试剂呈黄色至红色。这些反应最初产生的有色物质可能是酚的亚硝基衍生物,经互变异构后,成为颜色更深的邻醌肟,最终形成红色稳定产物。

不能利用Millon反应检测尿蛋白,试剂中的汞离子能被脲、无机盐所沉淀,使试剂失效。碱也能沉淀汞离子,因此鉴定碱性试样时,须先酸化。
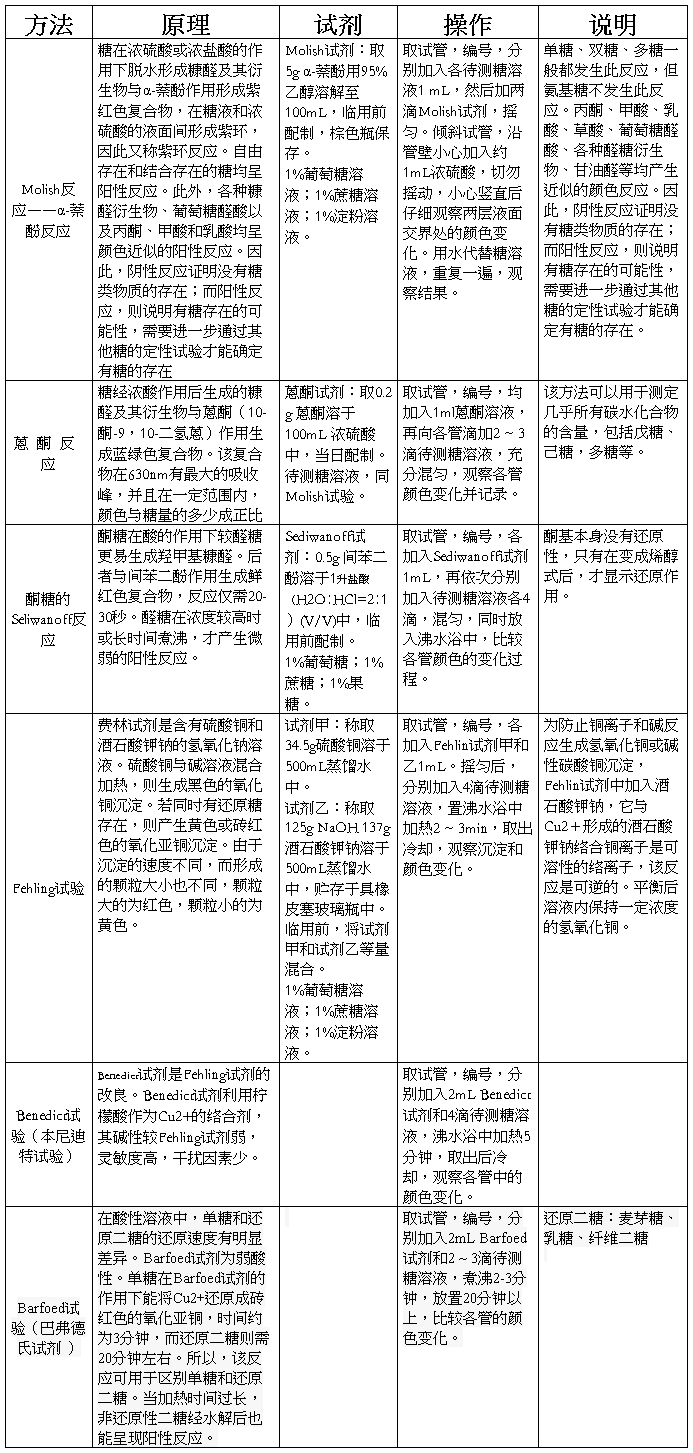
(3)蛋白的黄色反应:蛋白质分子中含有苯环结构的氨基酸,如酪氨酸、色氨酸等,遇到浓硝酸可硝化成黄色物质。此化合物在碱性溶液中进一步形成深橙色的邻硝醌酸钠。这就是蛋白的黄色反应。皮肤、指甲和毛发等遇到浓硝酸变黄即是这个反应的结果。参考反应如下:
蛋白质的苯丙氨酸不易硝化,一般不发生黄色反应,若加入少量浓硫酸,则得到明显的黄色反应。
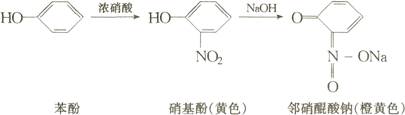
(4)茚三酮反应:蛋白质、多肽和各种氨基酸具有茚三酮反应。除无α氨基脯氨酸和羟脯氨酸呈黄色外,其他氨基酸生成紫红色化合物,最终变为蓝色。
该反应已广泛地用于氨基酸定量测定。
2.特定氨基酸鉴定的方法原理
(1)含酚基氨基酸,如酪氨酸,利用上述Millon反应。
(2)含苯环氨基酸,如苯丙氨基和酪氨酸利用上述蛋白黄色反应。
(3)含吲哚基氨基酸,如色氨酸,利用Hopkins-Cole乙醛酸反应加以鉴定。含色氨酸蛋白质或色氨酸在浓硫酸中与乙醛酸反应形成红紫色物质。NO3-、NO2-、ClO3-以及过多的Cl-干扰该反应。有微量CuSO4或Fe3+存在时,可以加强色氨酸的阳性反应。
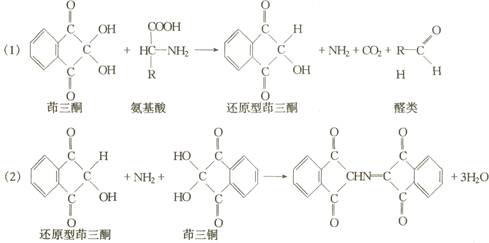
(4)含胍基的唯一氨基酸即精氨酸,可以利用坂口(Sakaguchi)反应加以鉴定。精氨酸与α萘酸在碱性次溴酸钠(或次氯酸钠)溶液中发生反应,产生红色产物。该反应受胍乙酸、甲胍和胍基丁胺等干扰。反应方程式:
由于过量次溴酸钠缓慢氧化上述有色物质,α氨基酸破裂,引起颜色消褪,必须加入浓脲溶液,破坏过量的次溴酸钠,以增加呈色反应的稳定性。
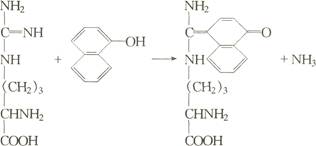
(5)含巯基氨基酸,如半胱氨酸,在碱性条件下与亚硝基铁氰化钠反应形成紫红色物质。
胱氨酸经KCN还原成半胱氨酸后,也呈阳性反应。反应方程式:
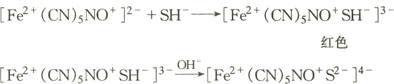
(6)含酚核或咪唑环氨基酸,如酪氨酸和组氨酸,利用Ehrlich重氮试剂法,重氮化合物与酚核或咪唑氨基酸或蛋白质结合产生有色物质。酪氨酸呈不很明显的橙红色;组氨酸呈鲜红色。此反应受到酪胺、组胺、肾上腺素和胆色素的干扰。
二、实验用品
(一)器材
试管及试管架,10mL量筒,滴管,滤纸,喷雾器,点滴反应板。
(二)试剂
(1)双缩脲试剂:将0.175g硫酸铜(CuSO4·5H2O)溶于约15mL蒸馏水,置于100mL容量瓶中,加入30mL浓氨水,30mL冰冷的蒸馏水和20mL饱和NaOH溶液,摇匀,室温放置1~2h,再用蒸馏水定容至100mL后,摇匀,置试剂瓶中备用。
(2)浓硝酸和浓硫酸。
(3)10%NaOH。
(4) 0.1%茚三酮乙醇溶液。
(5) 0.5%苯酚溶液
(三)材料
鸡卵清蛋白, 1%明胶溶液,黄豆提取液,脲
三、实验程序
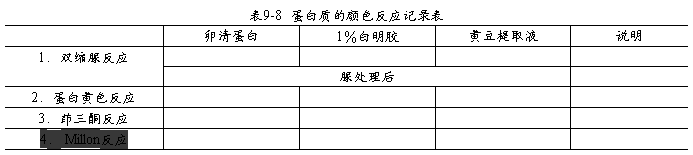
1.按表9-6、9-7要求操作
(1)蛋白质:

2.实验记录
观察并记录颜色;以“+”和“-”表示阳性、阴性反应,并以“+”“++”和“+++”表示颜色深浅程度;将结果记录于表9-8,9-9。
四、作业
1.综合分析蛋白质各种鉴定方法的特点和用途。
2.如果蛋白质水解作用一直进行到双缩脲反应呈阴性结果,这个结果说明什么?
第二篇:蛋白质、氨基酸、糖的鉴别试验及其比较
蛋白质
1.由于蛋白质分子中含有共轭双键的酪氨酸和色氨酸,因此在280nm波长处有特征性吸收峰。蛋白质的OD280与其浓度呈正比关系,因此可作蛋白质定量测定。
2.双缩脲反应biuret reaction:蛋白质在碱性溶液中与硫酸铜作用形成紫色络合物的呈色反应。在540nm 波长处有最大吸收。可用于蛋白质的定性和定量检测。
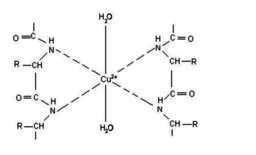
紫色络合物分子结构式
在碱性溶液(NaOH)中,双缩脲(H2NOC-NH-CONH2)能与铜离子(Cu2+)作用,形成紫色络合物(该物质的分子结构式见图),该反应即双缩脲反应。
双缩脲反应是肽和蛋白质所特有的,而为氨基酸所没有的一种颜色反应。一般分子中含有两个氨基甲酪基(即肽键:-CO-NH-)的化合物与碱性铜溶液作用,就会形成紫色或蓝紫色络合物。
注:除-CO-NH-有此反应外,(-CONH2-)、(-CH2-)、(-NH2-)、(-CS-CS-NH2)等基团亦有此反应。
双缩脲反应的鉴定
由于蛋白质分子中含有很多与双缩脲结构相似的肽键,因此也能与铜离子在碱性溶液中发生双缩脲反应,且颜色深浅与蛋白质的含量的关系在一定范围内符合比尔定律,而与蛋白质的氨基酸组成及分子量无关,故可用双缩脲法测定蛋白质的含量(借助分光光度计可减小误差)。
双缩脲反应主要涉及肽键,因此受蛋白质特异性影响较小。使用试剂价廉易得,操作简便,可测定的范围为1~10mg蛋白质,适于精度要求不太高的蛋白质含量的测定,能测出的蛋白质含量须在约0.5mg以上。双缩脲法的缺点是精确度低、所需样品量大。干扰此测定的物质包括在性质上是氨基酸或肽的缓冲液,如Tris缓冲液,因为它们产生阳性呈色反应,铜离子也容易被还原,有时出现红色沉淀。
配制双缩脲试剂的注意事项双缩脲试剂由NaOH溶液(0.1g/mL)和CuSO4溶液(0.01g/mL)配制而成,配制比例为5:1。但是双缩脲试剂不用现配现用,这是与斐林试剂不同的地方之一!
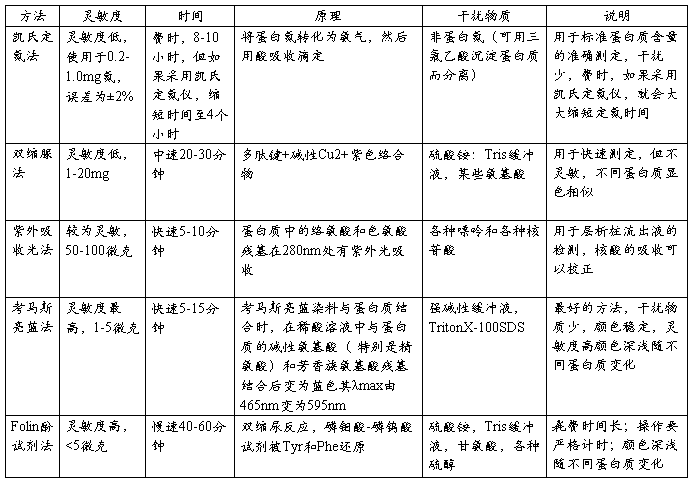
蛋白质检测方法比较
氨基酸
茚三酮鉴别试验的反应方程式:
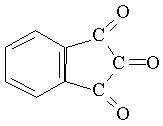

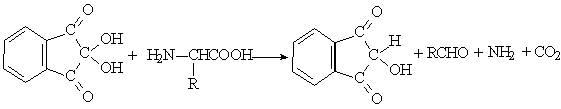
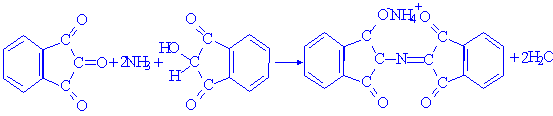
氨基酸与茚三酮水合物共热,可生成蓝紫色化合物,其最大吸收峰在570nm处。由于此吸收峰值与氨基酸的含量存在正比关系,因此可作为氨基酸定量分析方法。脯氨酸为黄色化合物,谷丙酰胺和天冬酰胺为棕色化合物。
糖分的鉴别实验
1. Fehling试验 生药的水浸液加Fehling试剂,于沸水浴加热数分钟,若有还原性糖类成分存在,则产生砖红色氧化亚铜沉淀。若有非还原性低聚糖及多糖存在,则必须加稀酸水解后,才能与Fehling试剂呈阳性反应。糖类包括多糖、寡糖、单糖,其中单糖和某些二塘具有有力羰基,是还原糖,多糖和蔗糖没有还原性。
斐林试剂是新配制的溶液,它在加热条件下与醛基反应,被还原成砖红色的沉淀,可用于鉴定可溶性还原糖的存在。
CuSO4 + 2NaOH=====Cu(OH)2 + Na2SO4
2CH3(CH2OH)4CHO + 2 Cu(OH)2 ---(加热)--→ 2 CH3(CH2OH)4COOH+ Cu2O(砖红色沉淀) + 2 H2O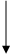

2. Molish试验 生药水浸液,加a -萘酚试剂数滴,摇匀后沿管壁滴加浓硫酸,若有糖类成分与甙类存在,则在二液面交界处出现紫红色环。
 紫红色复合物
紫红色复合物
3. 成脎试验 生药的水浸液与盐酸苯肼液共热,只要有糖类成分存在,即生成黄色的糖脎结晶。镜检结晶,可视结晶的形状而鉴定出糖的种类。
4. 层析法 取生药浸出液(多糖类需水解),以某种糖为对照品一起进行层析检测。常用纸层析法,正丁醇-乙酸-水(4 : 1 : 5上层)作展开剂,新配制的氨化硝酸银溶液为显色剂,结果还原糖形成黑色斑点。
糖检测方法比较