碱式碳酸铜的制备
一、实验原理
为了适于碱式碳酸铜的生成和离取, 根据碱式碳酸铜的性质和铜盐的性质, 选用硫酸铜溶液和碳酸钠溶液。其反应方程式如下:
水浴加热
2CuSO4 + 2NaCO3 + H2O === Cu2 (OH) 2CO3 + CO2 ↑+ 2NaSO4 反应过程中, 反应温度、反应物浓度及反应物配比对反应物均有影响。
二、仪器与药品:
数显恒温水浴锅;气流烘干机;烘干箱;抽滤装置;烧杯;容量瓶;硫酸铜溶液;碳酸钠溶液;钡盐溶液
.反应溶液的配置:配置0.5mol·L -1 的CuSO4溶液和0.5mol·L-1Na2CO3溶液各250mL。静置,以备用
称取固体药品硫酸铜31.2110g 和碳酸钠13.2488g , 分别倒入两个250mL 的烧杯中, 用100mL 蒸馏水溶解, 再转入250mL容量瓶中, 配成250mL 溶液。
三、制取碱式碳酸铜的最佳条件
反应温度: 50 ℃; 反应物浓度: 0.5mol/L 的CuSO4 溶液和0.5mol/LNa2CO3 溶液, 及反应物配料比: CuSO4 溶液: Na2CO3 溶液1 : 1.2。
四、制备过程设计
1 取60mL0.5mol/L 的CuSO4 溶液置于150mL 烧杯中, 再取72mL 0.5mol/L Na2CO3 溶液于另一个150mL 烧杯中。将两个贴有标签的烧杯同时放到50 ℃恒温水浴中加热, 几分钟后取出。
2 将两个烧杯取出, 将CuSO4 溶液倒入Na2CO3 溶液中, 用玻璃棒搅拌, 静置, 待沉淀完全。减压抽滤,收集产品,并用少量冷水洗涤至洗涤液内不含SO42-为止(用Ba2+检验)。将所得产品烘干,称量,计算产率。
3 用蒸馏水洗涤沉淀数次, 直到沉淀中不含硫酸根离子为止(可取上层清液少许置于小试管中, 滴加几滴BaCl2 溶液, 观
察有无白色沉淀) , 抽滤。
4 将产品在烘箱中(100 ℃) 烘干, 待冷至室温后称量, 并计算产率。
五、本实验注意事项
1 反应温度不应超过100 ℃, 且要处于恒温;
2 沉淀要洗涤干净;
3 若反应后不能观察到暗绿色或淡蓝色沉淀, 可将反应物保持原样(不可将滤液滤去) 静置1 - 2 天, 再作观察;
4 反应过程中不可将Na2CO3 溶液到入CuSO4 溶液中。
第二篇:废铝箔之硫酸铝钾大晶体及碱式碳酸铜制备
实验题目:由废铝箔制备硫酸铝钾大晶体
一、实验目的
1、巩固对铝和氢氧化铝两性的认识,掌握复盐晶体的制备方法;
2、了解从水溶液中培养大晶体的方法,制备硫酸铝钾大晶体。
3、掌握沉淀与溶液分离的几种操作方法。
二、实验原理
1、明矾的性状
明矾又称白矾、钾矾、钾铝矾、钾明矾、十二水硫酸铝钾。是含有结晶水的硫酸钾和硫酸铝的复盐。化学式KAl(SO4)2·12H2O,式量474.39,正八面体晶形,有玻璃光泽,密度1.757g/cm3,熔点92.5℃。64.5℃时失去9分子结晶水,200℃时失去12分子结晶水,溶于水,不溶于乙醇。在20度,1个标准大气压下,明矾在水中的溶解度约为5.90g。
表1 溶解度的参照表
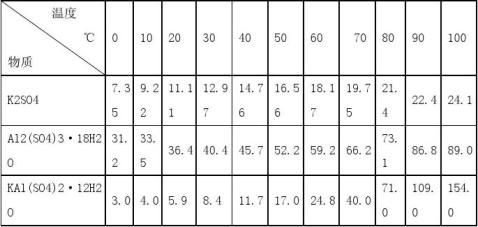
2、明矾晶体的实验制备原理
铝屑溶于浓氢氧化钾溶液,可生成可溶性的四羟基合铝(Ⅲ)酸钾K[Al(OH)4],用稀H2SO4调节溶液的pH值,将其转化为氢氧化铝,使氢氧化铝溶于硫酸,溶液浓缩后经冷却有较小的同晶复盐,此复盐称为明矾[KAl(SO4)2·12H2O]。小晶体经过数天的培养,明矾则以大块晶体结晶出来。制备中的化学反应如下:
2Al + 2KOH + 6H2O ══ 2K[Al(OH)4] + 3H2↑
2 K[Al(OH)4] + H2SO4 ══ 2Al(OH)3↓+ K2SO4 + 2H2O
2Al(OH)3 + 3H2SO4 ══ Al2(SO4)3 + 6 H2O
Al2 (SO4)3 + K2SO4 + 24H2O ══2KAl(SO4)2·12H2O
三、实验步骤
1、工艺流程图
KOH ↘ H2SO4 K2SO 4
↘
明矾单晶 废铝2、明矾晶体的实验制备
取50mL2mol·L-1 KOH溶液,分多次加入2g废铝制品(铝质牙膏壳、铝合金易拉罐等),反应完毕后用布氏漏斗抽滤,取清液稀释到l00mL,在不断搅拌下,滴加3 mol·L-1 H2SO4溶液,调ph6-7(按化学反应式计量,约41mL)。加热至沉淀完全溶解,并按计量数加入K 2SO4 ,适当浓缩溶液,然后用自来水冷却结晶,抽滤,所得晶体即为KAl(SO4)2·12H2O。
3、明矾透明单晶的培养
KAl(SO4)2·12H2O为正八面体晶形。为获得棱角完整、透明的单晶,应让籽晶(晶种)有足够的时间长大,而晶籽能够成长的前提是溶液的浓度处于适当过饱和状态。本实验通过将饱和溶液在室温下静置,靠溶剂的自然挥发来创造溶液的准稳定状态,人工投放晶种让之逐渐长成单晶。
(1)籽晶的生长和选择
根据KAl(SO4)2·12H2O的溶解度,称取l0g自制明矾(在40摄氏度,一个标准大气压下,明矾溶解度为11.7g),加入适量的水(理论值约为85ml,实际加水约50mL,若加水过多,蒸发结晶会比较耗时间),加热溶解,然后放在不易振动的地方,烧杯口上架一玻璃棒,然后在烧杯口上盖一块滤纸,以免灰尘落下,放置一天,杯底会有小晶体析出,从中挑选出晶型完整的籽晶待用,同时过滤溶液,留待后用。
(2)晶体的生长
以缝纫用的涤纶细线把籽晶系好,剪去余头,缠在玻璃棒上悬吊在已过滤的饱和溶液中,观察晶体的缓慢生长。数天后,可得到棱角完整齐全、晶莹透明的大块晶体。
四、实验现象
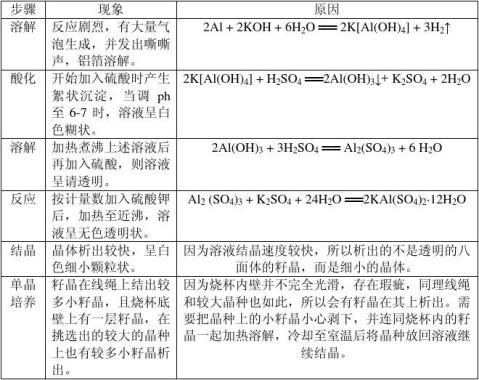
五、实验数据的处理及分析
1. 在溶解铝箔时,用去4mol/L的 KOH 25mL,而不是18.5mL.为的是让铝箔快速溶解,且多与的碱可在调节ph时中和。
2. 抽滤得到的Al(OH)3 为41.1g,大于理论值31.1g。可能的原因有:氢氧化铝在抽滤后仍含有较多的水分;杂质离子的沉淀也在其中。由于超过理论值太多,而铝箔中主要含铝,杂质是少量的,这说明沉淀含水过多占主导地位。而按照该值计算所得的硫酸钾会大量过量,所以,在这种情况下应该按照理论值计算K2SO4。 即比理论值6.4克略多一些即可。
3. 抽滤后得到KAl(SO4)2·12H2O 31.5g。 理论产量35.1g,产率为89.7%。
4. 最后获得的KAl(SO4)2·12H2O的外侧透明程度不好,内侧也不透明。看不出其八面体的形状。其原因为:1.籽晶并是并不是正八面体,而是一块透明的扁平
的晶种。2. 在用棉线捆绑籽晶后,棉线边上的细丝也会长出籽晶,并且晶种表面并不光滑,籽晶也会在晶种表面生成,造成晶体透明度差,形状不规则。解决方法是选择一个规则的晶种,并用洁净的头发丝缠住晶种。
六、参考文献
1.中美教师合编,《新化学实验》,天津科学技术出版社,1984
2.[美] B.A.苏迪著,刘光译,《单晶生长》,科学出版社,1979
3.张克从.1987.近代晶体学基础.北京.科学出版社
4.罗谷风编,《晶体学导论》,地质出版社,1985,11~25
5. 刘汉标、石建新、邹小勇.2008.基础化学实验.北京.科学出版社
6. 孙淑声等.2005.无机化学.北京.北京大学出版社
实验题目:碱式碳酸铜的制备及铜含量测定
摘要:本次试验主要是探究硫酸铜与碳酸钠反应的最适体积配比和反应温度,并用碘量法测定0.1g碱式碳酸铜中铜的质量分数。
关键词:探究 最适体积配比 最适反应温度 碘量法
前言:碱式碳酸铜为天然孔雀石的主要成分,其中铜含量的变化会影响产品的颜色,工业产品含66.2%~78.2%(质量分数)氧化铜,呈暗绿色或淡蓝绿色,加热至200oC即分解,在水中的溶解度度很小,新制备的试样在沸水中很易分解。实验室制备(水溶液反应法):2CuSO4 + 2Na2CO3 + H2O = Cu2(OH)2CO3↓+ CO2↑+ 2Na2SO4,并用碘量法测定碱式碳酸铜中铜的含量。
一、实验部分
(一)仪器与药品:
带标号的中式管10只;250mL烧杯及100mL烧杯; 50mL容量瓶;BaCl2溶液; 2mol/L HCl溶液, Na2CO3 及CuSO4·5H2O固体,1 mol/L硫酸溶液,10%KSCN溶液,10%KI 溶液,0.5%的淀粉溶液,0.1mol/L Na2S2O3溶液。
(二)实验过程
1. 探究CuSO4 和Na2CO3溶液体积的适合配比
配制0.5mol·L-1的CuSO4溶液和0.5mol·L-1的Na2CO3溶液100mL:分别称取12.5gCuSO4·5H2O和5.3gNa2CO3溶解于250ml小烧杯。
取10只中式管编号,其中5只加入2.0 mL 0.5 mol/L CuSO4溶液,另外5只分
别加入1.6mL,1.8mL,2.0mL, 2.2mL,2.4mL0.5mol/L的Na2CO3 .将他们放到90℃的
水浴中加热。几分钟后将Na2CO3分别加入到CuSO4 溶液中,震荡试管。观察现象,
比较各试管中沉淀的生成速度、沉淀的数量及颜色,以确定反应物溶液体积的最佳配比。
2.反应温度的探求
在5支试管中,各加入2.0mL0.5mol·L-1CuSO4溶液,另取5支试管,各加入由上述实验得到的合适用量的0.5mol·L-1Na2CO3溶液。从这两列试管中各取一支,
将它们分别置于80℃,85℃,90℃,95℃,100℃的恒温水浴中,数分钟后将Na2CO3溶液倒入CuSO4溶液中,振荡并观察现象,由实验结果确定合适温度。 3. 碱式碳酸铜的准备
由第1部分和第2部分的结果,在适宜的温度下用适宜的溶液比例,制取2.0g
的Cu2(OH)2CO3 。沉淀完全后,静置一段时间,抽滤。用蒸馏水洗涤沉淀数次,直至沉淀中不含SO42-为止。然后再用适量的无水乙醇洗涤一次。烘干,称量Cu2(OH)2CO3的质量。 4. 产品中铜含量的测定
1)准确称取0.1000(±0.0002)g碱式碳酸铜,加入2mol/L HCl,使试样完全溶解,定容于50ml容量瓶中,准确吸取10.00ml上述试液三份分别置于三个锥形瓶中. 2)与上述锥形瓶中加入2mol(1+1)HAc(从这里开始,分别处理每一样品). 4ml10%KI溶液,立即用0.0104mol/L Na2S2O3溶液滴定至浅黄色.再加入8滴0.5%淀粉水溶液指示剂,继续滴定至溶液呈浅灰色,加入5ml 10%KSCN溶液,滴定至蓝色消失为终点。平行测定三次。记录所消耗的V,计算铜的质量分数.
三、 实验结果及分析讨论
1. 溶液配比的探究
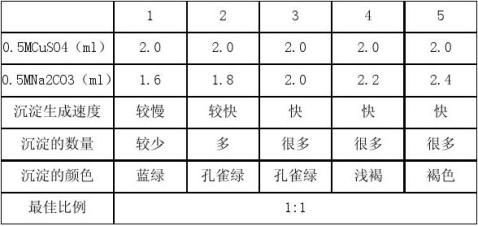
有表格可知,最佳配比为1:1。

2. 最佳反应温度的探究
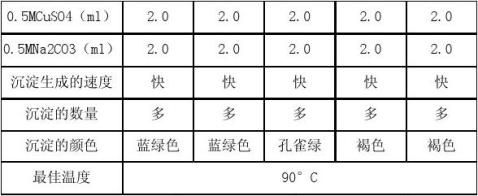
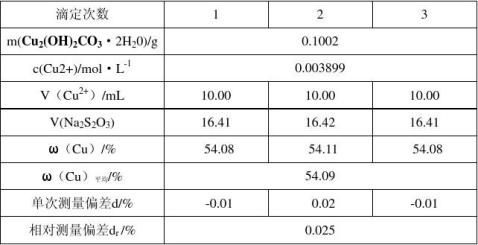
由上表可知,最是温度为90°C。 3. 碱式碳酸铜的制备
根据计算,取CuSO436mL, Na2CO3 36mL于两个100mL的小烧杯中,放在90℃
的水浴中加热数分钟,然后将Na2CO3溶液迅速倒入CuSO4 溶液并立刻搅拌。静置,烘干,称量后回收固体1.796g.固体颗粒很小,成粉末状,颜色为孔雀绿色。产率为89.80%。
4. 碱式碳酸铜中铜含量的测定
准确量取碱式碳酸铜0.10~0.15g,用适量HCl溶解后,转移到50mL容量瓶中
定容。用10.0mL移液管移取试液,用0.0104mol/L的Na2S2O3 按上述步骤滴定。结果如下:
四、 结论
1. CuSO4 与Na2CO3 的最佳反应比为1:1。 2. CuSO4 与Na2CO3 的最佳反应温度为90℃。
3. Cu2(OH)2CO3 中Cu的含量测量值为54.09% 略小于57.2%的理论值。这可能与结晶水的数目有关。
五、 讨论
1. 本实验的关键在于选择最适条件。实验主要探究了溶液的比例以及反应的温度对反应的影响,从而表明了条件控制的重要性。
2. 本实验最后测定铜的质量分数用的是碘量法,是采用沉淀法中的直接沉淀法。该法的优点是沉淀成分较单一,影响结果的因子相对较少,而其中的条件又相对易于控制。
六、参考文献
[1]催学桂 ,张晓丽主编.基础无机化学实验(无机及分析部分) [M] .山东:山东大学出版社 ,2000 ,8.
[2]北京师范大学无机化学教研室等主编.无机化学实验(高等学校试用教材) [M] .北京:高等教育出版社 ,1980 ,2.
[3]周宁怀主编.微型化学实验(高等院校选用系列教材) [M] .北京:科学教育出版社 ,2000 ,2.
[4]华中师范大学 ,东北师范大学等编.分析化学实验 - 3版[M] .北京:高等教育出版社 ,2001.
[5 ]武汉大学等编.无机化学 - 下册(高等学校教材) [M] .北京:高等教育出版社 ,1994 ,
