碱式碳酸铜的制备
碱式碳酸铜的制备
[教学目标]
1、通过碱式碳酸铜制备条件的探求和生成物颜色、状态的分析。
2、研究反应物的配料比并确定制备反应的温度条件
[教学重点及难点]
掌握制备反应条件的探求
[教学方法]
多媒体辅助讲授法,实验法
[教学时数]
30min学时
[教学过程]
一、实验原理
碱式碳酸铜的性质:
1、性质:暗绿色或淡蓝绿色
2、对热的稳定性:加热至200oC时分解。
3、在水中的溶解度:溶解度很小,新制备的样品在沸水浴中易分解,溶于稀酸和氨水。
讨论:1、哪些盐适合制备碱式碳酸铜?
现有几种制备方法如下:
第一种:利用硝酸铜与碳酸氢铵溶液反应制备碱式碳酸铜
优点:
1)条件易于控制,室温下即可进行制备;
2)副产物少,易于分离;
3)产物颗粒较大,品质好.
缺点:由于高温下碳酸氢铵容易分解使反应产率降低。
第二种:叶远安的沸水法制碱式碳酸铜,用CuSO4·5H2O和小苏打为原料,制得高纯度低成本的碱式碳酸铜,适于各类化工企业批量生产;但是由于条件难以控制,不适合在实验室采用。
第三种:以CuSO4·5H2O和Na2CO3为反应原料,无需准确的原料配比、pH值条件及反应温度 ,只须通过延长反应时间至48 h,常温下便可制得优质的碱式碳酸铜,既节约了能源、人力,该实验生产工艺简单、成本低。但是反应时间过长,不适合在实验室采用。
第四种:以CuSO4·5H2O和Na2CO3为反应原料,通过反应条件的探求制备出碱式碳酸铜,这样可以节约时间,同时采用成本低的原料,是可行的实验室制备方法。
综上所述,选用第四种方法制备碱式碳酸铜
二、实验用品
带标号的试管14只;烧杯(250mL);容量瓶(250mL);恒温水浴锅(YXS型,余姚长江温度仪表厂)。
三、实验内容
1、反应物配比的探究
1.1反应溶液的配置
配置0.5mol/L的CuSO4溶液和0.5mol/LNa2CO3溶液各250mL。
称取固体药品硫酸铜31.2l10g和碳酸钠13.2488g,分别倒入两个250mL的烧杯中,用100mL蒸馏水溶解,再转入250mL容量瓶中。配成250mL溶液。静置,备用。
1.2反应物合适配比
取四只已编号的试管(见图1),均加入2.0mL的0.5md/L的CuSO4溶液,再分别取0.5mol/LNa2CO3溶液1.6mL、2.0mL、2.4mL及2.8mL依次加入另外四只编号的试管中。将八只试管放在70℃恒温水浴中加热。几分钟后,依次将CuSO4溶液分别倒入Na2CO3溶液中,振荡试管,比较各试管沉淀生成的速度、沉淀的数量及颜色。
实验结果:
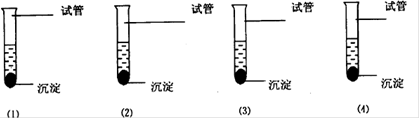
现象:(1)反应速度较慢,沉淀不完全, ,沉淀为蓝绿色
(2)反应速度慢,沉淀不完全,沉淀为蓝绿色
(3)反应速度较快,沉淀完全, 沉淀为蓝绿色
(4)反应速度较快,沉淀较完全,沉淀为浅蓝色
由上述现象推断CuSO4溶液:Na2CO3溶液=2.0:2.4,即1:1.2为反应物最佳配料比。
2、反应温度探求
在三只试管中(见图2),取三只已编号的式管,均加入2.0mL的0.5mol/L的CuSO4溶液,再取三只已编号的式管分别加入2.4mL0.5mol/LNa2CO3溶液。从两列试管中各取一只,将它们分别置于室温、50℃、10℃恒温水浴中加热。几分钟后,依次将CuSO4溶液分别倒入Na2CO3溶液中,振荡试管,比较各试管沉淀生成的速度、沉淀的数量及颜色。
实验结果:
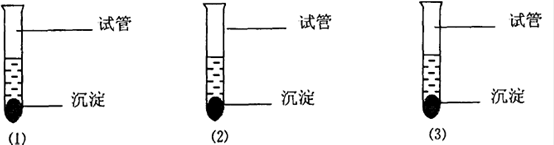 现象:
现象:
(1)反应速度较慢,沉淀不完全,沉淀为蓝色
(2)反应速度适中,沉淀较完全,沉淀为蓝绿色
(3)反应速度快,沉淀为浅蓝色,且有褐色沉淀生成
由上述实验现象可见。反应在50℃水浴中进行最佳。当反应在沸水浴中进行时,会产生褐色产物,这是由于碱式碳酸铜所含的成分中Cu(OH)2 受热易分解,即:Cu(OH)2 =CuO + H2O,生成了黑褐色的CuO沉淀。
通过以上实验,我们找到了制取碱式碳酸铜的最佳反应温度:50℃;反应物浓度:0.5mol/L的CuSO4溶液和0.5mol/LNa2CO3溶液,及反应物配料比:CuSO4溶液:Na2CO3溶液1:1.2。
3、制备过程设计
3.1取60m10.5mol/L的CuSO4溶液置于150mL烧杯中,再取72mL0.5mol/L Na2CO3溶液于另一个150mL烧杯中。将两个贴有标签的烧杯同时放到50℃恒温水浴中加热,几分钟后取出。
3.2 将两个烧杯取出,将CuSO4溶液倒入Na2CO3溶液中,用玻璃棒搅拌,静置,待沉淀完全。
3.3 用蒸馏水洗涤沉淀数次,直到沉淀中不含硫酸根离子为止(可取上层清液少许置于小试管中,滴加几滴BaCl2溶液,观察有无白色沉淀),抽滤。
3.4 将产品在烘箱中(100℃)烘干,待冷至室温后称量,并计算产率。
四、本实验应注意的问题
1、反应温度不应超过100℃ ,且反应时要恒温且不断搅拌,否则会出现部分颜色变黑的现象;
2、沉淀要洗涤干净;
3、反应过程中不可将Na2CO3溶液倒入CuSO4溶液中。
[实验习题]
1、反应温度对本实验有何影响?
2、反应在何种温度下进行会出现褐色产物?这种褐色产物是什么?
第二篇:实验 甲酸铜的制备
甲酸铜的制备及其组成的测定
2011级化院环境科学二班——张雷
学号---20116113
前言
①用废铜屑制备甲酸铜可以节省精铜的用量,环保,而且还可以废物利用
②由废铜屑制得五水硫酸铜有很多的方法,都不近相同,但也都有本质的区别,可以将废铜屑→硝酸铜→硫酸铜。但在转化成硝酸铜时会产生污染性气体,会对环境产生危害。再比如废铜屑→氧化铜→硫酸铜,在转化成氧化铜时就相当困难,铜的性质相当稳定,普通的酒精灯几乎是很难办到的。而废铜屑用硫酸和过氧化氢却可以实施。但其唯一的缺点是反应速度过慢。
③在测定其组成成份的时候,可以用吸光光度法,也可以用EDTA准确测定铜盐中铜的含量。而第二种方法所需试剂颇多,而且方法繁冗,实施起开较为困难。但是第一种方法是前几次实验课做过的,所需数据也有所记录,所以本实验用的是吸光光度法进行分析实验。
实验药品的配制
(1)KMnO4溶液的配制:准确称取0.9 g的KMnO4,置于500 mL烧杯中,加入200 mL蒸馏水,加热至沸,使其溶解,冷却后,稀释至300 mL摇匀,在暗处放置6到7天,用玻璃砂芯漏斗过滤,除去MnO2沉淀,储存在棕色试剂瓶中,摇匀后即可标定使用。
(2)Na2S2O3溶液的配制:称取12.5 g的Na2S2O3;5H2O于烧杯中,加入100mL250 mL的蒸馏水将其溶解,加入0.05 g的碳酸钠,再稀释至500mL,储存在暗处3到5天后标定。
(3)淀粉溶液:称取0.5 g可溶性淀粉用少量水搅拌溶解,加入100mL沸水,煮沸2到3 min
(4)用溶质质量分数为98%的浓硫酸(密度为1.84g/cm3),配制50mL 20%的稀硫酸(密度为1.14g/cm3),应先在烧杯中倒入水45.4 mL,再将6.3 mL 98%的浓H2SO4慢慢注入水中,并不断搅拌。
实验方案
一、甲酸铜的制备
(1)、五水硫酸铜的制备
称取5g废铜屑、50 mL 20% H2SO4溶液和30%H2O2,溶解于100mL烧杯中,待反应完全后减压过滤,抽滤,至干,称重。
(2)、碱式碳酸铜的制备
称取CuSO4·5H2O和NaHCO3比例为12.5:9.5于研钵中,磨细和混合均匀。在快速搅拌下将混合物分多次小量缓慢加入到100mL近沸的蒸馏水(此时停止加热)。混合物加完后,再加热至沸数分钟。静置澄清后,用倾析法洗涤沉淀。抽滤,用水淋洗至溶液无SO42-,称重。得到蓝绿色晶体(所得产物为碱式碳酸铜)。
(3)、甲酸铜的制备
将前面所制得的产品放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量甲酸至沉淀完全溶解(所需甲酸量自行计算),趁热过滤。滤液在通风橱下蒸发至原体积的1/3左右。冷至室温,减压过滤,用少量乙醇洗涤晶体2次左右,抽滤,至干,得Cu(HCOO)2·4H2O产品,称重,计算产率。
二、甲酸铜中铜的测定
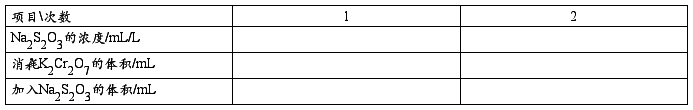
(1)Na2S2O3溶液的标定
用指定称量法称取1.2258 g K2Cr2O7于小烧杯中,加水溶解定量转移至250 mL容量瓶中加水稀释至刻度线,摇匀。准确移取25.00 mL标准溶液于锥形瓶中,加入5 mL 6 mol/L HCl溶液,5 mL 200g/L KI溶液摇匀放在阴暗处5分钟,待反应完全后,加入100 mL蒸馏水,用待标定的Na2S2O3滴定至淡黄色,然后加入3 mL 5 g/L 淀粉指示剂,继续滴定至呈现亮绿色为终点。计算Na2S2O3的东渡浓度。
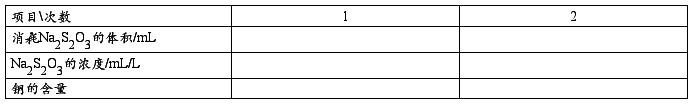
(2)铜盐中铜含量的测定
准确称取甲酸铜0.6 g 溶解于小烧杯中,定量转移至250 mL容量瓶中,取25.00mL于锥形瓶中,8 mL(1:1) 醋酸溶液,加入1 g NH4HF2加入10 mL KI 溶液,用Na2S2O3滴定至浅黄色,再加入3 mL 5 g/L 淀粉至浅蓝色,再加入10mL KSCN(100 g/L),滴定至蓝色消失,计算铜的含量。
三、甲酸铜中加酸根的测定
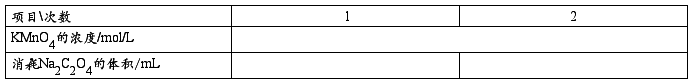
(1)KMnO4-溶液的标定
准确称取Na2C2O4(0.15-0.18g),分别放于250mL锥形瓶中,加入50mL蒸馏水,溶解后,加入15mL 的稀硫酸,从滴定管中放出10.00mL KMnO4,水浴加热80度左右至红色退去,再用KMnO4滴定至微红色30s内不褪色,计算其浓度。

(2)甲酸根含量的测定
用移液管移取25.00 mL的甲酸铜标准溶液和0.2 g无水碳酸钠,50.00 mL KMnO4溶液用水浴加热至80度左右至颜色变浅为止,加入10 mL 4 mol/L硫酸,2.0 g碘化钾,在暗处放置5 min,再加淀粉指示剂,用Na2S2O3标准溶液滴定。趁热用Na2C2O4滴定至刚好蓝色消失。
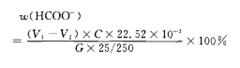
 1
1
数据处理与讨论
1、
 。其余全部出自教材。
。其余全部出自教材。
