中宁职业教育培训中心
赛位号:______________ 成绩:______________
_______________________________________________________________________________
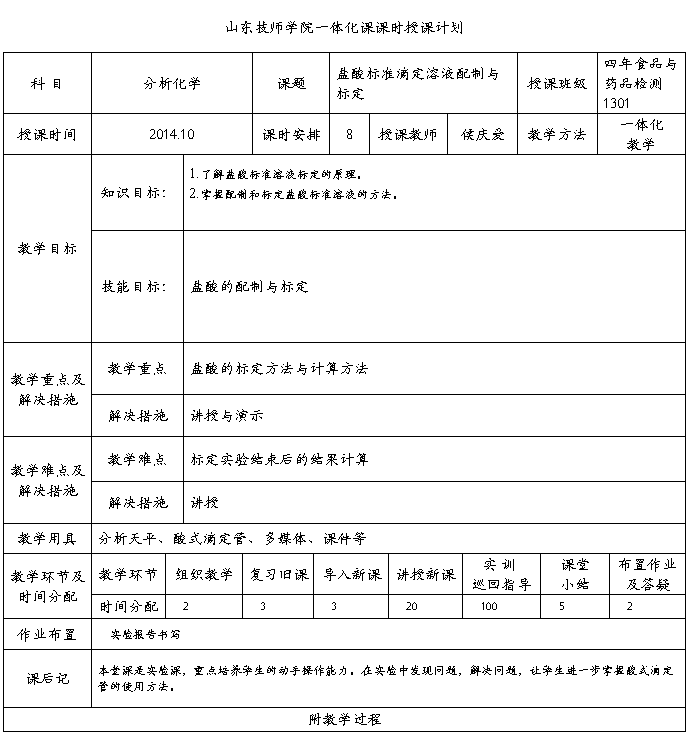
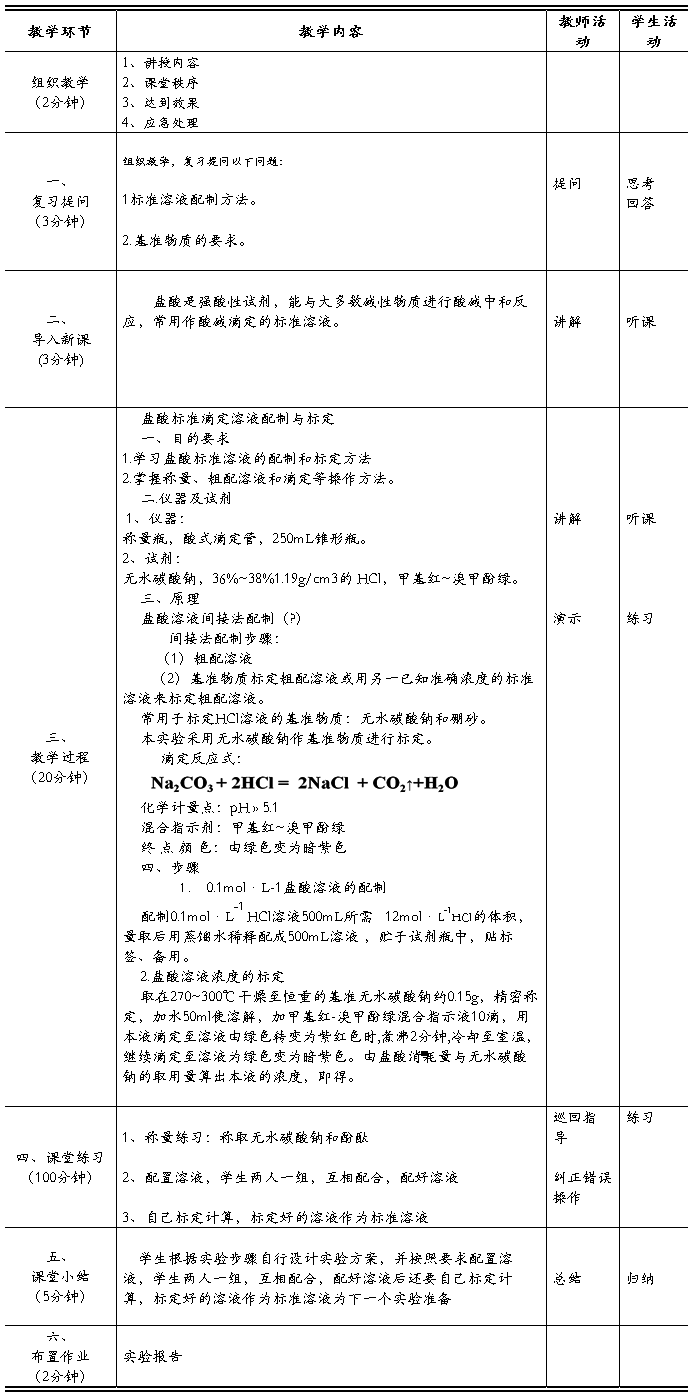
竞赛题目:盐酸标准溶液的配制与标定
一、目的要求
1. 练习溶液的配制和滴定的准备工作,训练滴定操作,进一步掌握滴定操作。
2. 学会用基准物质标定盐酸浓度的方法。
3. 了解强酸弱碱盐滴定过程中 pH 的变化。
4. 熟悉指示剂的变色观察,掌握终点的控制。
二、实验原理
市售盐酸为无色透明的HCl水溶液,HCl含量为36%~38%(W/W),相对密度约为1.18。由于浓盐酸易挥发出HCl气体,若直接配制准确度差,因此配制盐酸标准溶液时需用间接配制法。
标定盐酸的基准物质常用碳酸钠和硼砂等,本实验采用无水碳酸钠为基准物质,以甲基红-溴甲酚绿混合指示剂指示终点,无水碳酸钠作基准物质的优点是容易提纯,价格便宜。缺点是碳酸钠摩尔质量较小,具有吸湿性。因此Na2CO3固体需先在270℃~300℃高温炉中灼烧至恒重,然后置于干燥器中冷却后备用。
计量点时溶液的 pH为3.89,用待标定的盐酸溶液滴定至溶液由绿色变为暗红色后煮沸2 min,冷却后继续滴定至溶液再呈暗红色即为终点。根据Na2CO3的质量和所消耗的 HCl 体积,可以计算出HCl的准确浓度。
用Na2CO3标定时反应为:2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
反应本身由于产生H2CO3会使滴定突跃不明显,致使指示剂颜色变化不够敏锐,因此,接近滴定终点之前,最好把溶液加热煮沸,并摇动以赶走CO2,冷却后再滴定。
三、实验用品
分析天平(感量0.01mg/分度),量筒,称量瓶,25mL酸式滴定管,250mL锥形瓶。
工作基准试剂无水Na2CO3:先置于270℃~300℃高温炉中灼烧至恒重后,保存于干燥器中。浓HCl(浓或0.1mol/L),
溴甲酚绿(3.8-5.4)一甲基红(4.4-6.2)指示液(变色点pH=5.1):溶液 Ⅰ: 称取0.1 g 溴甲酚绿,溶于乙醇(95%),用乙醇(95%)稀释至100m L;溶液 Ⅱ; 称取0.2 g 甲基红,溶于乙醇(95%),用乙醇(95% )稀释至100m L;取 30 m L溶液I, 10m L溶液Ⅱ,混匀。
四、实验步骤
(1)0.1mol.L-1盐酸溶液的配制: 用小量筒取浓盐酸3.6ml,加水稀释至400ml混匀即得.
(2) 盐酸标准滴定溶液的标定
取在270~300℃干燥至恒重的基准无水碳酸钠约0.12~0.14g,精密称定3份,分别置于250ml锥形瓶中,加50ml蒸馏水溶解后,加甲基红-溴甲酚绿混合指示剂10滴,用盐酸溶液(0.1mol·L-1)滴定至溶液又由绿变紫红色,煮沸约2min。冷却至室温(或旋摇2min)继续滴定至暗紫色,记下所消耗的标准溶液的体积, 同时做空白试验
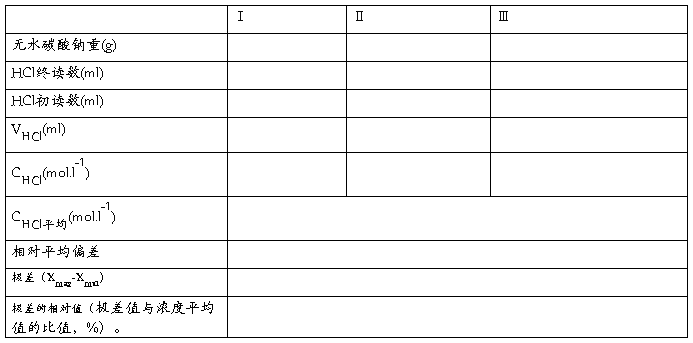
五、实验结果
(1)数据记录
(2)结果计算
盐酸标准滴定溶液的浓度[c(HCl)].数值以摩尔每升(mol/L)表示,按下式计算:
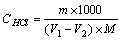
式中 : m — 无水碳酸钠的质量的准确数值,单位为克(g);
V1— 盐酸溶液的体积的数值,单位为毫升(mL);
V2 — 空白试验盐酸溶液的体积的数值,单位为毫升(mL)
M— 无水碳酸钠的摩尔质量的数值,单位为克每摩尔(g/mol),[(1/2Na2CO3)=52.994]。 CHCl =? MNCO3=105.99
计算步骤:
第二篇:16. 盐酸配制与标定一体化教案