第九章 羧酸及其衍生物
一、选择
1、下列物质中不属于羧酸衍生物的是( )
A、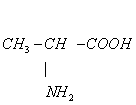 B、
B、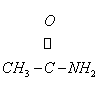
C、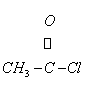 D、
D、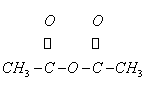
2、下列化合物中不与格氏试剂反应的是( )
A、乙醇 B、乙醛
C、环氧乙烷 D、绝对乙醚
3、下列化合物酸性最强的是( )
A、CH3CH2OH B、CH3COOH
C、HOOC-CH2-COOH D、HOOC-COOH
4、下列化合物沸点最高的是( )
A、CH3(CH2)2OH B、CH3 CH2 CH2CHO
C、CH3 CH2 CH2 CH2 CH3 D、CH3 CH2COOH
5、下列化合物中既能使高锰酸钾溶液褪色,又能使溴水褪色,还能与NaOH发生中和反应的化合物是( )
A、CH2=CH-COOH B、CH3- CH3
C、CH2= CH2 D、CH3 CH2OH
6、下列化合物中既能与托伦试剂发生银镜反应,又能与碳酸钠反应的是( )
A、乙醇 B、乙醛
C、甲酸 D、乙二酸
二、命名
1、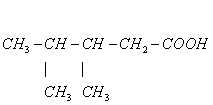
2、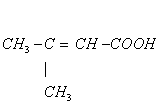
3、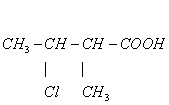
4、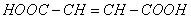
5、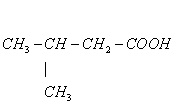
6、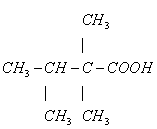
7、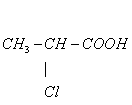
三、完成反应
1、
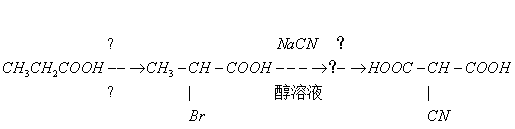
2、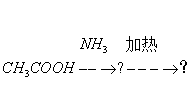
3、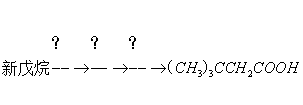
4、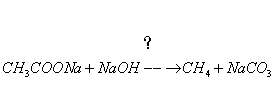
5、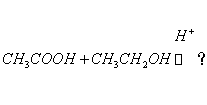
四、鉴别。
1、 甲酸、乙酸、乙醛
2、 乙酸、丙二酸
五、推断
化合物A、B的分子式均为C3H6O2。A能与NaCO3作用放出CO2,B、在氢氧化钠溶液中加热发生水解,B的水解产物之一能发生碘仿反应,另一个能与托伦试剂发生银镜反应,试推断A、B的结构。
第二篇:(新)实验四_苯及其衍生物的紫外光谱测定 4 齐齐哈尔大学化学专业实验报告物化
实验四 苯及其衍生物的紫外光谱测定
实验目的
1.用紫外分光光度汁测定苯及其衍生物的紫外吸收光谱,计算跃迁能。
2.掌握TU-1900型分光光度计的使用方法。
实验原理
原子或分子中的电子(成键电子、反键电子,孤对电子、游离基电子等)当受到光、热、电等的激发,从一个能级转移到另一个能级,称为跃迁。这种跃迁所需要的能量称为跃迁能;原子或分子中电子的跃迁能级与电磁波中某一光子的能量相一致时就会发生能级跃迁,即
 (2-1)
(2-1)
式中:h为普朗克常数;c为光速;λmax为最大吸收波长。
因此,电子激发所对应的光子的能量,可用相对吸收的光频率或波长来表示。
从分子的成键情况看,与吸收光谱有关的电子主要有三种:(1)形成单键的σ电子;(2)形成复键的π电子;(3)非键n电子。根据分子轨道理论,三种电子的能级高低次序一般是:
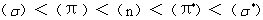 (2-2)
(2-2)
分子在大多数有机化合物中,电子总是填充在n轨道以下的各个分子轨道中。当受到外来辐射的激发时,处于较低能级的电子就跃迁到较高的能级。由于各个分子轨道之间的能量差不同,各个不同的跃迁所需吸收的能量也不同,见图1.
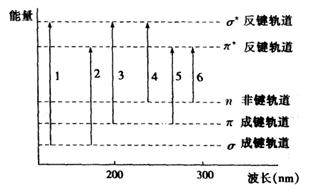
图1 各种电子跃迁相应的吸收峰和能量示意图
1.σ-σ*跃迁;2.σ-π*跃迁;3.π-σ*跃迁;4.n-σ*跃迁;5.π-π*跃迁;6.n-π*跃迁
当分子中含有σ键电子时,σ-σ*跃迁需要的能量大,吸收光谱在远紫外区, <150nm。一般仪器不易测量。饱和碳氢化合物就属于这一类。然而,当饱和碳氢化合物中含有氧、氮、硫、卤素等杂原子时,由于其中含有孤对电子,因而可发生n-σ*跃迁,其吸收峰向长波方向移动。有些已进入近紫外区,一般紫外分光光度计即可测定。当分子中含有双键、共轭双键、三键、杂原子双键等助色基团时,其中不仅还有孤对电子,而且有π键电子,吸收峰不但向长波方向移动,而且吸收波强度增强。
<150nm。一般仪器不易测量。饱和碳氢化合物就属于这一类。然而,当饱和碳氢化合物中含有氧、氮、硫、卤素等杂原子时,由于其中含有孤对电子,因而可发生n-σ*跃迁,其吸收峰向长波方向移动。有些已进入近紫外区,一般紫外分光光度计即可测定。当分子中含有双键、共轭双键、三键、杂原子双键等助色基团时,其中不仅还有孤对电子,而且有π键电子,吸收峰不但向长波方向移动,而且吸收波强度增强。
各种物质分子的能级千差万别,它们内部各种能级之间的间隔也就各异。因此,物质的内部结构决定了它们对不同波长光的选择吸收。如果我们逐渐改变通过某一吸收物质的入射光的波长,并记录该物质在每一波长的消光度(A)。以吸光度对波长作图,即可得到该物质的吸收光谱。
仪器与试剂
TU-1900双光束紫外可见分光光度计,移液管(2mL)4支,微量注射器(500,50μL)各2支,容量瓶(100, 10mL)各4个。
无水乙醇(AR),苯甲醛(AR),苯(AR),氯苯(AR),苯胺(AR)。
操作步骤
1.用100mL容量瓶分别配制0.1mol/L的苯、氯苯、苯甲醛和苯胺的乙醇溶液。在10mL的容量瓶中,分别取上述配制的溶液,配制浓度为2×10-3mol/L的苯和氯苯的乙醇溶液,浓度为2×10-4mol/L的苯甲醛和苯胺的乙醇溶液。(注意:配制试样溶液时,浓度尽量接近规定浓度。浓度太高或太低都会使某些吸收峰测不出来,致使测得的紫外光谱不理想。)
2.接通仪器的电源,预热仪器30min。
3.将待测试样装入1cm的石英比色皿中,盖好比色皿盖,置于光路中(以无水乙醇作参比)。
4.按照TU-1900型双光束紫外可见分光光度计说明在200~300nm波长范围内对各样品进行扫描。
5.测试完毕后,倒掉试液(指定废液缸中),清洗比色皿,关闭仪器。
6.TU-1900双光束紫外可见分光光度计的操作系统全部由微机控制,具体的操作步骤,需要在教师的指导下完成,有关操作的详细内容参见仪器说明。
数据处理
(1) 绘制苯、苯甲醛和苯胺的消光度与波长曲线
(2) 分别找出最大吸收波长及其消光值。
由有图知:
苯胺:λmax = 293.782654 消光度值是2.03727885
苯甲醛:λmax =289.916405 消光度值是1.37910699
苯 :λmax =288.662487 消光度值是0.0999382196
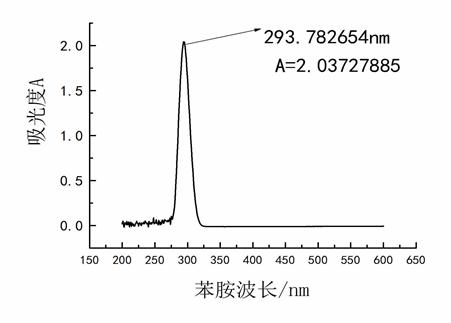
图一 苯胺的消光度与波长曲线
(3)按(2-1)式计算各物质的电子跃迁能,根据光谱图各物质分子内电子能级发生了什么类型的跃迁?并说明助色团的作用。
∵ ΔE=E2-E1=hν=h h=6.626×10-34 ?·s C=3.0×108 m·s-1
h=6.626×10-34 ?·s C=3.0×108 m·s-1
∴ ΔE苯胺=6.626×10-34 ×3.0×108 ÷ 293.782654 = 6.766×10-28 J
ΔE苯甲醛=6.626×10-34 ×3.0×108 ÷ 289.916405 =6.85 ×10-28 J
ΔE苯 =6.626×10-34 ×3.0×108 ÷ 288.662487=6.886 ×10-28 J
由光谱图可以知道苯、苯甲醛、苯胺的分子内电子能级都发生了n—σ*和π*—π*跃迁,苯甲醛和苯胺还发生了n—π*跃迁。
助色基团上含有孤电子对,会使吸收峰向长波长方向移动,而且吸收波强度增强。
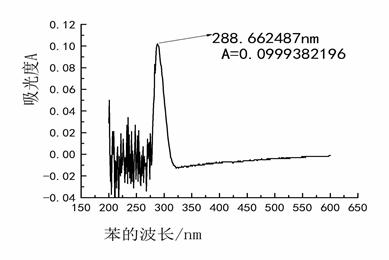
图二 苯消光度与波长曲线
思考题
1.计算摩尔消光度有何作用?
答:可以通过吸光度了解不同结构的物质对光的吸收强度。摩尔吸光度越大,吸收
强度越大
2.摩尔消光度的大小与哪些因素有关?
答:各种物质分子的能级千差万别,它们内部各种能级之间的间隔也就各异。
因此,物质的内部结构决定了它们对不同波长光的选择吸收。对于不同波长 的光的吸收强度也就不同 ,因此摩尔吸光度和化合物结构有关。
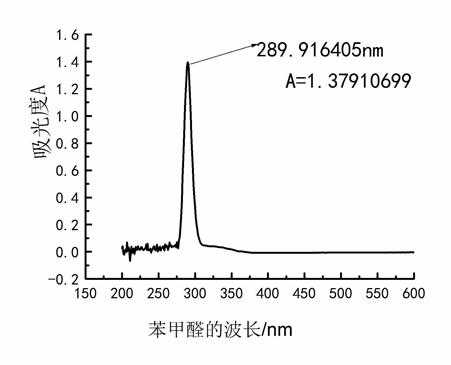
图三 苯甲醛消光度与波长曲线
