羧酸及其衍生物的性质
目的
验证羧酸及其衍生物的主要化学性质。
原理
羧酸最典型的化学性质是具有酸性,酸性比碳酸强,故羧酸不仅溶于氢氧化钠溶液,而且也溶于碳酸氢钠溶液。饱和一元羧酸中,以甲酸酸性最强,而低级饱和二元羧酸的酸性又比一元羧酸强。羧酸能与碱作用成盐,与醇作用成酯。甲酸和草酸还具有较强的还原性,甲酸能发生银镜反应,但不与裴林试剂反应。草酸能被高锰酸钾氧化,此反应用于定量分析。
羧酸衍生物都含有酰基 结构,具有相似的化学性质。在一定条件下,都能发生水解,醇解、氨解反应,其活泼性为:酰卤>酸酐>酯>酰胺。
药品
甲酸,乙酸,冰乙酸,草酸,苯甲酸,硫酸(3mol·L-1),盐酸(6mol·L-1),乙酰氧,乙酸酐,乙酸乙酯,乙酰胺,无水乙醇,饱和碳酸钠溶液,氢氧化钠溶液(5%,20%),硝酸银溶液(5%),三氯化铁(1%),苯胺(新蒸),刚果红试纸。
实 验 步 骤
[一] 羧酸的性质
1.酸性试验 在3支试管中,分别加入5滴甲酸、5滴乙酸,0.2g草酸,各加入lmL蒸馏水,振摇使其溶解。然后用玻璃棒分别蘸取少许酸液,在同一条刚果红试纸上划线。比较试纸颜色的变化和颜色的深浅,并比较三种酸的酸性强弱。
2. 成盐反应
[1] 苯甲酸钠的生成与分解。取0.2G苯甲酸晶体,加入lmL水,振摇后观察溶解情况。然后滴加几滴20%NaOH溶液,振摇后观察有什么变化。再滴加几滴6mol·L-1盐酸溶液,振摇后再观察现象。
[2] 乙酸铁的形成与分解。在试管中滴入3滴冰乙酸并加入2mL水,用5%NaOH溶液中和至中性(碱不要过量),然后加1滴1%FeCL3溶液,振摇后,观察溶液呈现的颜色。再加热煮沸1~2分钟,观察发生何种变化[2]。
3. 成酯反应 在干燥试管中,加入1mL无水乙醇和1mL冰乙酸,并滴加3滴浓H2SO4。摇匀后放入70~80℃水浴中,加热10分钟(也可在直接火上加热,微沸2~3分钟)。放置冷却后,再滴加约3mL饱和Na2CO3溶液,中和反应液至出现明显分层,并可闻到特殊香味。
4. 甲酸的还原性(银镜反应):准备3支洁净试管中加入1mL20%NaOH溶液[3],并滴[1]
加5~6滴甲酸溶液。
在第2支试管中,加入1mL(1∶1)氨水,并滴入5~6滴5%AgNO3溶液。再取第3支洁净试管,将上述两种溶液一并倒入其中,并摇匀。若产生沉淀,则补加几滴氨水,直至沉淀完全消失,形成无色透明溶液。然后,将试管放入90~95℃水浴中,加热10分钟,观察银镜的析出。
二 羧酸衍生物的性质
1.水解反应
(1)乙酰氯的水解。在试管中加入1mL蒸馏水,沿管壁慢慢滴加3滴乙酰氯,略微振摇试管,乙酰氯与水剧烈作用,并放出热(用手摸试管底部)。待试管冷却后,再滴加1~2滴2%AgNO3溶液,观察溶液有何变化。
(2)乙酸酐的水解。在试管中加入lmL水,并滴加3滴乙酸酐,由于它不溶于水,呈珠粒状沉于管底。再略微加热试管,这时乙酸酐的珠粒消失,并嗅到何种气味。说明乙酸酐受热发生水解,生成了何种物质。
(3)酯的水解。在三支试管中,分别加入1mL乙酸乙酯和1mL水。然后在第1支试管中,再加入0.5mL3mol·LH2SO4,在第2支试管中再加入0.5mL20%NaOH,将三支试管同时放入70~80℃的水浴中,一边振摇,一边观察并比较酯层消失的快慢。
(4)酰胺的水解
碱性水解。在试管中加入0.2g乙酰胺和2mL20%NaOH溶液,小火加热至沸,嗅氨的气味并可在试管口用润湿的试纸检验。
酸性水解。在试管中加入0.2g乙酰胺和2m13mol.LH2SO4小火加热至沸,闻一闻-1-1
有无乙酸的气味。冷却后加入10%NaOH溶液至碱性,再加热并嗅其气味(或用试纸检验)。
2.醇解反应
(1)乙酰氯的醇解。在干燥的试管中加入1mL无水乙醇,在冷却与振摇下沿试管壁慢慢滴入1mL乙酰氯。反应进行剧烈并放热,待试管冷却后,再慢慢加入约3mL饱和Na2CO3溶液中和至出现明显的分层,并可闻到特殊香味。
(2)乙酸酐的醇解。在干燥的试管中加入1mL无水乙醇和1mL乙酸酐,混匀后,再加3~4滴浓硫酸。振摇下在小火上微沸。放置冷却后,慢慢加入约3mL饱和Na2CO3溶液中和至析出酯层,并可闻到特殊香味。
3.胺解反应
(1)在干燥试管中加入0.5mL新蒸苯胺,再滴加0.5mL乙酰氯,振摇后,用手摸试管底部有无放热。然后,再加入2~3mL水,观察有无结晶析出。
(2)在干燥试管中加入0.5mL新蒸苯胺,再滴加0.5mL乙酸酐,振摇并用小火加热几分钟,冷却后,加入2~3mL水,观察有无结晶析出。
注释 [4]
[1]刚果红试纸与弱酸作用呈棕黑色,与中强酸作用呈蓝黑色,与强酸作用呈稳定的蓝色。
[2]3NaAc+FeCl3→FeAc3+3NaCl,生成的乙酸铁立即部分水解成碱式六乙酸铁络离子
[Fe3(OH)2Ac6]+1C1-1,使溶液呈淡红棕色。煮沸时进一步水解,生成不溶于水的碱式乙酸铁Fe(OH)Ac2呈红棕色絮状沉淀。
[3]甲酸的酸性较强,假使直接加到弱碱性的银氨溶液中,银氨络离于将被破坏,析不出银镜,故需用碱液中和甲酸。
[4]乙酰氯与醇反应十分剧烈,并有爆破声。滴加时要慢,一滴一滴加入,防止液体从试管内溅出。
思 考 题
1.在羧酸及其衍生物与乙醇反应中,为什么在加入饱和碳酸钠溶液后,乙酸乙酯才分层浮在液面上?
2.为什么酯化反应中要加浓硫酸?为什么碱性介质能加速酯的水解反应?
3.甲酸具有还原性,能发生银镜反应。其它羧酸是否也有此性质?为什么?
4.根据实验事实,比较各种羧酸衍生物的化学活泼性。
第二篇:羧酸及其衍生物的物理性质
目前位置:首页—>羧酸及其衍生物—>K2 羧酸及其衍生物的物理性质
羧酸及其衍生物的物理性质
教学目标:
1.了解羧酸一般物理性质及其影响因素。
2.掌握羧酸及其衍生物 IR 特征。
教学重点:IR特征
教学安排:B5, K1—>K2;10min
一、一般物理性质
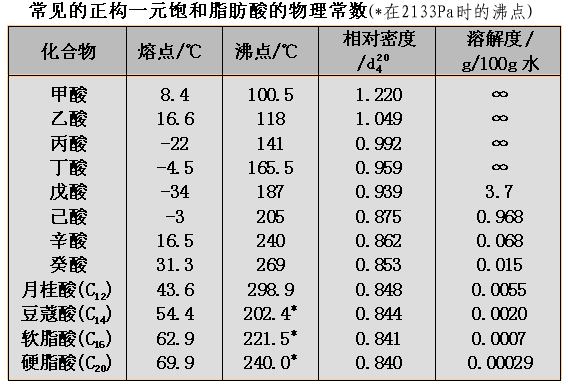
低级的一元羧酸(C1-C9)是液体,C1-C3的羧酸有一定挥发性,并且有较强的刺激性;C4-C9的羧酸不同程度地具有腐败气味,并且是具有一定粘度的油状液体。C10以上的羧酸则是石蜡状固体,气味很小。二元羧酸以及芳香族羧酸都是晶体。
羧酸的沸点较分子量相近的醇高,这是由于羧基的强极性和分子间的氢键所致。在气态时,甲酸、乙酸等是以双分子缔合形态出现。与烷烃相似,偶数碳原子的羧酸其熔点要比与之相邻的奇数碳原子羧酸的熔点高。
C1-C4 的正构羧酸由于分子的极性大,与水分子可很好地形成氢键,所以它们的溶解度很大;但正戊酸在水中的溶解度只有3.7g/100g水。高级的一元酸在水中的溶解度非常小,甚至不溶于水。常见的二元酸在水中都有很好的溶解度。
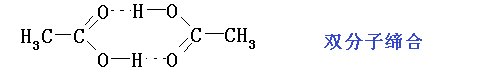
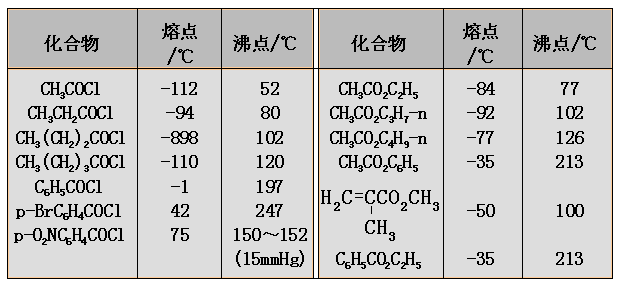
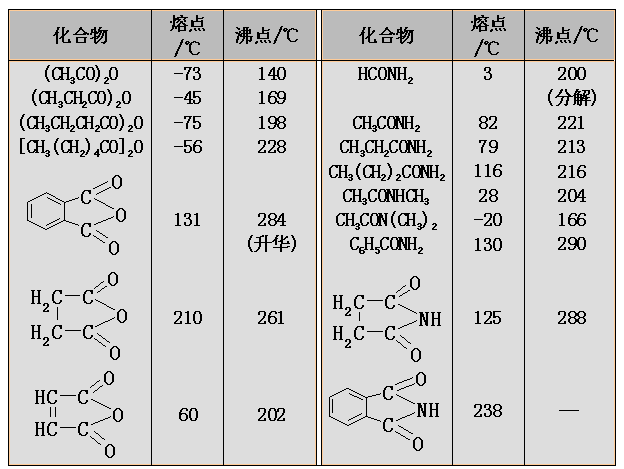
酰氯、酸酐和酯的沸点与分子量相近的醛酮大体相近,酰胺由于分子间可形成氢键,而具有很高的沸点。低级的酯和酰胺在水中有一定的溶解度;但低级的酰氯和酸酐在水中容易发生水解。一般情况下,酰氯和酯的熔点比较低,酰胺的熔点较高,不同的酸酐的熔点变化是较大的。
低级的酰氯和酸酐都有刺鼻气味,而低级的酯却有芳香气味并可用作香料;低级的酰胺是良好的非质子型极性溶剂。常见的羧酸及其衍生物在一般的有机溶剂中有良好的溶解性。
一些常见的羧酸衍生物的熔点和沸点如下表:
二、光波谱性质
由于羧酸分子的羟基之间可形成氢键,在 3300cm-1 处有非常强而宽的羟基的特征峰,并且该峰可含盖烃基中的 CH3 和 CH2 的 C-H 键伸缩振动吸收峰的区域;在 2500-2700cm-1 处,还有 O-H 键的伸缩振动。另外,OH 的弯曲摆动(面外摇摆)在 925cm-1 处有一个比较宽的特征吸收峰。脂肪族羧酸中的羰基在 1700-1725cm-1 处有中等强度的吸收,而芳香族羧酸的羰基在 1680-1700cm-1 处有吸收。在羧酸的各种衍生物中,羰基在红外光谱中出现吸收的位置是不同的,羰基越缺电子,吸收波数越高;羧酸根据负离子的红外吸收波数是最低的。 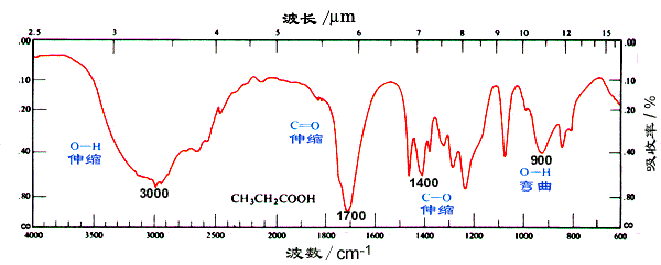
丙酸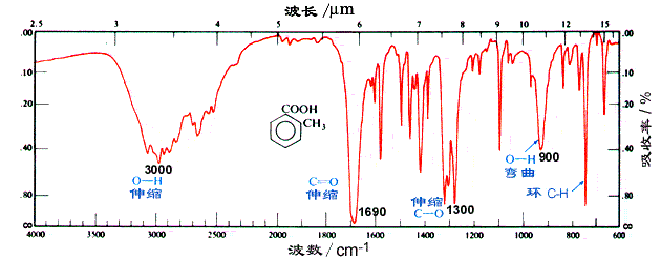
邻甲苯甲酸
邻甲苯甲酰氯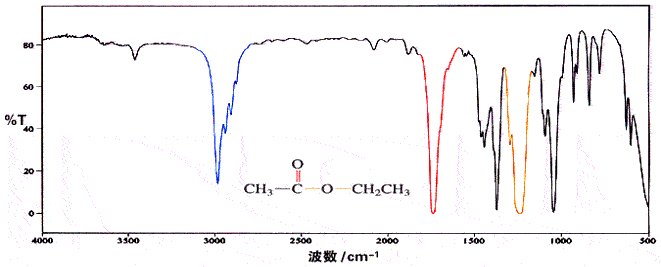
乙酸乙酯
邻甲苯甲酰氯
乙酸乙酯
x羰基的影响下,其化学位移多在δ=2.2-2.5。
三、关键词
羧酸的物理性质、羧酸的光波谱性质
