铜合金含量的测定
项目一:铜合金中锌含量的测定
一、实验目的
1、掌握铜合金中锌含量测定的原理与方法
二、实验原理
试料以盐酸—过氧化氢溶解,在微酸性溶液中以氯化钡和硫酸钠溶液掩蔽铅,氟化钠掩蔽铁、铝,硫脲掩蔽铜,在pH=5~6介质中,以二甲酚橙为指示剂,用EDTA标准溶液滴定。
三、实验仪器与试剂
仪器:锥形瓶、胶头滴管、电炉、碱式滴定管、移液管、电子天平
试剂:盐酸溶液(1+1)、30%过氧化氢、氯化钡溶液(10%)、硫酸钠溶液(100g/L)、氟化钠固体、饱和硫脲溶液、甲基橙指示剂、六亚甲基四胺,二甲酚橙、EDTA标准溶液
四、实验步骤
精密称取0.1~0.2g样品,置于250mL容量瓶中,加入5mL盐酸溶液(1+1),2mL30%过氧化氢溶液,加热溶解并蒸发至近干。加入50mL水,5mL氯化钡溶液,10mL硫酸钠溶液,1.5g氟化钠,溶解后加入15mL饱和硫脲溶液,滴加1滴甲基橙,用六亚甲基四胺滴至红色消失并过量10mL。再加入3滴二甲酚橙,以EDTA滴定至红色消失。
五、实验结果与讨论
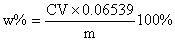
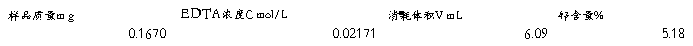
讨论:此次实验结果较好,与样品本身含量一致
项目二:铜合金中铅含量的测定
一、实验目的
1、掌握铜合金中铅含量测定的方法与原理
二、实验原理
试料以盐酸—过氧化氢溶解,硫脲掩蔽铜,以二甲酚橙为指示剂,用EDTA标准溶液滴定。
三、实验仪器与试剂
仪器:电子天平、烧杯、电炉、滴管、量筒、移液管、碱式滴定管、容量瓶、锥形瓶
试剂:盐酸溶液(1+1)、30%过氧化氢、100g/L硫脲溶液、六亚甲基四胺,二甲酚橙、EDTA标准溶液、抗坏血酸、亚铁氰化钾、
四、实验步骤
精密称取0.2g样品,置于烧杯中,加入5mL盐酸溶液(1+1),2mL30%过氧化氢溶液,加热并煮沸1min,冷却定容至50mL的容量瓶中。移取15mL试液于250ml的锥形瓶中,加入20mL水,加入30mL硫脲溶液,10mL抗坏血酸,振荡1min,加30mL酒石酸钾钠,30mL六亚甲基四胺,5mL亚铁氰化钾,再加入8~10滴二甲酚橙指示剂,用EDTA滴定至红色消失。
五、实验结果
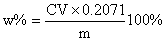
样品:0.1924g——50mL EDTA浓度0.02171mol/L

第二篇:铜合金中铜的测定
实验十五 铜合金中铜的测定(间接碘量法)
一 实验目的
1 掌握Na2S2O3溶液配制及标定
2 了解淀粉指示剂的作用原理
3 了解间接碘量法测定铜的原理
4 学习铜含量试样的分解方法
二 实验原理
1 铜合金的分解 铜合金的种类较多,主要有黄铜和各种青铜等。试样可以用HNO3分解,但低价氮的氧化物能氧化I-而干扰测定,故需用浓H2SO4蒸发将它们除去。也可用H2O2和HCl分解试样:Cu + 2HCl + H2O2 = CuCl2 + 2H2O 煮沸以除尽过量的H2O2
2 含量的测定
<1> Cu2+与过量碘化钾的反应;
在弱酸性溶液中,Cu2+与过量 KI作用,生成CuI沉淀,同时析出定量的 I2:
2Cu2+ + 4I- = 2CuI¯ + I2 或 2Cu2+ + 5I-= 2CuI ¯+ I3- 通常用HAc-NH4Ac或NH4HF2等缓冲溶液将溶液的酸度控制为pH=3.5~4.0,酸度过低,Cu2+易水解,使反应不完全,结果偏低,而且反应速率慢,终点拖长;酸度过高,则I-被空气中的氧氧化为I2(Cu2+催化此反应),使结果偏高。Cu2+与I-之间的反应是可逆的,任何引起 Cu2+浓度减小或引起CuI溶解度增加的因素均使反应不完全。加入过量的KI可使反应趋于完全。这里KI是Cu2+的还原剂,又是生成的Cu+的沉淀剂,还是生成的I2的络合剂,使生成I3-, 增加I2的溶解度,减少I2的挥发。由于CuI 沉淀强烈吸咐I3-会使测定结果偏低。故加入SCN-使CuI(Ksp = l.l x l0-12)转化为溶解度更小的CuSCN (Ksp= 4.8 x 10-15) ,释放出被吸附的I3-。
<2> 铜的测定。生成的I2用Na2S2O3标准溶液滴定,以淀粉为指示剂。由于CuI沉淀表面吸附I2,使分析结果偏低,终点变色不敏锐。为了减少CuI对I2的吸附,可在大部分I2被Na2S2O3溶液滴定后,加入NH4SCN,使CuI转化为溶解度更小的CuSCN :CuI + SCN- = CuSCN↓ + I-噢它基本上不吸附I2,使终点变色敏锐。
试样中有Fe存在时,Fe3+也能氧化I-为I2,2Fe3+ + 2I- = 2Fe2+ + I2↓
可加入NH4F,使Fe3+生成稳定的FeF63-,降低了Fe3+/Fe2+电对的电势,使Fe3+不能将I-氧化为I2。
以上方法也适用于测定铜矿、炉渣、电镀液及胆矾等试样中的铜。
三 试剂
KI:固体,AR。 0.5% 淀粉溶液 30% H2O2 NH4F HCl: 1:1,约 6 mol/L。 HAc:1:1水溶液。氨水:1:1 水溶液。
四分析步骤

1, 溶解铜试样的过程中,有哪些注意事项?
<1> 加热与冷却的过程中决不能加塞子(为什么?)
<2> 控制火焰的大小,溶液不能蒸干(为什么?万一不慎,溶液体积很少,但未烧干,如何处理?)
<3> 多余的H2O2一定要分解完(如何判断多余的H2O2已分解完?)
2若过氧化氢未赶尽,对实验结果有何影响?
若留有H2O2,加入KI后,会有以下反应 :H2O2 + 2I- + 2H+ = I2 + 2H2O使测定结果偏高。
3为什么要滴加 1:1 氨水至溶液微呈浑浊,再滴加 1:1 醋酸至溶液澄清并多加1mL?
在弱酸性溶液中,Cu2+与过量的KI反应生成CuI沉淀,同时,定量的析出碘。因此通过上述操作(滴加 1:1 氨水至溶液微呈浑浊,再滴加 1:1 醋酸至溶液澄清并多加1mL) 组成HAc—NH4Ac缓冲溶液,控制溶液的pH=3.5~4.0,使反应能定量进行
4若酸度过低或过高,对实验结果有何影响?
若酸度小了,Cu2+易水解,结果偏低;反应速度慢,终点拖长不易判断。若酸度高,因Cu2+有催化作用,I-易氧化为I2,使实验结果偏高
5如何调节溶液为微酸性?
调节方法 :滴加 1:1 氨水至溶液微呈浑浊,再滴加 1:1 醋酸至溶液澄清,并多加1mL。
①由于用HCl、H2O2溶解铜合金,所以溶液为强酸性,需用 1:1 氨水降低溶液的酸度。
溶样结束时,溶液呈淡绿色(因有Cl-存在,溶液中既有黄色的CuCl42-配离子,也有淡蓝色的Cu(H2O)42+配离子,溶液呈两者的混合色绿色)。边滴加 1:1 氨水,边旋摇锥形瓶混合溶液。开始时溶液澄清,锥形瓶内有白色的雾(什么物质?NH4Cl),随着氨水加入量的增加,滴落点出现深蓝色(什么物质?),旋摇后消失,放慢滴加速度,多旋摇。随后溶液的颜色从绿转为淡蓝色,此时需采用“1滴多摇”的方式,直至旋摇后慢慢出现天蓝色浑浊。
请注意:滴加氨水至出现沉淀,所需的时间较长,请耐心。若氨水加快了,溶液为深蓝色,不会出现天蓝色浑浊(为什么?与NH4+络合了);加入氨水的量与溶样时加入 1:1 HCl的量、溶样时加热时间的长短、加热温度的高低有关。
②边滴加 1:1 HAc,边旋摇锥形瓶,而且需一滴多摇,锥形瓶内浑浊慢慢变少,最后在旋摇中浑浊消失。由于Cu(OH)2沉淀溶解的过程也需要时间,因此 1:1 HAc决不能加快。
多加1mL 1:1 醋酸时,可用量筒加,也可根据滴瓶中的滴管滴多少滴为1mL,按照滴数加。
6为什么要加氟化铵?还有哪些杂质会干扰铜的测定?
<1> 加NH4F固体可以掩蔽Fe3+,使Fe3+以FeF63-形式存在,因此E(Fe3+/Fe2+)的值降低,Fe3+氧化I-为I2的反应不能发生,而且由于FeF63-无色,不干扰终点颜色变化。
<2>As(V)、Sb(V)杂质也会干扰铜的测定,当pH>3.5时,五价As、Sb的氧化性可降低至不能氧化I-。
7为什么要加过量的碘化钾,它有哪些作用?
<1> 因Cu2+与I-反应生成CuI与I2的反应是可逆的,过量的KI可使Cu2+的还原趋于完全。
<2>过量的I-与I2形成I3-,增大I2的溶解度,避免I2的挥发。 从以上的叙述可见,过量的KI起了还原剂、沉淀剂的作用,并和I2形成了多卤化物。络合剂
8为什么加了碘化钾后,需立即用硫代硫酸钠标准液滴定
防止碘挥发与I-的氧化。
9为什么要近终点时才加入淀粉溶液?何时加淀粉最适宜?
<1> 因淀粉吸附I3-,使I2不易放出,影响实验结果,见硫代硫酸钠标准溶液的配制和标定实验步骤中思考题13。
<2> 淀粉既不能加入过早,也不能过迟加,以免过终点。测铜时,当滴定到溶液的颜色为淡黄色时加淀粉为宜。
10何时加硫氰酸钾?
加入淀粉后,继续慢滴硫代硫酸钠标准溶液,当蓝色很淡或刚消失时加硫氰酸钾,剧烈旋摇锥形瓶蓝色再现。若加迟了,终点易过
11 为什么要加硫氰酸钾?
CuI沉淀易吸附I2,导致分析结果偏低,终点不敏锐。因此近终点时,加入KSCN,使CuI转化为溶解度更小的CuSCN,它基本上不吸附I2,使终点变色敏锐
12 为什么不能早加硫氰酸钾?
由于 : 6Cu2+ + 7SCN- +4H2O = 6CuSCN↓ + SO42- + 8H+ + CN- 导致可逆反应 :2Cu2+ + 4I- = CuI↓ + I2
向左移动,从而使析出的I2减少,测定结果偏低。因此不能早加,只能近终点时加入
13加了硫氰酸钾之后,为什么要在激烈旋摇下继续滴定?
有利于沉淀的转化和释放出吸附的碘。
14 终点前后,溶液的颜色如何变化?
当淀粉吸附I2的蓝色消失,终点即到达。由于体系中有CuI沉淀,它是白色,从理论上讲,终点应是蓝色褪去呈白色浑浊液。但有时浑浊液常呈现肉色或藕色,因此终点到达的标志是蓝色褪去,而不是白色浑浊出现
15 如何正确判断终点?
当蓝色渐褪变淡时,悬1滴于尖嘴管管口,用锥形瓶壁靠下,纯水洗下,旋摇锥形瓶使溶液混匀,重复操作直至蓝色消失。由于初练习者看到带浅肉色或藕色的浑浊不能判断蓝色是否褪尽,可读好读数后,再滴加1滴或半滴,浑浊液颜色不变,可判断终点已到,取前面的读数。
五 数据处理

六 可能出现的问题
1 滴加 1:1 氨水后溶液成了深蓝色;或滴加了很多 1:1 醋酸;
原因 <1> 滴加氨水时加得太快,使溶液成了深蓝色。
<2> 加1滴醋酸后未多摇动,造成HAc加多;忘了沉淀溶解要足够的时间。
解决办法 见思考题5
2 加入碘化钾后,溶液中有淡红棕色出现,但仍带有绿色;
原因 溶液的酸度未控制好,尚有Cu2+未还原为CuI沉淀。
解决办法 调节好溶液的酸度。
3 滴定时终点过了。
原因 <1> 硫氰酸钾加迟了,造成加入硫氰酸钾后,虽剧烈旋摇,蓝色仍不出现。
<2> 判断终点有误或不会判断终点。
解决办法(1)试样加淀粉后,逐滴加Na2S2O3标准液,当蓝色刚褪或为浅蓝色时加KSCN,以免过了终点。
<2> 当淀粉吸附I2的蓝色消失即到终点,但浑浊液往往带色(藕色或肉色),这给终点的判断带来了困难。因此,操作时应将注意力放在蓝色褪去,当判断有困难时,可先读好滴定管液面的读数,再滴加1滴或半滴,比较沉淀颜色(指蓝的成分)是否有变化来确定终点。
l 如何调节溶液为微酸性?
调节方法 :滴加 1:1 氨水至溶液微呈浑浊,再滴加 1:1 醋酸至溶液澄清,并多加1mL。
①由于用HCl、H2O2溶解铜合金,所以溶液为强酸性,需用 1:1 氨水降低溶液的酸度。
溶样结束时,溶液呈淡绿色(因有Cl-存在,溶液中既有黄色的CuCl42-配离子,也有淡蓝色的Cu(H2O)42+配离子,溶液呈两者的混合色绿色)。边滴加 1:1 氨水,边旋摇锥形瓶混合溶液。开始时溶液澄清,锥形瓶内有白色的雾(什么物质?),随着氨水加入量的增加,滴落点出现深蓝色(什么物质?),旋摇后消失,放慢滴加速度,多旋摇。随后溶液的颜色从绿转为淡蓝色,此时需采用“1滴多摇”的方式,直至旋摇后慢慢出现天蓝色浑浊。
请注意 :滴加氨水至出现沉淀,所需的时间较长,请耐心。若氨水加快了,溶液为深蓝色,不会出现天蓝色浑浊(为什么?);加入氨水的量与溶样时加入 1:1 HCl的量、溶样时加热时间的长短、加热温度的高低有关。
②边滴加 1:1 HAc,边旋摇锥形瓶,而且需一滴多摇,锥形瓶内浑浊慢慢变少,最后在旋摇中浑浊消失。由于Cu(OH)2沉淀溶解的过程也需要时间,因此 1:1 HAc决不能加快。
多加1mL 1:1 醋酸时,可用量筒加,也可根据滴瓶中的滴管滴多少滴为1mL,按照滴数加。
用碘量法测定铜时,标定硫代硫酸钠溶液最合适的工作基准试剂是何物?
最合适的工作基准试剂应是纯铜。用纯铜标定硫代硫酸钠溶液,使标定与测定一致,可以抵消方法的系统误差。
步骤如下 :
<1>准确称取0.2g纯铜于250mL烧杯中,加入约10mL1:1盐酸,2~3mL30%H2O2,加热,使铜溶解并将多余的H2O2分解赶尽,然后定量转入250mL容量瓶中,加水稀释至刻度,摇匀。
<2>准确移取25.00mL标准液于250mL锥形瓶中,按测定铜合金铜含量的步骤标定Na2S2O3标准溶液。
