硫代硫酸钠的制备和定性鉴定
前言
采用亚硫酸钠法,用近饱和的亚硫酸钠溶液和硫粉共煮来制备硫代硫酸钠。由于硫代硫酸钠具有不稳定性,较强的还原性和配位能力。所以对制好的产品进行性质鉴定。用盐酸溶液检验其不稳定性,用碘水和淀粉溶液检验其还原性,用硝酸银溶液和溴化钾溶液检验其配合性。
硫代硫酸钠是最重要的硫代硫酸盐,俗称“海波”,又名“大苏打”,是无色透明单斜晶体。易溶于水,难溶于乙醇,硫代硫酸钠在酸性条件下极不稳定,易分解;硫代硫酸钠具有较强的还原性和配位能力,可用于照相行业的定影剂,洗染业、造纸业的脱氯剂,定量分析中的还原剂。
实验原理
采用亚硫酸钠法制备硫代硫酸钠,是近饱和的亚硫酸钠溶液与硫粉共煮。
Na2SO3 + S + 5H2O ══ Na2S2O3·5H2O
126 32 248
5.1g 1.5g 10g
反应液经脱色、过滤、浓缩结晶、过滤、干燥即得产品。
Na2S2O3于40~45℃熔化,48℃分解,因此,在浓缩过程中要注意不能蒸发过度。
实验用品
仪器:电热套,托盘天平,100mL锥形瓶,10mL量筒,蒸发皿,磁力搅拌器,玻璃棒,石棉网,抽滤瓶,布氏漏斗,试管
固体试剂:Na2SO3,硫粉,活性炭
液体试剂:乙醇, AgNO3(1mol·L-1),碘水,淀粉溶液,盐酸(6mol·L-1),KBr(0.1mol·L-1)
实验内容
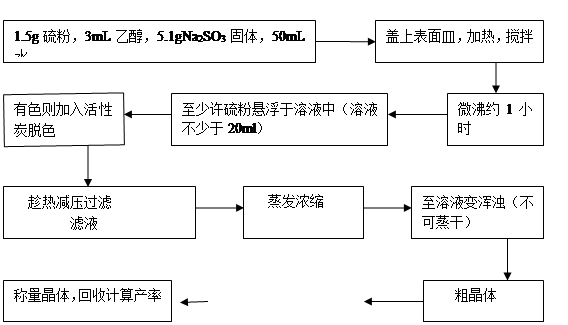
1.硫代硫酸钠的制备
(1)称取5.1g Na2SO3 固体于100mL锥形瓶中,加50mL蒸馏水搅拌溶解。
(2)称取1.5g 硫磺粉于100mL烧杯中,加3mL乙醇充分搅拌均匀,再加入Na2SO3溶液混合,盖上表面皿,加热并不断搅拌。
(3)待溶液沸腾后改用小火加热,保持微沸状态1h,不断地用玻璃棒充分搅拌,直至仅有少许硫粉悬浮于溶液中,加少量活性炭作脱色剂。
(4)趁热减压过滤,将滤液转至蒸发皿中,水浴加热浓缩至液体表面出现结晶为止。
(5)自然冷却、结晶。
(6)减压过滤,滤液回收。
(7)用少量乙醇洗涤晶体,用滤纸吸干后,称重,计算产率。
其流程图

2.硫代硫酸钠的性质鉴定
取少量自制的Na2S2O3·5H2O晶体溶于10mL水中,进行以下实验。
1.S2O32离子鉴定
在点滴板加入Na2S2O3 溶液再加2 滴0.1mol·L-1AgNO3 溶液。观察现象。如果沉淀由白色变黄色变棕色最后变为黑色。可证明含有S2O32- 离子。
2Ag+ + S2O32- == Ag2S2O3 Ag2S2O + H2O == Ag2S + H2SO4
2.Na2S2O3.5H2O的稳定性
取少量Na2S2O3 溶于试管中,加入3滴6mol·L-1盐酸溶液,振荡片刻,用湿润的蓝色石蕊试纸检验逸出气体,观察现象。观察到蓝色石蕊试纸变红色,有浅黄色沉淀生成。
S2O32- + H+ =S↓+SO2 + H2O
3.Na2S2O3.5H2O的还原性
滴入少量的碘水和淀粉溶液于试管中,然后再滴入少量Na2SO3 溶液于试管中,观察现象 。观察到溶液由蓝色变为无色。
2S2O32- + I2═ S4O62 - + 2I-
4.Na2S2O3.5H2O配位性
在点滴板滴加2滴0.1 mol·L-1AgNO3 溶液和2滴0.1 mol·L-1 KBr 溶液,再滴入3滴Na2S2O3 溶液,观察现象。
Ag+ + Br-═ AgBr↓ 2AgBr + 2 S2O32-═ [Ag(S2O3)2]3- + 2Br-

3.数据处理
将实际产量Mg除以理论产量10.0g,就可以得到硫代硫酸钠晶体的产率。
Na2SO3 + S + 5H2O ══ Na2S2O3·5H2O
126 32 248
5.1g 1.3g 10.0g
由实验制得Na2S2O3·5H2O晶体的实际产量 m g。
则Na2S2O3·5H2O晶体的产率 = 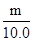 ×100%=
×100%=
误差来源:
1.反应原硫粉溶解的量不够,导致Na2S2O3.5H2O的产量过少。
2.在煮沸过程中,时间把握不够,没到完全反应就停止煮沸,导致产量过少。
3.蒸发与过滤过程中,产生的损耗过大,影响产物的收集,导致产量的减少.
注意事项
1.蒸发浓缩时,速度太快,产品易于结块;速度太慢,产品不易形成结晶。
2.反应中的硫磺用量已经是过量的,不需再多加。
3.实验过程中,浓缩液终点不易观察,有晶体出现即可。
4.反应过程中,应不时地将烧杯壁上的硫粉也搅入反应液中。
5.注意保持反应液体积不少于32 mL。
6.抽滤时应细心操作,避免活性炭进入滤液。
7.浓缩结晶时,切忌蒸出较多溶剂,免得产物因缺水而固化,得不到Na2S2O3?5H2O晶体。
8.若放置一段时间仍没有晶体析出,是形成过饱和溶液,可采用磨擦器壁或加一粒硫代硫酸钠晶体引发结晶。
第二篇:碘和硫代硫酸钠溶液的配制与标定
实验六碘和硫代硫酸钠溶液的配制与标定
实验七葡萄糖含量的测定
一、实验目的
1、掌握Na2S2O3及I2溶液的配制和标定方法
2、掌握间接碘量法测定葡萄糖含量的方法
二、实验原理
1、硫代硫酸钠的标定
Na2S2O3不稳定,见光、受热、酸性溶液中易分解,易被氧化,需间接配制
Na2S2O3标定是采用间接碘量法。准确称取一定量的K2Cr2O7 基准试剂,配成溶液,加入过量的KI,在酸性溶液中定量地完成下列反应:

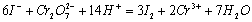
生成的I2,立即用Na2S2O3溶液滴定。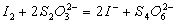
有关系: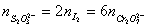 ,根据滴定Na2S2O3消耗的体积,即可计算出Na2S2O3的浓度。
,根据滴定Na2S2O3消耗的体积,即可计算出Na2S2O3的浓度。

2、I2溶液的标定(略)
由式: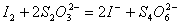 相互滴定,可计算出I2的浓度。
相互滴定,可计算出I2的浓度。
3、葡萄糖溶液的测定
碘与NaOH作用能生成NaIO,而C6H12O6能定量地被NaIO氧化。在酸性条件下,未与C6H12O6作用的NaIO可转变为I2析出,只要用标准Na2S2O3溶液滴定析出的I2,便可计算C6H12O6的含量。有关反应:

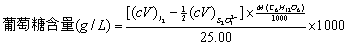
三、实验步骤
1、0.05mol/L I2和0.1mol/L Na2S2O3溶液的配制(已配好)
2、I2和Na2S2O3溶液的比较滴定
用移液管取25.00mL标准I2于锥形瓶中,加入50mL水,用Na2S2O3溶液滴定至浅黄色后,加入2mL的淀粉指示剂③,再用Na2S2O3溶液继续滴定至蓝色刚好褪去为止。平行滴定2次。
3、Na2S2O3溶液的标定
准确地称取0.11~0.12g的K2Cr2O7基准试剂2份。分别置于2个250mL的碘量瓶中,分别加入10~20mL蒸馏水使之溶解。加10mL 20% KI溶液 , 10mL 2mol/LHCl,充分混合溶解后,盖好塞子,以防止I2因挥发而损失。在暗处放置5min①,然后加50mL水稀释②,用Na2S2O3溶液滴定到溶液呈浅绿黄色时,加2mL淀粉溶液③,继续滴入Na2S2O3溶液直到蓝色刚好消失④而Cr3+绿色出现为止。
4、葡萄糖的测定
用移液管吸取25.00mL待测葡萄糖溶液于碘量瓶中,准确加入25.00mLI2 标准溶液。一边摇动,一边慢慢加入2mol/L NaOH溶液,直到溶液显淡黄色⑤。将碘量瓶加塞于暗处放置10~15min后,加2mL6mol/L HCl使溶液呈酸性,立即用Na2S2O3溶液滴定到溶液呈淡黄色,加入2mL淀粉指示剂,继续滴加到蓝色消失为止,记下读数。平行测定2次。
四、结果与计算
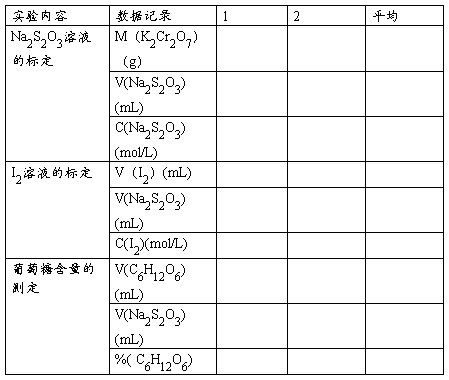
C6H12O6的分子量为:180
五、注意事项
1、K2Cr2O7与I2的反应不是立即完成,在稀溶液中进行更慢,所以一般需要放置5min以上。
2、K2Cr2O7还原后生成的Cr3+呈绿色,妨碍终点指示剂观察,需加水稀释,使颜色变浅。稀释还可降低过量I-,避免空气中的O2氧化。
3、Na2S2O3滴定I2时,淀粉不宜过早加入,否则易与大量I2形成加合物,加合物中的I2不易与Na2S2O3作用。
4、滴定到终点的溶液,经一段时间后变蓝。如果不是很快变蓝,那是因空气中的氧化作用所致。如果很快变蓝,而且不断加深,说明溶液稀释太早,K2Cr2O7和KI的反应在滴定前进行得不完全,此时实验失败。
5、此处,加碱的速度不宜过快,否则过量的NaIO来不及氧化C6H12O6而歧化为不与葡萄糖反应的NaIO3和NaI,使测定结果偏低,此时的颜色也需仔细地观察。
六、思考题:
1、用Na2S2O3溶液滴定I2溶液和用I2溶液滴定Na2S2O3溶液时都是用淀粉指示剂,为什么要在不同时候加入?终点颜色变化有何不同?
2、标定Na2S2O3溶液时,加入的KI溶液的量是否要很精确?为什么?
