琼脂糖凝胶电泳的操作步骤如下:
1. 制备1%琼脂糖凝胶(大胶用70ml,小胶用50ml):称取0.7 g(0.5 g)琼脂糖置于锥形瓶中,加入70 ml(50ml)1×TAE,瓶口倒扣小烧杯.微波炉加热煮沸3次至琼脂糖全部融化,摇匀,即成1.0%琼脂糖凝胶液.
2. 胶板制备:取电泳槽内的有机玻璃内槽(制胶槽)洗干净,晾干,放入制胶玻璃板.取透明胶带将玻璃板与内槽两端边缘封好,形成模子.将内槽置于水平位置,并在固定位置放好梳子.将冷却到65℃左右的琼脂糖凝胶液混匀小心地倒入内槽玻璃板上,使胶液缓慢展开,直到整个玻璃板表面形成均匀胶层.室温下静置直至凝胶完全凝固,垂直轻拔梳子,取下胶带,将凝胶及内槽放入电泳槽中.添加
1×TAE电泳缓冲液至没过胶板为止.
3. 加样:在点样板或parafilm上混合DNA样品和上样缓冲液,上样缓冲液的最终稀释倍数应不小于1X.用10 ul微量移液器分别将样品加入胶板的样品小槽内,每加完一个样品,应更换一个加样头,以防污染,加样时勿碰坏样品孔周围的凝胶面.(注意:加样前要先记下加样的顺序).
4. 电泳:加样后的凝胶板立即通电进行电泳,电压60-100V,样品由负极(黑色)向正极(红色)方向移动.电压升高,琼脂糖凝胶的有效分离范围降低.当溴酚蓝移动到距离胶板下沿约1cm处时,停止电泳.
(5)电泳完毕后,取出凝胶,用含有0.5 ug/ml的溴化乙锭1×TAE溶液染色约20 min,再用清水漂洗10 min.
(6)观察照相:在紫外灯下观察,DNA存在则显示出红色荧光条带,采用凝胶成像系统拍照保存
实验原理
闭合环状质粒、线性质粒和开环质粒DNA由于构形不同,在加溴化乙锭的琼脂糖凝胶电泳上呈现不同的迁移率,因而在紫外灯下观察,能区别闭合环状质粒DNA(cccDNA)、线性质粒DNA(L-DNA)和开环质粒DNA(ocDNA)。
实验材料和试剂
(一)实验样品
质粒pUC118
(二)试剂
1.l DNA/HindIII分子量标准
2.溴酚蓝指示剂点样缓冲液
0.2% 溴酚蓝
50% 蔗糖
3.1mg/ml溴化乙锭溶液
4.电泳缓冲液(TAE)
40 mmol/L Tris-乙酸
1 mol/L EDTA
(配制方法:24.2克Tris碱,5.71ml冰乙酸,10ml 0.5mol/L EDTA(pH8.0),定容至5000ml)
5.0.7% 琼脂糖凝胶
(配制方法:称取琼脂糖0.35克,加入50ml TAE电泳缓冲液)
(三)仪器
微量移液器 电泳仪
水平电泳槽 透射紫外观察仪
实验步骤
1.选择合适的水平式电泳槽,调节电泳槽平面至水平。检查稳压电源与正负极的线路。
2.选择孔径大小合适的点样梳子,垂直架在电泳胶模的一端,使点样梳子底部离电泳胶模底部的距离为1.0mm。
3.制备0.7%琼脂糖凝胶,100℃水浴加热至琼脂糖融化均匀。
4.用吸管取少量琼脂糖凝胶溶液将电泳胶模四周密封好,防止浇灌琼脂糖凝胶板时发生渗透。待琼脂糖凝胶冷却至60℃左右时,加入一滴溴化乙锭,摇匀,轻轻倒入电泳胶模中,琼脂糖凝胶的厚度在3~5mm。倒胶时要避免产生气泡,若有气泡可用吸管小心吸去。
5.琼脂糖凝胶凝固后,在室温放置20分钟,小心拔掉点样梳子和电泳胶模两端的挡板,保持点样孔的完好。
6.将电泳胶模放入电泳槽中,加入电泳缓冲液,使电泳缓冲液面高出琼脂糖凝胶表面1~2mm。如点样孔内有气泡,用吸管小心吸出,以免影响加样。
7.将15ml DNA样品与1/5体积的溴酚蓝指示剂点样缓冲液混合。上样缓冲液不仅可以提高样品的密度,使样品均匀沉到样品孔内,还可以使样品带颜色,便于上样和估计电泳时间和判断电泳的位置。
8.用微量移液器将样品小心加入加样孔内,记录样品点样秩序。
9.盖上电泳槽,开启电源开关,最高电压不超过5V/cm(100~150V恒压电泳),使DNA从负极向正极移动。
10.电泳时间随实验的具体要求而异。电泳一般需1~3小时。电泳完毕后关闭电源,戴一次性塑料手套取出凝胶,尽可能将所有的电泳缓冲液淋干,在254nm波长的透射紫外灯下观察。
【提示】
(一)琼脂糖凝胶电泳
1.琼脂糖凝胶的性质
琼脂糖是从海藻中提取的一种直链多糖,它由D-半乳糖和3,6-脱水-L-半乳糖的残基交替排列组成的线型多聚糖。当琼脂糖加热至90~100℃左右,即可形成清亮透明的液体。浇在模板上冷却至40~45℃时,凝固形成凝胶。琼脂糖带有亲水性,不含有带电荷的基团,不引起DNA变性,又不吸附被分离的物质,因此它是一种很好的凝胶剂。琼脂糖凝胶可区分相差100bp的DNA片段。
2.DNA分子的迁移率
DNA分子在电泳中的迁移率的因素是多方面的,除了决定于DNA分子大小与构型外,还有琼脂糖凝胶的浓度、电压大小、缓冲液pH值和电泳时的温度等。
(二)实验操作中注意的问题
1.加热溶解琼脂糖时应不断地摇动容器,使附于壁上的颗粒也完全溶解。
2.溴化乙锭是一种强致癌剂,并有中度毒性,因此必须十分谨慎小心。操作时一定要戴手套,用过的手套要及时将手套顺手翻过来,让污染有溴化乙锭的面朝里。
3.用254nm波长的紫外光进行观察的效果比366nm清晰,但产生的切口DNA量也较高。紫外光对眼睛有害,观察时应戴上眼镜或防护面罩。
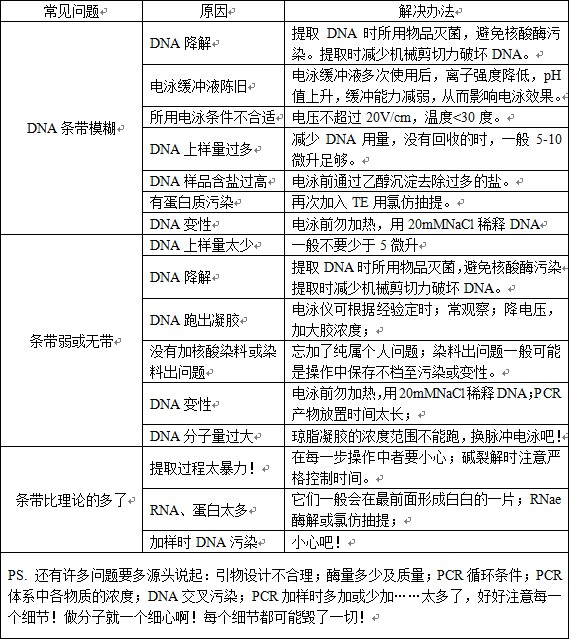
琼脂糖凝胶电泳实验技巧
核酸分子是两性解离分子,在高于其等电点的电泳缓冲液(pH8.0-8.3)中,基其碱基不解离,而磷酸基团全部解离,核酸分子因而带负电荷,电泳时向正极迁移。琼脂糖主要多海洋植物琼脂中提取而来并经糖基化修饰,为一种聚合链线性分了,使用琼脂糖凝胶作为电泳支持介质,发挥分子筛功能,使得大小和构象不同的核酸分子的迁移率出现较大差异,从而达到分离的目的。琼脂糖凝胶电泳操作简单、快速、通过调整其使用浓度,使得分辨率达到大多实验的要求。因此成为分离、鉴定、纯化核酸分子的常用方法。
一、操作过程中要注意以下一些问题。
1、凝胶制作
1.1 凝胶浓度
凝胶的浓度据实验需要而变,一般在1.8%-2.0%之间,没有用完的凝胶可以再次融化,但随着融化次数的增加,水分丢失也越多,凝胶浓度则会越来越高,导致实验结果不稳定。补水办法:一是在容器上标记煮胶前的刻度,煮胶后补充水分到原刻度;二是在煮胶前称重,煮胶后补充水至原重量。粗略一点的办法是通过多次较恒定的煮胶条件得出一个经验补水值,以保证凝胶浓度基本维持在原浓度。如果条带要回收最好不要用回收胶。
1.2 梳板的选用
一般每个制胶模具均配有多个齿型不同的梳板。梳齿宽厚,形成的点样孔容积较大,用于DNA片段回收实验等;相反,梳齿窄而薄,形成的点样孔容积就较小,用于PCR产物、酶切产物鉴定等。回收的话还可以将几个齿用透明胶带粘起来,形成一个窄而长的大孔以加大点样量提高回收率。梳板的选择主要是看上样量的多少而定。一般来说,上样量小时尽量选择薄的梳板制胶,此时电泳条带致密清晰,便于结果分析。另外,每次制胶时都要注意梳齿与底板的距离至少要1mm,否则,拔梳板时易损坏凝胶孔底层,导致点样后样品渗漏。当然,点样孔的破坏还与拔梳板的时间和方法有关,一般凝胶需冷却30min以上方可拔出梳板,应急的情况下可以将成型的凝胶块入4度冰箱中冷却15min左右,拔梳板的方法是将制胶槽放置在电泳槽中的电泳缓冲液中,然后垂直向上慢慢用力,因为有液体的润滑作用,梳板易拔出且不易损坏点样孔。
2、点样
在样品加入上样缓冲液中含有甘油或蔗糖以增加密度,使样品沉入孔底;上样缓冲液中一般还含有两种指示剂,溴酚兰和二甲苯菁,用于指示样吕的迁移过程。上样缓冲液储存液一般为6倍(10倍),表示其浓度为工作浓度的六倍。使用时上样缓冲液应稀释到一倍浓度。点样方法是将移液枪基本垂直对准点样孔,用另一只手帮助固定移液枪下端,移液枪的枪头尖端进入点样孔即可将样品注入孔内。上样量的多少根据跑胶的目的而不同,一般直接跑DNA时量最少,跑一般的分子标记适中,回收时可以都加进去。最后根据扩增条带的大小点上适合的DNA Maker。
3、电泳
将电泳仪的正极与电泳槽的正极相连,负极与负极相连,每次电泳时都要检查一下电极方向,以免白干(新手来做时可能就有这样的情况发生)。核酸带负电荷,从负极向正极移动。电泳槽中电泳缓冲液与制胶用电泳缓冲液应相同,电泳缓冲液刚好浸过胶为好。电泳缓冲液浓度太大则电流加大,凝胶发热,易使DNA降解。电泳早所加电压一般不超过5v/cm(正负电极之间的距离,而不是凝胶的长度)。电泳时间一般为30-60min,根据实验需要也可作适当调整。电压增高,电泳时间缩短,核酸条带相对来说不够整齐,不够清晰;相反,电压降低,电泳时间较长,条带会相对的清晰。另外,如果电泳后样品泳支很慢或者没移动可能是由于挡板没有拿开。
附 EB作用原理:观察琼脂糖凝胶中DNA最常用的方法是利用荧光染料溴化乙锭进行染色,溴化乙锭含有一个可以嵌入DNA堆积碱基之间的一个三环平面基团。它与DNA的结合几乎没有碱基序列特异性。在高离子强度的饱和溶液中,大约每2.5个碱基插入一个溴化乙锭分子。当染料分子插入后,其平面基团与螺旋的轴线垂直并通过范德华力与上下碱基相互作用。这个基团的固定位置及其与碱基的密切接近,导致与DNA结合的染料呈现荧光,其荧光产率比游离溶液中染料有所增加。DNA吸收254nm处的紫外辐射并传递给染料,而被结合的染料本身吸收302nm和366nm的光辐射。这两种情况下,被吸收的能量在可见光谱红橙区的590nm处重新发射出来。由于溴化乙锭-DNA复合物的荧光产率比没有结合DNA的染料高出20-30倍,所以当凝胶中含有游离的溴化乙锭(0.5ug/ml)时,可以检测到少至10ng的NDA条带。
第二篇:琼脂糖凝胶电泳实验
琼脂糖凝胶电泳实验技巧
核酸分子是两性解离分子,在高于其等电点的电泳缓冲液(pH8.0-8.3)中,基其碱基不解离,而磷酸基团全部解离,核酸分子因而带负电荷,电泳时向正极迁移。琼脂糖主要多海洋植物琼脂中提取而来并经糖基化修饰,为一种聚合链线性分了,使用琼脂糖凝胶作为电泳支持介质,发挥分子筛功能,使得大小和构象不同的核酸分子的迁移率出现较大差异,从而达到分离的目的。琼脂糖凝胶电泳操作简单、快速、通过调整其使用浓度,使得分辨率达到大多实验的要求。因此成为分离、鉴定、纯化核酸分子的常用方法。
一、操作过程中要注意以下一些问题。
1、凝胶制作
1.1 凝胶浓度
凝胶的浓度据实验需要而变,一般在1.8%-2.0%之间,没有用完的凝胶可以再次融化,但随着融化次数的增加,水分丢失也越多,凝胶浓度则会越来越高,导致实验结果不稳定。补水办法:一是在容器上标记煮胶前的刻度,煮胶后补充水分到原刻度;二是在煮胶前称重,煮胶后补充水至原重量。粗略一点的办法是通过多次较恒定的煮胶条件得出一个经验补水值,以保证凝胶浓度基本维持在原浓度。如果条带要回收最好不要用回收胶。
1.2 梳板的选用
一般每个制胶模具均配有多个齿型不同的梳板。梳齿宽厚,形成的点样孔容积较大,用于DNA片段回收实验等;相反,梳齿窄而薄,形成的点样孔容积就较小,用于PCR产物、酶切产物鉴定等。回收的话还可以将几个齿用透明胶带粘起来,形成一个窄而长的大孔以加大点样量提高回收率。梳板的选择主要是看上样量的多少而定。一般来说,上样量小时尽量选择薄的梳板制胶,此时电泳条带致密清晰,便于结果分析。另外,每次制胶时都要注意梳齿与底板的距离至少要1mm,否则,拔梳板时易损坏凝胶孔底层,导致点样后样品渗漏。当然,点样孔的破坏还与拔梳板的时间和方法有关,一般凝胶需冷却30min以上方可拔出梳板,应急的情况下可以将成型的凝胶块入4度冰箱中冷却15min左右,拔梳板的方法是将制胶槽放置在电泳槽中的电泳缓冲液中,然后垂直向上慢慢用力,因为有液体的润滑作用,梳板易拔出且不易损坏点样孔。
2、点样
在样品加入上样缓冲液中含有甘油或蔗糖以增加密度,使样品沉入孔底;上样缓冲液中一般还含有两种指示剂,溴酚兰和二甲苯菁,用于指示样吕的迁移过程。上样缓冲液储存液一般为6倍(10倍),表示其浓度为工作浓度的六倍。使用时上样缓冲液应稀释到一倍浓度。点样方法是将移液枪基本垂直对准点样孔,用另一只手帮助固定移液枪下端,移液枪的枪头尖端进入点样孔即可将样品注入孔内。上样量的多少根据跑胶的目的而不同,一般直接跑DNA时量最少,跑一般的分子标记适中,回收时可以都加进去。最后根据扩增条带的大小点上适合的DNA Maker。
3、电泳
将电泳仪的正极与电泳槽的正极相连,负极与负极相连,每次电泳时都要检查一下电极方向,以免白干(新手来做时可能就有这样的情况发生)。核酸带负电荷,从负极向正极移动。电泳槽中电泳缓冲液与制胶用电泳缓冲液应相同,电泳缓冲液刚好浸过胶为好。电泳缓冲液浓度太大则电流加大,凝胶发热,易使DNA降解。电泳早所加电压一般不超过5v/cm(正负电极之间的距离,而不是凝胶的长度)。电泳时间一般为30-60min,根据实验需要也可作适当调整。电压增高,电泳时间缩短,核酸条带相对来说不够整齐,不够清晰;相反,电压降低,电泳时间较长,条带会相对的清晰。另外,如果电泳后样品泳支很慢或者没移动可能是由于挡板没有拿开。
附 EB作用原理:观察琼脂糖凝胶中DNA最常用的方法是利用荧光染料溴化乙锭进行染色,溴化乙锭含有一个可以嵌入DNA堆积碱基之间的一个三环平面基团。它与DNA的结合几乎没有碱基序列特异性。在高离子强度的饱和溶液中,大约每2.5个碱基插入一个溴化乙锭分子。当染料分子插入后,其平面基团与螺旋的轴线垂直并通过范德华力与上下碱基相互作用。这个基团的固定位置及其与碱基的密切接近,导致与DNA结合的染料呈现荧光,其荧光产率比游离溶液中染料有所增加。DNA吸收254nm处的紫外辐射并传递给染料,而被结合的染料本身吸收302nm和366nm的光辐射。这两种情况下,被吸收的能量在可见光谱红橙区的590nm处重新发射出来。由于溴化乙锭-DNA复合物的荧光产率比没有结合DNA的染料高出20-30倍,所以当凝胶中含有游离的溴化乙锭(0.5ug/ml)时,可以检测到少至10ng的NDA条带。
DNA电泳一般使用的都是琼脂糖凝胶电泳,电泳的驱动力靠DNA骨架本身的负电荷。
聚丙烯酰氨(PAGE)凝胶电泳用于蛋白质与寡糖核苷酸的分离。电泳的驱动力靠与蛋白质结合的SDS上所携带的负电荷。蛋白质电泳(一般指SDS-PAGE)根据蛋白分子量亚基的不同而分离蛋白。蛋白质亚基的电泳迁移率主要取决于亚基分子量的大小,电荷因素可以忽视。
所以相同点就是样品都是带负电荷的,从负极向正极移动,移动的距离都和样品的分子量有关。而且这两个电泳体系可以互相交换使用。进行大分子蛋白质电泳时,可以考虑换用琼脂糖凝胶,因为该体系孔径大。相反,如果需要精确到各位数碱基的DNA电泳也可以使用聚丙烯酰胺凝胶系统,因为使用该系统可以将相差一个碱基的两条DNA链分开。
不同点首先是样品不同。这个就不用多说了。其次是结果的观察方法不同。DNA电泳普遍使用EB做染料,在紫外灯下观察;而蛋白电泳使用的考马斯亮蓝染色,还需要经过脱色步骤,不过观察起来比较简单。还有就是胶体系的差别,DNA电泳通常是一胶跑到底,而蛋白质电泳则会有分离胶和浓缩胶之区别。
电泳中样品移动的本质确实是样品所携带的电荷。但是,区分这些条带直接可以用分子量而无需使用电荷数,是因为这些样品的电荷/分子量比都是恒定的了。以DNA分子为例,它在电泳中的移动是靠其骨架中磷酸所携带的负电荷来实现的,而这个磷酸分子又是每一个核苷酸中都有的,所以DNA分子所携带的负电荷数是由其核苷酸总数决定的。而且,DNA分子中核苷酸的组成动辄成百上千,在如此大的分子量面前,讨论单个核苷酸之间分子量的差别就显得毫无意义。这样,DNA分子中负电荷的量就可以用DNA的分子量来代替,反过来,DNA的分子量也就可以用DNA分子所携带的电荷来代替(一句话,DNA分子的电荷/分子量比是恒定的)。
这在蛋白电泳中(特别是SDS-PAGE中)是一样的。在SDS-PAGE中,SDS将蛋白质变性成直线分子并紧密包裹于其上,使得其所携带的电荷与蛋白分子量成了一定的比例,剩下的就和核酸电泳一样了。
至于为什么核酸的横着跑,蛋白竖着跑,个人认为最大的问题是蛋白制胶的过程导致的。蛋白制胶由于使用了两种不同的凝胶系统,所以需要一个水平的分界面。这个分界面在配胶的过程中是依靠异丙醇在重力作用下的压力下形成的。所以,一并就竖着跑了~~
电泳是指混悬于溶液中的样品(有机的或无机的,有生命的或无生命的)电荷颗粒,在电场影响下向着与自身带相反电荷的电极移动的现象
