一、实验目的
琼脂糖凝胶电泳是常用的检测核酸的方法,学习DNA琼脂糖凝胶电泳的使用技术,掌握有关的技术和识读电泳图谱的方法。
二、实验原理
琼脂糖凝胶电泳是常用的用于分离、鉴定DNA、RNA分子混合物的方法,这种电泳方法以琼脂凝胶作为支持物,利用DNA分子在泳动时的电荷效应和分子筛效应,达到分离混合物的目的。DNA分子在高于其等电点的溶液中带负电,在电场中向阳极移动。在一定的电场强度下,DNA分子的迁移速度取决于分子筛效应,即分子本身的大小和构型是主要的影响因素。DNA分子的迁移速度与其相对分子量成反比。不同构型的DNA分子的迁移速度不同。如环形DNA分子样品,其中有三种构型的分子:共价闭合环状的超螺旋分子(cccDNA)、开环分子(ocDNA)、和线形DNA分子(IDNA)。这三种不同构型分子进行电泳时的迁移速度大小顺序为:cccDNA>IDNA>ocDNA
核酸分子是两性解离分子,pH3.5是碱基上的氨基解离,而三个磷酸基团中只有一个磷酸解离,所以分子带正电,在电场中向负极泳动;而 pH8.0-8.3时,碱基几乎不解离,而磷酸基团解离,所以核酸分子带负电,在电场中向正极泳动。不同的核酸分子的电荷密度大致相同,因此对泳动速度影响不大。在中性或碱性时,单链DNA与等长的双链DNA的泳动率大致相同。
影响核酸分子泳动率的因素主要是:
1、样品的物理性状
即分子的大小、电荷数、颗粒形状和空间构型。一般而言,电荷密度愈大,泳动率越大。但是不同核酸分子的电荷密度大致相同,所以对泳动率的影响不明显。
对线形分子来说,分子量的常用对数与泳动率成反比,用此标准样品电泳并测定其泳动率,然后进行DNA分子长度(bp)的负对数——泳动距离作标准曲线图,可以用于测定未知分子的长度大小。
DNA分子的空间构型对泳动率的影响很大,比如质粒分子,泳动率的大小顺序为:cDNA>IDNA>ocDNA但是由于琼脂糖浓度、电场强度、离子强度和溴化乙锭等的影响,会出现相反的情况。
2、支持物介质
核酸电泳通常使用琼脂糖凝胶和聚丙烯酰胺凝胶两种介质,琼脂糖是一种聚合链线性分子。含有不同浓度的琼脂糖的凝胶构成的分子筛的网孔大小不同,是于分离不同浓度范围的核酸分子。聚丙烯酰胺凝胶由丙烯酰胺(Acr)在N,N,N′-四甲基乙四胺(TEMED)和过硫酸铵
(AP)的催化下聚合形成长链,并通过交联剂N,N′-亚甲双丙烯酰胺(Bis)交叉连接而成,其网孔的大小由Acr与Bis的相对比例决定。
琼脂糖凝胶适合分离长度100至60的分子,而聚丙烯酰胺凝胶对于小片段(5bp-500bp)的分离效果最好。选择不同浓度的凝胶,可以分离不同大小范围的DNA分子。
3、电场强度
电场强度愈大,带点颗粒的泳动越快。但凝胶的有效分离范围随着电压增大而减小,所以电泳时一般采用低电压,不超过4V/cm。而对于大片段电泳,甚至用0.5-1.0V/cm电泳过夜。进行高压电泳时,只能使用聚丙烯酰胺凝胶。
4、缓冲液离子强度
核酸电泳常采用TAE、 TBE、TPE三种缓冲系统,但它们各有利弊。TAE价格低廉,但缓冲能力低,必须进行两极缓冲液的循环。TPE在进行DNA回收时,会使DNA污染磷酸盐,影响后续反应。所以多采用TBE缓冲液。
在缓冲液中加入EDTA,可以鳌合二价离子,抑制DNase,保护DNA。
缓冲液pH常偏碱性或中性,此时核酸分子带负电,向正极移动。
核酸电泳中常用的染色剂是溴化乙锭(ethidium bromide EB)。溴化乙锭是一种扁平分子,可以嵌入核酸双链的配对碱基之间。在紫外线照射BE-DNA复合物时,出现不同的效应。254nm的紫外线照射时,灵敏度最高,但对DNA损伤严重;360nm紫外线照射时,虽然灵敏度较低,但对DNA损伤小,所以适合对DNA样品的观察和回收等操作。300nm紫外线照射的灵敏度较高,且对DNA损伤不是很大,所以也比较适用。
使用溴化乙锭对DNA 样品进行染色,可以在凝胶中加入终浓度为0.5μg/ml的EB。EB掺入DNA分子中,可以在电泳过程中随时观察核酸的迁移情况,但是如果要测定核酸分子大小时,不宜使用以上方法,而是应该在电泳结束后,把凝胶浸泡在含0.5μg/mlEB的溶液中10~30min进行染色。BE见光分解,应在避光条件下4℃保存。
三、材料、试剂及器具
1、材料
ΛDNA/HindⅢ Marker(分子量标准);实验37的质粒提取物;实验39的酶切产物;实验40的连接产物。
2、试剂
加样缓冲液(6x):0.25% 溴酚兰,40%蔗糖;琼脂糖;溴化乙锭(EB);酶液(10mg/ml)。
3、器具
(1)电泳系统:电泳仪、水平电泳槽、制胶板等。
(2)紫外透射仪。
四、操作步骤
1、按所分离的DNA分子的大小范围,称取适量的琼脂糖粉末,放到一锥形瓶中,加入适量的0.5×TBE电泳缓冲液。然后置微波炉加热至完全溶化,溶液透明。稍摇匀,得胶液。冷却至60℃左右,在胶液内加入适量的溴化乙锭至浓度为0.5μg/ml。
2、取有机玻璃制胶板槽,有透明胶带沿胶槽四周封严,并滴加少量的胶液封好胶带与胶槽之间的缝隙。
3、水平放置胶槽,在一端插好梳子,在槽内缓慢倒入已冷至60℃左右的胶液,使之形成均匀水平的胶面。
4、.待胶凝固后,小心拔起梳子,撕下透明胶带,使加样孔端置阴极段放进电泳槽内。
5、在槽内加入0.5×TBE 电泳缓冲液,至液面覆盖过胶面
6、把待检测的样品,按以下量在洁净载玻片上小心混匀,用移液枪加至凝胶的加样孔中。 1μl加样缓冲液(6×)+5μl待测DNA样品
〔+0.5μlEB 液(10mg/ml)(注:若胶内未加EB,可选用此法)。〕
7、接通电泳仪和电泳槽,并接通电源,调节稳压输出,电压最高不超过5V/cm,开始电泳。点样端放阴极端。根据经验调节电压使分带清晰。
8、观察溴酚兰的带(蓝色)的移动。当其移动至距胶板前沿约1cm处,可停止电泳。
9、染色:把胶槽取出,小心滑出胶块,水平放置于一张保鲜膜或其他支持物上,放进EB溶液中进行染色,完全浸泡约30min。
10、在紫外透视仪的样品台上重新铺上一张保鲜膜,赶去气泡平铺,然后把已染色的凝胶放在上面。关上样品室外门,打开紫外灯(360nm或254nm),通过观察孔进行观察。
五、注意事项
1、电泳中使用的溴化乙锭(EB)为中度毒性、强致癌性物质,务必小心,勿沾染于衣物、皮肤、眼睛、口鼻等。所有操作均只能在专门的电泳区域操作,戴一次性手套,并及时更换。
2、预先加入EB时可能使 DNA的泳动速度下降15%左右,而且对不同构型的DNA的影响程度不同。所以为取得较真实的电泳结果可以在电泳结束后再用0.5μg/ml的EB溶液浸泡染色。若胶内或样品内已加EB,染色步骤可省略;若凝胶放置一段时间后才观察,即使原来胶内或样品已加EB,也建议增加此步。
3、加样进胶时不要形成气泡,需在凝胶液未凝固之前及时清除,否则,需重新制胶。
4、以0.5×TBE作为电泳缓冲液时,溴酚兰在0.5%~1.4%的琼脂糖凝胶中的泳动速度大约相当于300bp的线性DNA的泳动速度,而二甲苯青 FF的泳动速度相当于4Kb的双链线形DNA的泳动速度。
第二篇:DNA琼脂糖凝胶电泳原理

琼脂糖凝胶电泳进行DNA/RNA定量原理
DNA(RNA)定量 分析可用紫外光谱分析,原理是DNA(RNA)分子在260 nm处有特异的紫外吸收峰,且吸收强度与DNA(RNA)的浓度成正比。此外,还可通过琼脂糖凝胶电泳上显示的DNA(RNA)带的亮度来分析,因为EB 作为一种荧光染料,能插入DNA(RNA)的碱基对平面之间而结合于其上,在紫外光的激发下产生荧光,DNA(RNA)分子上EB的量与DNA分子的长度 和数量成正比。在电泳时加入已知浓度的DNA(RNA)Marker作为DNA(RNA)分子量及浓度的参考,样品DNA(RNA)的荧光强度就可以大致 表示DNA(RNA)量的多少。这种方法的优点是简便易行,可结合琼脂糖凝胶电泳分析DNA(RNA)样品的完整性来进行,缺点是不太准。
琼脂糖凝胶的配制
根据所需凝胶的浓度秤取琼脂糖,加入相应电泳缓冲液中,用微波炉加热煮沸至琼脂糖完全溶解,加入适量 EB 混匀,适当冷却后倾入凝胶铸槽中,插入梳子,凝胶厚度不超过梳孔,如有气泡产生则用玻璃棒驱除,不能过早拔除梳子,应待凝胶完全凝结后才能拔除梳子。
3.P1、P2、P3的配制P1 的配制:在 800ml 去离子水中溶入 Tris 碱 6.06g,Na2EDTA?2H2O 3.72g,用 HCl 调整 pH 至 8.0,用去离子水调整容积至1升,每升P1内加入RNaseA100mg。
P2 的配制:在 950ml 去离子水中溶入 NaOH 8.0g,20%SDS 50ml,调整容积至 1 升。
P3 的配制:在 500ml 去离子水中溶入醋酸钾 294.5g,用冰醋酸调整 pH 值至 5.5,用去离子水调整容积至1升。
4.常用缓冲液:
TE
pH 7.4
10mmol/LTris?Cl (pH7.4)
1mmol/L EDTA(pH8.0)
pH 7.6
10mmol/LTris?Cl (pH7.6)
1mmol/L EDTA(pH8.0)
pH 8.0
10mmol/LTris?Cl (pH8.0)
1mmol/L EDTA(pH8.0)
STE(亦称 TEN)
0.1mmol/L NaCl
10mmol/LTris?Cl (pH8.0)
1mmol/L EDTA(pH8.0)
STET
0.1mmol/L NaCl
10mmol/LTris?Cl (pH8.0)
1mmol/L EDTA(pH8.0)
5%Triton X-100
TNT
10mmol/LTris?Cl (pH8.0)
150mmol/L NaCl
0.05% Tween 20
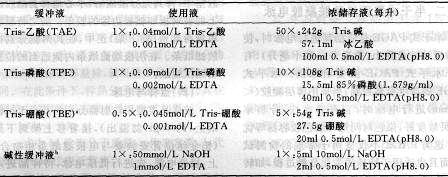
电泳缓冲液
Tris-乙酸(TAE):50×浓贮存液(每升):242g Tris 碱
5 7.1ml 冰乙酸
100ml 0.5mmol/L EDTA(pH8.0)
使用时再稀释50倍。
Tris-磷酸(TPE):10×浓贮存液(每升):108g Tris 碱
15.5ml 85%磷酸(1.679g /ml)
40ml 0.5mmol/L EDTA(pH8.0)
使用时再稀释10倍。
Tris-硼酸(TBE):5×浓贮存液(每升):54g Tris 碱
27.5g 硼酸20ml 0.5mmol/L EDTA(pH8.0)
使用时再稀释10倍。
碱性缓冲液:1×使用液(每升):5ml10mol/L NaOH
2ml 0.5mmol/L EDTA(pH8.0)
Tris-甘氨酸:5×浓贮存液(每升):15.1g Tris 碱
94g 甘氨酸(电泳级)(pH8.3)
50ml 10%SDS(电泳级)
2×SDS 凝胶加样缓冲液
100mmol/L Tris?HCl(pH6.8)
200mmol/L 二硫苏糖醇(DTT)
4%SDS(电泳级)
0.2%溴酚蓝
20%甘油
30%丙烯酰胺:
将29g 丙烯酰胺和1gN,N’-亚甲双丙烯酰胺溶于总体积为60ml的水中,加热至37℃溶解之,补加
水至终体积为100ml。用Nalgene滤器(0.45孔径)过滤除菌查证该溶液的pH值应不大于7.0,置棕色瓶中
保存于室温。
10mol/L 乙酸铵:
把770g 乙酸铵溶解于800ml水中,加水定容至1L后过滤除菌。
1mol/LCaCl2:
在200ml纯水中(Milli-Q水或相当级别的水)溶解54gCaCl2?6H2O,用0.22滤器过滤除菌,分装成10ml小份贮存于-20℃。
2.5mol/LCaCl2:
在20ml蒸馏水中溶解13.5gCaCl2?6H2O,用0.22滤器过滤除菌,分装成1ml小份贮存于-20℃。
1mol/L 二硫苏糖醇(DTT):
用20ml0.01mol/L乙酸钠溶液(pH5.2)溶解3.09gDTT,过滤除菌后分装成1ml小份贮存于-20℃。
0.5mol/LEDTA(pH8.0):
在 800ml 水中加入 186.1g 二水乙二胺四乙酸二钠(EDTA-Na?H2O),在磁力搅拌器上剧烈搅拌,用NaOH调节溶液的pH值至8.0,然后定容至1升,分装后高压灭菌备用。
溴化乙锭(10mg/ml):
在100ml水中加入1g 溴化乙锭,磁力搅拌数小时以确保其完全溶解,然后用铝箔包裹容器或转移至棕色瓶中,保存于室温。
1mol/LMgCl2:
在800ml水中溶解203.3gMgCl2?6H2O,用水定容至1升,分装成小份并高压灭菌备用。
酚:氯仿:
把酚和氯仿等体积混合后用0.1mol/LTris?Cl(pH7.6)抽提几次以平衡这一混合物,置棕色玻璃瓶中,上面覆盖等体积的0.01mol/LTris?Cl(pH7.6)液层,保存于4℃。
磷酸缓冲盐溶液(PBS):
在800ml蒸馏水中溶解8g NaCl、0.2g KCl、1.44gNa2HPO4和0.24gKH2PO4,用HCl调节溶液的pH 值至 7.4,加水定容至 1 升,高压蒸汽灭菌 20min。保存于室温。
乙酸钾溶液(用于碱裂解):
在60ml 5mol/L乙酸钾溶液中加入11.5ml冰乙酸和28.5ml;水,即成钾浓度为3mol/L而乙酸根浓度5mol/L的溶液。
3mol/L 乙酸钠(pH5.2 和 7.0):
在800ml水中溶解408.1g 三水乙酸钠,用冰乙酸调节pH值至5.2或用稀乙酸调节pH至7.0,加水定容至1升,分装后高压灭菌。
1mol/LTris:
在800ml水中溶解121.1gTris碱,加入浓HCl调节pH至所需值。
pH HCl
7.4 70ml
7.6 60ml
8.0 42ml
应使溶液冷至室温后方可最后调定pH值,加水定容至1升,分装后高压灭菌。
Tris 缓冲盐溶液(TBS):
在800ml蒸馏水中溶解8gNaCl、0.2gKCl和3gTris碱,加入0.015酚红并用HCl调pH值至7.4,用蒸馏水定容至1升,分装后在15lbf/in2(1.34×105Pa)高压下蒸汽灭菌20分鈡,于室温保存。
5mmol/LNH4Ac 溶液:
秤取乙酸铵192.7g,加重蒸水250ml混匀,加重蒸水定容至500ml,1.1kg/cm2灭菌20min。
10mg/mlBSA(小牛血清白蛋白)溶液:
秤取100mg小牛血清白蛋白溶于10ml灭菌重蒸水中。置4℃冰箱贮存备用。
10%十二烷基硫酸钠(SDS):
在900ml水中溶解100g 电泳级SDS,加热至68℃助溶,加入几滴浓盐酸调节溶液的pH值至7.2,加入水定容至1L,分装备用
琼脂糖凝胶电泳缓冲液的配制
实际工作中常用的缓冲液配制见表
琼脂糖凝胶电泳缓冲液配方
a.TBE浓储存液长时间存放后会形成沉淀物,为避免这一问题,可在室温条件下用玻璃瓶保存5X溶液,出现沉淀后则予以废弃。以往都以lX作为使用液(即1:5稀释浓储存液)进行琼脂糖凝胶电泳。但0.5X的使用液已具备足够的缓冲容量。目前几乎所有的琼脂糖凝胶电泳都以1:10稀释的储存液作为使用液。进行聚丙烯酰胺凝胶电泳使用的lXTBE,是琼脂糖凝胶电泳时使用液浓度的2倍。聚丙烯酰胺凝胶垂直槽的缓冲液槽较小,通过缓冲液的电流量通常较大,需要使用1XTBE以提供足够的缓冲容量
b.碱性电泳缓冲液应现用现配
在配制缓冲液时,不论哪一种都需要加适量的EDTA,以除去2价金属离子。另外,硼酸与琼脂糖易形成复合物,使凝胶带负电荷,可能会吸附带正电荷的物质。
琼脂糖凝胶电泳的操作步骤如下:
1. 制备1%琼脂糖凝胶(大胶用70ml,小胶用50ml):称取0.7 g(0.5 g)琼脂糖置于锥形瓶中,加入70 ml(50ml)1×TAE,瓶口倒扣小烧杯.微波炉加热煮沸3次至琼脂糖全部融化,摇匀,即成1.0%琼脂糖凝胶液.
2. 胶板制备:取电泳槽内的有机玻璃内槽(制胶槽)洗干净,晾干,放入制胶玻璃板.取透明胶带将玻璃板与内槽两端边缘封好,形成模子.将内槽置于水平位置,并在固定位置放好梳子.将冷却到65℃左右的琼脂糖凝胶液混匀小心地倒入内槽玻璃板上,使胶液缓慢展开,直到整个玻璃板表面形成均匀胶层.室温下静置直至凝胶完全凝固,垂直轻拔梳子,取下胶带,将凝胶及内槽放入电泳槽中.添加
1×TAE电泳缓冲液至没过胶板为止.
3. 加样:在点样板或parafilm上混合DNA样品和上样缓冲液,上样缓冲液的最终稀释倍数应不小于1X.用10 ul微量移液器分别将样品加入胶板的样品小槽内,每加完一个样品,应更换一个加样头,以防污染,加样时勿碰坏样品孔周围的凝胶面.(注意:加样前要先记下加样的顺序).
4. 电泳:加样后的凝胶板立即通电进行电泳,电压60-100V,样品由负极(黑色)向正极(红色)方向移动.电压升高,琼脂糖凝胶的有效分离范围降低.当溴酚蓝移动到距离胶板下沿约1cm处时,停止电泳.
(5)电泳完毕后,取出凝胶,用含有0.5 ug/ml的溴化乙锭1×TAE溶液染色约20 min,再用清水漂洗10 min.
(6)观察照相:在紫外灯下观察,DNA存在则显示出红色荧光条带,采用凝胶成像系统拍照保存
琼脂糖凝胶电泳步骤20##-10-24 17:21
a)用高压灭菌指示纸带将洗净、干燥的玻璃板的边缘(或电泳装置所配备的塑料盘的开口)封住,形成一个胶模。将胶模放在工作台的水平位置上(用水平仪校正)。
b)配制足够用于灌满电泳槽和制备凝胶所需的电泳缓冲液(通常是1x TAE或0.5xTBE)。在已加有一定量的电泳缓冲液的三角锥瓶或瓶盖未拧紧的玻璃瓶中加入准确称量的琼脂糖粉。缓冲液不宜超过锥瓶或玻璃瓶的50%容量。
c)在锥瓶的瓶颈上松松地塞上Kimwipes纸。如用玻璃瓶,瓶盖须拧松。在沸水浴或微波炉中将悬浮液加热至琼脂糖溶解。
d)用融化的琼脂糖封住边界。
e)在合适的位置上放置核子,以便加入琼脂糖后可以形成完好的加样孔。如果梳子距玻璃板再近,则拔出梳子时孔底将有破裂的危险.破裂后会使样品从凝胶与破璃板之间渗漏。
f)将剩余的温热琼脂糖溶液倒入胶模中。凝胶的厚度在3-5mm之间。检查一下梳子的齿下或齿间是否有气泡。
g)在凝胶完全凝固后(于室温放置30—45分钟),小心移去梳子和高压灭菌纸带,将疑胶放入电泳槽中。
h)加入恰好没过胶面约1mm深的足量电泳缓冲液。
i)DNA样品与所需加样缓冲液混合后,用一次性微量移液器,或者只要手不至颤动,亦可使用巴斯德吸管.慢慢将混合物加至样品槽中。此时凝胶已浸没在缓冲液中.
