酸碱滴定法测定混和碱各组分的含量
内容提要
根据甲基橙和酚酞两种指示剂所示终点时消耗的HCl标准溶液的体积,计算混和碱中各组分的含量。
目的要求
了解双指示剂法测定混和碱各组分含量的原理
实验关键
1. 掌握不同指示剂终点时消耗的HCl标准溶液的体积与各种碱的量的关系。
2. 基本操作技能的掌握程度(滴定管、移液管)。
实验原理
混和碱是指Na2CO3与NaOH或Na2CO3与NaHCO3的混和物,采用双指示剂法的测定原理和测定过程如下:
用酚酞作指示剂,HCl标准溶液滴定至溶液刚好褪色,此为第一化学计量点,消耗的HCl体积为V1/ml,有关的反应有
NaOH + HCl = NaCl + H2O
NaCO3 + HCl = NaHCO3 + NaCl
继续用甲基橙为指示剂,用HCl标准溶液滴定至溶液呈橙色,此为第二化学计量点,消耗的HCl体积为V2/mL,有关的反应为
NaHCO3 + HCl = NaCl + CO2 + H2O
可见,当混和碱组成为NaOH与Na2CO3时,V1 > V2, V2 > 0;
当混和碱组成为Na2CO3与NaHCO3时,V2 > V1,V1 > 0。
由HCl标准溶液的浓度和消耗的体积,可计算混和碱中各组分含量。
仪器、药品及材料
0.1mol/L HCl溶液;0.2%酚酞指示剂,0.2%甲基橙指示剂。
实验步骤
准确移取试液25.00mL于锥形瓶中,加入25mL去离子水,再加酚酞指示剂1 ~ 2滴,摇匀后用0.1mol/L HCl标准溶液滴定,边滴边充分摇动①,滴定至酚酞恰好褪色,即为终点,记下所用HCl标准溶液的体积V1。然后再加1滴甲基橙指示剂,继续用HCl标准溶液滴定至溶液由黄色变为橙色,即为终点,记下所用HCl标准溶液的体积V终点 ,计算混和碱各组分的含量。
注释① 摇动是为了避免局部Na2CO3直接被滴定至H2CO3。
思考题
滴定混和碱时,如果①V1 = V2;②V1 = 0,V2 > 0;③V2 = 0,V1 > 0,试样的组成如何?
实验记录与结果处理
HCl溶液滴定混合碱溶液 cHCl : mol/L ; 取样体积: mL

1. 根据V1和V2的体积判断混合碱的组成;
2. 计算混合碱中各组分的含量。
(MNa2CO3 = 106.0g/mol, MNaOH = 40.01g/mol, MNaHCO3 = 84.01g/mol )
第二篇:酸碱滴定法测定混合碱中各组分的含量
实验一 酸碱滴定法测定混合碱中各组分的含量
一、内容提要
根据甲基橙和酚酞两种指示剂所示终点时消耗的盐酸标准溶液的体积,计算混合碱中各组分的含量。
二、目的要求
了解双指示剂法测定混合碱各组分含量的原理和方法。
三、实验关键
1. 掌握不同指示剂终点时消耗的盐酸标准溶液的体积与各种碱的量的关系。
2. 基本操作技能的掌握程度(滴定管、移液管)。
四、实验原理
混和碱是指Na2CO3与NaOH或Na2CO3与NaHCO3的混和物,采用双指示剂法的测定原理和测定过程如下:
用酚酞作指示剂,盐酸标准溶液滴定至溶液刚好褪色,此为第一化学计量点,消耗的盐酸体积为V1 mL,有关的反应有
NaOH + HCl = NaCl + H2O
NaCO3 + HCl = NaHCO3 + NaCl
继续用甲基橙为指示剂,用盐酸标准溶液滴定至溶液呈橙色,此为第二化学计量点,消耗的盐酸体积为V2 mL,有关的反应为
NaHCO3 + HCl = NaCl + CO2 + H2O
可见,当V1 >V2, V2 > 0时,混和碱组成为NaOH与Na2CO3;
当V2 > V1,V1 > 0,混和碱组成为Na2CO3与NaHCO3。
由盐酸标准溶液的浓度和消耗的体积,可计算混和碱中各组分含量。
五、仪器、药品及材料
0.2mol·L-1 盐酸标准溶液;0.2%酚酞指示剂,0.2%甲基橙指示剂。
六、实验步骤
准确移取试液25.00mL,加25mL去离子水,加酚酞指示剂1–2滴,摇匀后用0.2mol·L-1 盐酸标准溶液滴定,边滴边充分摇动①,滴定至酚酞恰好褪色,即为终点,记下所用盐酸标准溶液的体积V1 。然后再加1–2滴甲基橙指示剂,继续用盐酸标准溶液滴定至溶液由黄色变为橙色,即为终点,记下所用盐酸标准溶液的体积V终点,计算混和碱各组分的含量。
注释① 摇动是为了避免局部Na2CO3直接被滴定至H2CO3。
七、实验记录与结果处理
HCl溶液滴定混合碱溶液 cHCl: mol·L-1 ; 取样体积: mL
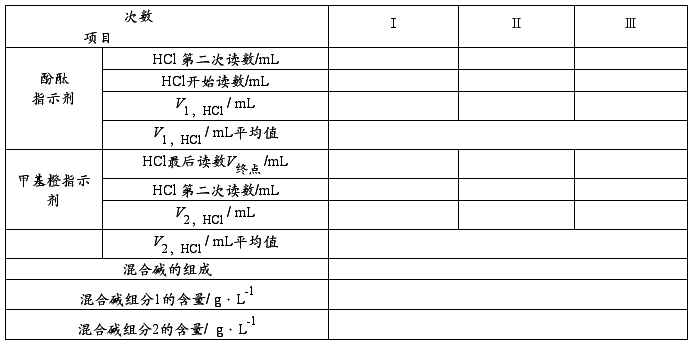
1. 根据V1 和 V2的体积判断混合碱的组成。
2. 计算混合碱中各组分的含量。其计算公式如下:
① Na2CO3与NaOH的混和物计算公式
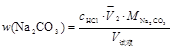
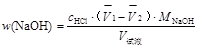
② Na2CO3与NaHCO3的混和物计算公式
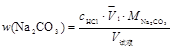
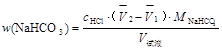
(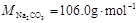 ,
,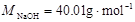 ,
, )
)
八、思考题:滴定混和碱时,如果①V1 = V2;②V1 = 0,V2 > 0;③V2 = 0,V1 > 0,试样的组成如何?
