附件2:
风险管理报告
(模版)
编 写:
风险管理参加人员:
日 期: 年 月 日
评 审:
日 期: 年 月 日
批 准:
日 期: 年 月 日
(盖章)
目 录
第一章 概述
第二章 风险管理人员及其职责分工
第三章 风险可接受准则
第四章 预期用途和与安全性有关的特征的判定
第五章 判定可预见的危害、危害分析及初始风险控制方案
第六章 风险评价、风险控制和风险控制措施验证
第七章 综合剩余风险评价
第八章 生产和生产后信息
第九章 风险管理评审结论
第一章 概述
1. 编制依据
1.1相关标准(按企业所生产产品的类型列举相关标准,以下标准为举例)
1)YY0316-2008 医疗器械——风险管理对医疗器械的应用
2)注册产品标准(XXXX YZB/国XXXX-2009)
3)其他标准
1.2产品的有关资料
1)使用说明书
2)医院使用情况、维修记录、顾客投诉、意外事故记录等
3)专业文献中的文章和其他信息
2.目的和适用范围
本文是对XXXX 进行风险管理的报告,报告中对XXXX 产品在上市后风险管理情况进行总体评价,所有的可能危害以及每一个危害产生的原因进行了判定。对于每种危害可能产生损害的严重度和危害的发生概率进行了估计。在某一风险水平不可接受时,采取了降低见的控制措施,同时,对采取风险措施后的剩余风险进行了可接受性评价,证实对产品的风险已进行了管理,并且控制在可接受范围内。
本报告适用于……产品,该产品处于批量生产阶段。
3.产品描述
本风险管理的对象是……(如能加入照片或图片最好),产品概述、机理、用途
适应症:
禁忌症:
设备由以下部分组成:(文字描述或示意图)
4. 风险管理计划及实施情况简述
XXXX 产品于20XX 年开始策划立项。立项同时,我们就针对该产品进行了风险管理活动的策划,指定了风险管理计划(文件编号:XXXX,版本号XX)。
该风险管理计划确定了风险管理活动范围、参加人员及职责和权限的分配、基于制造商决定可接受风险方针的风险可接受性准则,包括在损害发生概率不能估计时的可接受风险的准则、风险管理活动计划等内容。
XXXX 产品于20XX 年开始批量生产,未发生设计、材料、工艺等方面的变更(或者发生了XXXX 方面的变更,公司已针对变更情况制订了风险管理计划并实施了风险评估及纠正)。
第二章 风险管理人员及其职责分工
风险管理小组(team):

第三章 风险可接受准则
1.风险的严重度水平
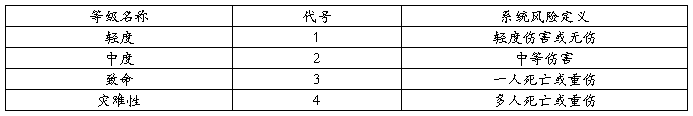
2.风险的概率分级
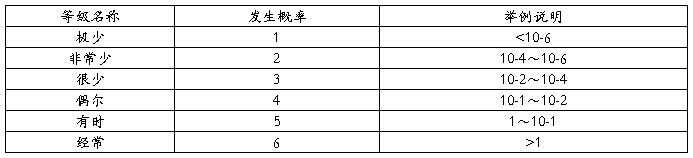
3.风险评价准则
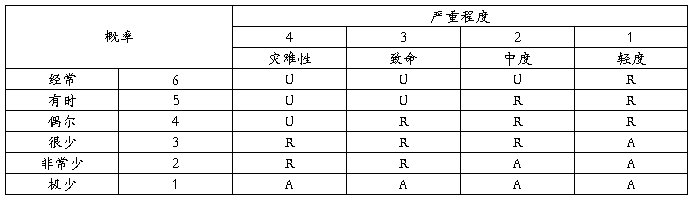
说明:A:可接受的风险;R:合理可行降低(ALARP)的风险;U:不经过风险/收益分析即判定为不可接受的风险
第四章 预期用途和与安全性有关的特征的判定
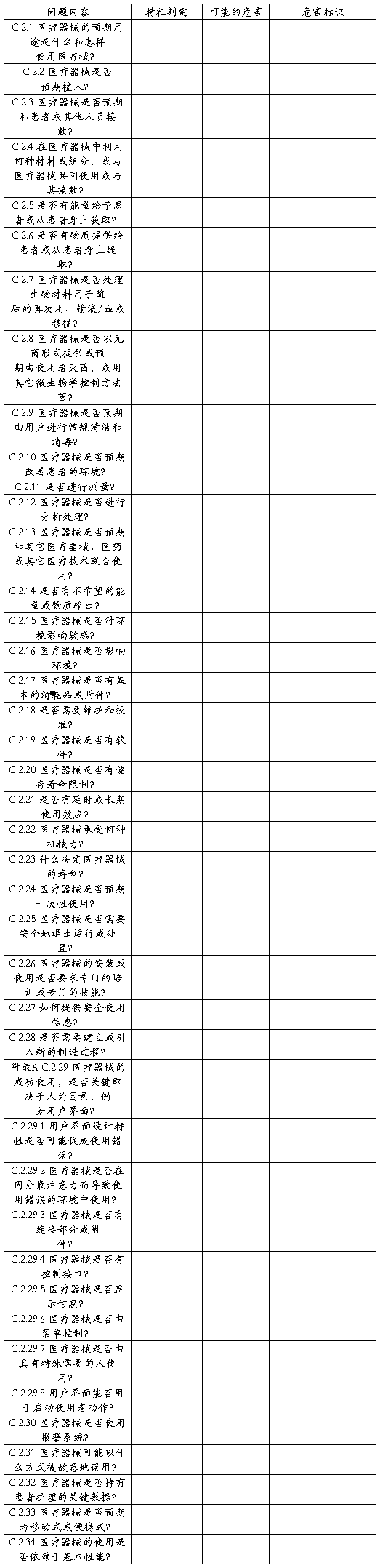
企业以YY0316-2008附录C为基础对医疗器械预期用途和与安全性有关的特征进行了判定,通过对涉及医疗器械的制造、预期使用者、预期用途、合理可预见的误用和最终处置等等提出一系列问题的方法,逐步了解该产品的安全性特征,为进一步的风险分析打下基础,XXXX产品安全特征问题清单如下:
表 1 XXXX 产品安全特征问题清单
第五章 判定可预见的危害、危害分析及初始风险控制方案
企业在对危害分析中,已考虑合理可预见的情况,它们包括正常条件下、故障条件下;对危害产生的后果或损害包括:对于患者的危害、对于操作者的危害、对于维修人员的危害、对于附近人员的危害、对于环境的危害。XXXX 产品的初始危害分析表见表2,包括可预见的事件序列、危害处境和可发生的损害及初始风险控制方案分析
表2:XXXX产品的初始危害分析表

第六章 风险评价、风险控制和风险控制措施验证
公司对已知危害进行风险评价,按照风险可接受准则判断每
个危害的风险是否达到可接受水平,对合理可行降低的风险、不
经过风险/收益分析既判定为不可接受的风险采取控制措施,并对具体措施进行实施验证,同时重新对采取措施后的风险进行估计,确认其风险水平是否可接受。XXXX产品风险评价、风险控制措施记录表见表3:
表3 XXXX 产品风险评价、风险控制措施记录表见表

第七章 综合剩余风险评价
公司在采取降低风险的措施后,……等危害的风险已降到广泛可接受的程度,……等危害的风险也降到了合理可行降低的程度。(还要说明采取降低风险的措施后,有没有引入新的风险,若有,则须进行再次评价和控制),经评审小组确认:产品综合剩余风险可接受。具体评价方面:
1)单个风险的风险控制是否有相互矛盾的要求?
结论:尚未发现现有风险控制有相互矛盾的情况。
2)警告的评审(包括警告是否过多?)
结论:警告的提示清晰,符合规范。
3)说明书的评审(包括是否有矛盾的地方,是否难以遵守)
结论:产品说明书符合10 号令及产品专用安全标准要求,相关产品安全方面的描述清晰易懂,易于使用者阅读。
4)和同类产品进行比较
结论:通过与XXX 公司的XXX 型XX产品进行的临床、性能、功能比较比较认为产品与目前市场上反映较好的XXX 公司的XXX 型XX产品从性能指标到功能及临床使用上是相同的。
5)与类似功能产品进行比较(必要时)
6)专家结论
结论:风险管理评审小组在分析了以上方面,并临床应用专家进行了充分的沟通后,一致评价,本产品的综合剩余风险可接受。
第八章 生产和生产后信息
医疗器械XXXX产品已正式投入生产并上市,公司已对生产和生产后信息收集和评审,并填写了XXXX产品生产和生产后信息收集表(表4),以决定是否需要改进产品(尤其安全性)和服务该项目风险管理负责人对得到的生产和生产后信息进行管理,必要时,风险管理小组开展活动实施动态风险管理。
表4:XXXX产品生产和生产后信息收集表
第九章 风险管理评审结论
风险管理评审小组经过对XXXX产品评审,认为:
- 风险管理计划已被适当地实施;
- 综合剩余风险是可接受的;
- 已有适当方法获得相关生产和生产后信息,并在适当时启动动态
风险管理程序。
XXXX产品全部剩余风险处于风险可接受准则的可接受范围内,且收
益超过风险。
签名:
第二篇:医疗器械风险管理报告
医疗器械风险管理报告
(XXX型XX诊断仪)
文件编号:
批 准 人:
批准日期:
目 录
第一章 综述………………………………………………………………3
第二章 风险管理评审输入………………………………………………4
第三章 风险管理评审……………………………………………………5
第四章 风险管理评审结论………………………………………………7
附录1 ………………………………………………………………………8
附录2 ………………………………………………………………………9
附录3 ………………………………………………………………………13
附录4 ………………………………………………………………………16
第一章 综述
1 产品简介
XXX型XX诊断仪其工作原理、产品组成、产品功能……。
(产品外形示意图)
2 风险管理计划及实施情况简述
XXX型XX诊断仪于20XX年开始策划立项。立项同时,我们就针对该产品进行了风险管理活动的策划,制定了风险管理计划(文件编号:XXXX 版本号:XX)。
该风险管理计划确定了XXX型XX诊断仪的风险可接受性准则,对产品设计开发阶段(包括试生产阶段)的风险管理活动以及生产和生产后信息的获得方法的评审要求进行了安排。
公司组成了风险管理小组,确定了该项目的风险管理负责人。确保该项目的风险管理活动按照风险管理计划有效的执行。
3 此次风险管理评审目的
本次风险管理的评审目的是通过对XXX型XX诊断仪产品在上市前各阶段风险管理活动进行总体评价,确保风险管理计划已经圆满地完成,并且通过对该产品的风险分析、风险评价和风险控制,以及综合剩余风险的可接受性评价,证实对产品的风险已进行了管理,并且控制在可接受范围内。
4 风险管理评审小组成员及其职责

第二章 风险管理评审输入
1 风险可接受准则
见附件1
2 风险管理文档
风险管理计划 文件编号:XXXX 版本号XX
XXX型XX诊断仪安全性特征问题清单 文件编号:XXXX 版本号XX
初始危害判断及初始风险控制方案分析 文件编号:XXXX 版本号XX
风险评价表、风险控制措施记录表 文件编号:XXXX 版本号XX
……
3 相关法规
……
关于执行 GB 9706.1-2007《医用电气设备 第一部分:安全通用要求》有关事项的通知 (国食药监械[2008]314号)
……
4 相关标准
GB 9706.1-2007
GB 9706.15-1999
YY 0505-2005
……
5 相关文件和记录
风险管理控制程序 文件编号:XXXX 版本号XX
产品设计开发文档(主要包括设计图纸、工艺、DFMEA表XXXXX、PFMEA表XXXXX等)
……
第三章 风险管理评审
1 风险管理计划完成情况
评审小组对风险管理计划的完成情况逐一进行了检查,通过对相关风险管理文档的检查,认为XXX型XX诊断仪风险管理计划已基本落实实施。
2 综合剩余风险可接受评审
评审小组对所有剩余风险进行了综合分析,考虑所有剩余风险共同影响下的作用,评
审结果认为:产品综合剩余风险可接受。具体评价方面:
1)单个风险的风险控制是否有相互矛盾的要求?
结论:尚未发现现有风险控制有相互矛盾的情况。
2)警告的评审(包括警告是否过多?)
结论:警告的提示清晰,符合规范。
3)说明书的评审(包括是否有矛盾的地方,是否难以遵守)
结论:产品说明书符合10号令及产品专用安全标准要求,相关产品安全方面的描述清晰易懂,易于使用者阅读。
4)和同类产品进行比较
结论:通过与XXX公司的XXX型XX诊断仪进行的临床比较;以及与YYY公司的XXX型XX诊断仪进行性能、功能比较分析,认为产品与目前市场上反映较好的这两款机型从性能指标到功能及临床使用上是相同的。
5)与类似功能产品进行比较(必要时)
6)专家结论
结论:风险管理评审小组在分析了以上方面,并与临床应用专家进行了充分的沟通后,一致评价,本产品的综合剩余风险可接受。
3 关于生产和生产后信息
生产和生产后信息获取方法参见《风险管理控制程序》(文件编号:XXX 版本号XX)中《生产和生产后信息获取方法表》。
评审组对《生产和生产后信息获取方法表》的适宜和有效性进行了评价,认为:该方法是适宜和有效的, XXX型XX诊断仪的生产和生产后信息的获取可使用此方法。该项目
风险管理负责人对得到的生产和生产后信息进行管理,必要时,风险管理小组开展活动实施动态风险管理。
4 评审通过的风险管理文档
本次评审后最终确定的风险管理文档:
……
《XXX型XX诊断仪安全特征问题清单》 文件编号:XXXX 版本号XX(见附件2)
《初始危害判定和初始风险控制方案分析》 文件编号:XXXX 版本号XX(见附件3)
《风险评价、风险控制措施评价表》 文件编号:XXXX 版本号XX(见附件4)
……
第四章 风险管理评审结论
风险管理评审小组经过对XXX型XX诊断仪产品评审,认为:
- 风险管理计划已被适当地实施;
- 综合剩余风险是可接受的;
- 已有适当方法获得相关生产和生产后信息。
XXX型XX诊断仪全部剩余风险处于风险可接受准则的可接受范围内,且受益超过风险。同意批准XXX型XX诊断仪申报注册。
签名:
批准:
附录1
风险评价和风险可接受准则
1 风险的严重度水平

2 风险的概率等级

注: 频次是指每台设备每年发生或者预期发生的事件次数。
3 风险评价准则
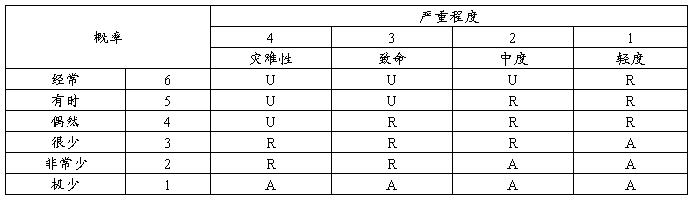
说明:A:可接受的风险;R:合理可行降低(ALARP)的风险;U:不经过风险/收益分析即判定为不可接受的风险
附录2
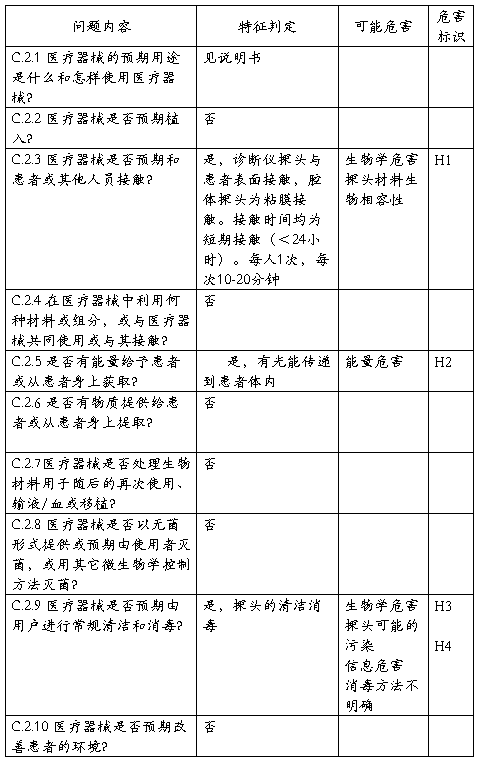
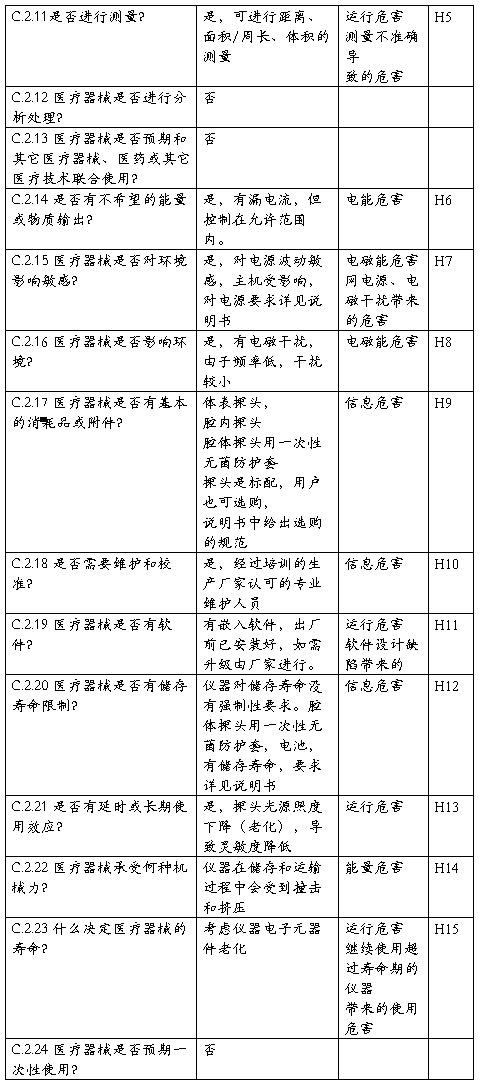
XXX型XX诊断仪安全特征问题清单
该清单依据YY/T0316-2008标准的附录C的问题清单,补充了有关XXX型XX
诊断仪产品的特有的安全性问题。
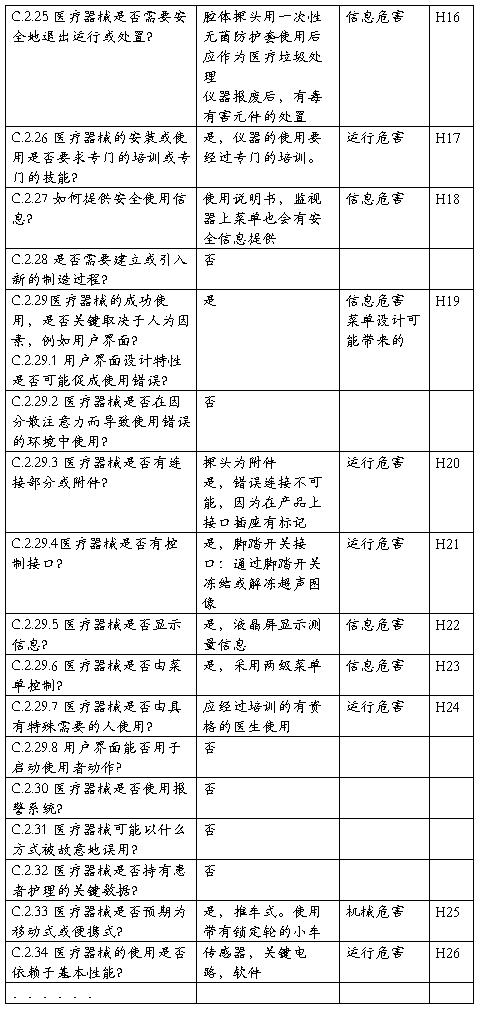
附录3
XXX型XX诊断仪的初始危害分析(PHA),包括可预见的事件序列、危害处境和可发生的损害及初始风险控制方案分析
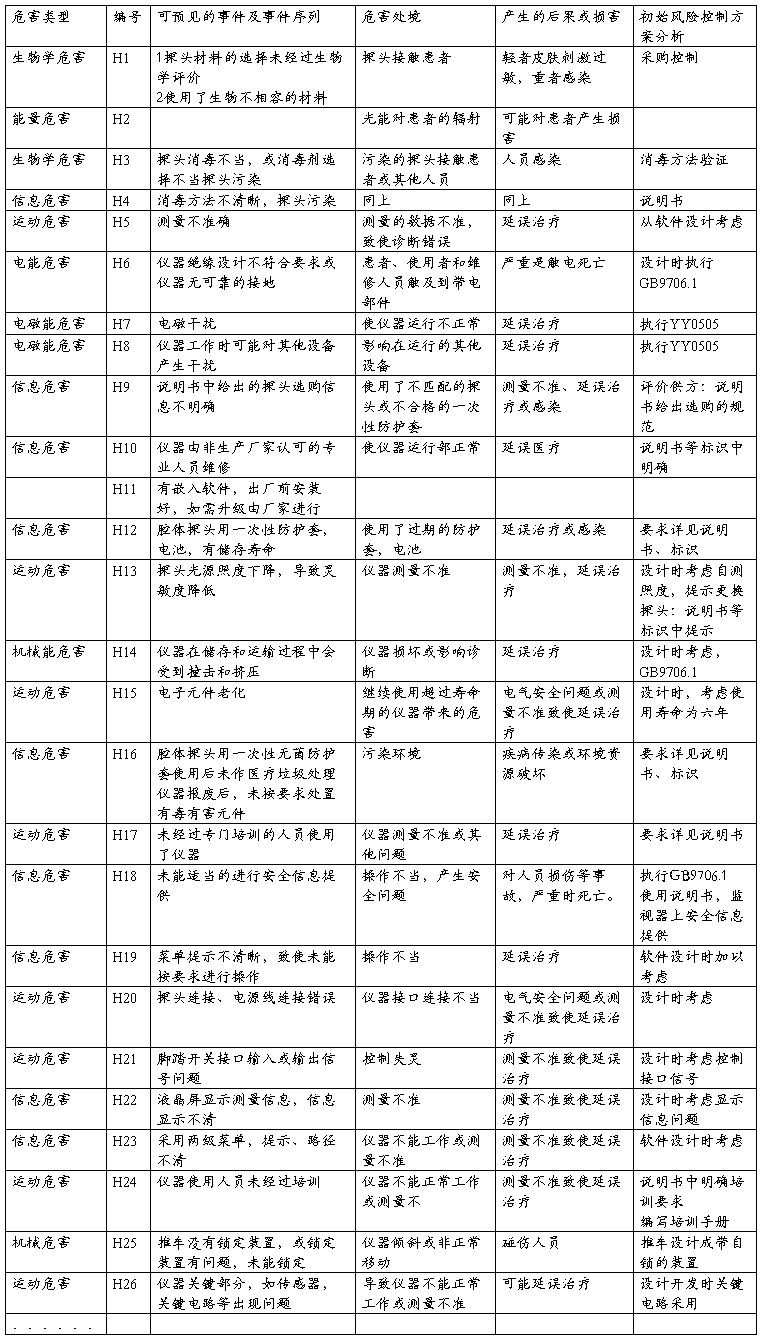
附录4
风险评价、风险控制措施记录表

说明:
本报告仅做为医疗器械产品上市前,制造商的风险管理评审活动所形成的风险管理报告的案例。
本报告中斜体字表示提示内容要求。
本报告可以作为风险管理报告的模板,但制造商在使用时应考虑相应的特定要求。
