实验八 环己烯的制备
计划学时:4学时
实验目的:
1、学习以浓硫酸催化环己醇脱水制备环己烯的原理和方法;
2、学习分馏原理及分馏柱的使用方法;
3、巩固水浴蒸馏的基本操作技能。
实验原理:
实验室中通常可用浓硫酸或浓磷酸催化环己醇脱水制备环己烯。本实验
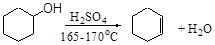 是以浓硫酸作催化剂来制备环己烯的。
是以浓硫酸作催化剂来制备环己烯的。
主反应式:
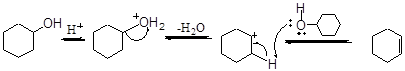 一般认为,该反应历程为E1历程,整个反应是可逆的:
一般认为,该反应历程为E1历程,整个反应是可逆的:
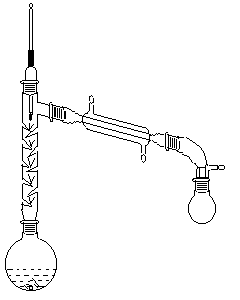 实验装置:见P.91图3.22
实验装置:见P.91图3.22
右下图:反应装置图
实验试剂:
15.0g(15.6ml,0.15mol)环己醇、
1ml浓硫酸、氯化钠、无水氯化钙、5%的
碳酸钠水溶液
实验步骤:
1、投料
在50ml干燥的圆底烧瓶中加入15g
环己醇、1ml浓硫酸和几粒沸石,充分摇振使之混合均匀(见【注释】),按P.91图3.22安装反应装置。
2、加热回流、蒸出粗产物产物
将烧瓶在石棉网上小火空气浴缓缓加热至沸,控制分馏柱顶部的溜出温度不超过90℃(见【注释】),馏出液为带水的混浊液。至无液体蒸出时,可升高加热温度(缩小石棉网与烧瓶底间距离),当烧瓶中只剩下很少残液并出现阵阵白雾时,即可停止蒸馏。
3、分离并干燥粗产物
将馏出液用氯化钠饱和,然后加入3—4ml 5%的碳酸钠溶液中和微量的
酸。将液体转入分液漏斗中,振摇(注意放气操作)后静置分层,打开上口玻塞,再将活塞缓缓旋开,下层液体从分液漏斗的活塞放出,产物从分液漏斗上口倒入一干燥的小锥形瓶中,用1—2g无水氯化钙干燥(见【注释】)。
4、蒸出产品
待溶液清亮透明后,小心滗入干燥的小烧瓶中,投入几粒沸石后用水浴
蒸馏(见【注释】),收集80—85℃的馏分于一已称量的小锥形瓶中。
实验关键步骤:
1、投料时应先投环己醇,再投浓硫酸;投料后,一定要混合均匀。
2、反应时,控制温度不要超过90℃。
3、干燥剂用量合理。
4、反应、干燥、蒸馏所涉及器皿都应干燥。
参考书目:
1、韩广甸 赵树纬 李述文 等编译《有机制备化学手册》上卷
2、曾昭琼 主编《有机化学实验》(第二版)
3、周科衍 吕俊民主编《有机化学实验》(第二版)
习题:
1、实验报告 2、P.124【思考题】(1)(2)(3)(4)
预习:P.129—131 正溴丁烷的制备
第二篇:环己烯的制备实验
环己烯的制备
一、实验目的
1、学习、掌握由环己醇制备环己烯的原理及方法。
2、了解分馏的原理及实验操作。
3、练习并掌握蒸馏、分液、干燥等实验操作方法。
二、实验原理

主反应为可逆反应,本实验采用的措施是:边反应边蒸出反应生成的环己烯和水形成的二元共沸物(沸点70.8℃,含水10%)。但是原料环己醇也能和水形成二元共沸物(沸点97.8℃,含水80%)。为了使产物以共沸物的形式蒸出反应体系,而又不夹带原料环己醇,本实验采用分馏装置,并控制柱顶温度不超过90℃。
反应采用85%的磷酸为催化剂,而不用浓硫酸作催化剂,是因为磷酸氧化能力较硫酸弱得多,减少了氧化副反应。
分馏的原理就是让上升的蒸汽和下降的冷凝液在分馏柱中进行多次热交换,相当于在分馏柱中进行多次蒸馏,从而使低沸点的物质不断上升、被蒸出;高沸点的物质不断地被冷凝、下降、流回加热容器中;结果将沸点不同的物质分离。详细的原理参见P88-89。
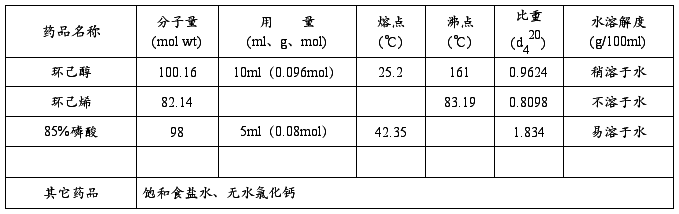
三、实验药品及物理常数
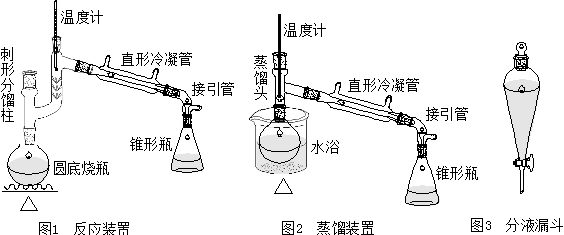
四、实验装置图
五、实验流程图
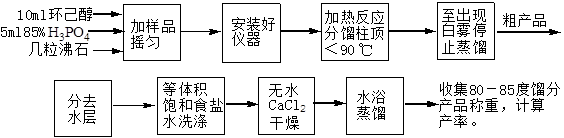
六、实验步骤
在50毫升干燥的圆底(或茄形)烧瓶中,放入10ml环己醇(9.6g,0.096mol)、5ml85%磷酸,充分振摇、混合均匀。投入几粒沸石,按图1安装反应装置,用锥形瓶作接受器。
将烧瓶在石棉网上用小火慢慢加热,控制加热速度使分馏柱上端的温度不要超过90℃,馏出液为带水的混合物。当烧瓶中只剩下很少量的残液并出现阵阵白雾时,即可停止蒸馏。全部蒸馏时间约需40min。
将蒸馏液分去水层,加入等体积的饱和食盐水,充分振摇后静止分层,分去水层(洗涤微量的酸,产品在哪一层?)。将下层水溶液自漏斗下端活塞放出、上层的粗产物自漏斗的上口倒入干燥的小锥形瓶中,加入1-2克无水氯化钙干燥。
将干燥后的产物滤入干燥的梨形蒸馏瓶中,加入几粒沸石,用水浴加热蒸馏。收集80-85℃的馏分于一已称重的干燥小锥形瓶中。产量4-5g。
本实验约需4h。
七、注意事项
1、环己醇在常温下是粘碉状液体,因而若用量筒量取时应注意转移中的损失。所以,取样时,最好先取环己醇,后取磷酸。
2、环己醇与磷酸应充分混合,否则在加热过程中可能会局部碳化,使溶液变黑。
3、安装仪器的顺序是从下到上,从左到右。十字头应口向上。
4、由于反应中环己烯与水形成共沸物(沸点70.8℃,含水l0%);环己醇也能与水形成共沸物(沸点97.8℃,含水80%)。因比在加热时温度不可过高,蒸馏速度不宜太快,以减少末作用的环己醇蒸出。文献要求柱顶控制在73℃左右,但反应速度太慢。本实验为了加快蒸出的速度,可控制在90℃以下。
5、反应终点的判断可参考以下几个参数:(1)反应进行40min左右。(2)分馏出的环己烯和水的共沸物达到理论计算量。(3)反应烧瓶中出现白雾。(4)柱顶温度下降后又升到85℃以上。
6、洗涤分水时,水层应尽可能分离完全,否则将增加无水氯化钙的用量,使产物更多地被干燥剂吸附而招致损失。这里用无水氯化钙干燥较适合,因它还可除去少量环己醇。无水氯化钙的用量视粗产品中的含水量而定,一般干燥时间应在半个小时以上,最好干燥过夜。但由于时间关系,实际实验过程中,可能干燥时间不够,这样在最后蒸馏时,可能会有较多的前馏分(环己烯和水的共沸物)蒸出。
7、在蒸馏已干燥的产物时,蒸馏所用仪器都应充分干燥。接收产品的三角瓶应事先称重。
8、一般蒸馏都要加沸石。
9、进实验室前,一定要事先查好原料、产品及副产品的物理常数,做到心中有数。
八、教学法
1、有条件的实验室,在用分馏装置进行实验时,可让学生分成几个小组,分别控制柱顶温度为71℃、85℃、93℃进行操作,然后用色谱法分析粗产物的组成,各组间交流实验结果,总结出严格控制反应条件的重要性。
2、正确理解共沸物概念及其在有机化学实验中的应用。
3、教学过程中,结合反应装置的选择,反应条件的控制,产物分离方法的选择等,强调在实验前查反应物、中间产物、产物、副产物的物理化学常数的重要性。养成实验前查物性常数的习惯,培养查阅手册的能力。
九、思考题
1、 在纯化环己烯时,用等体积的饱和食盐水洗涤,而不用水洗涤,目的何在?
答:在纯化有机物时,常用饱和食盐水洗涤,而不用水直接洗涤是利用其盐析效应,可降低有机物在水中的溶解度,并能加快水、油的分层。
2、 本实验提高产率的措施是什么?
答:本实验主反应为可逆反应,提高反应采取的措施是:边反应边蒸出反应生成的环己烯和水形成的二元共沸物,并控制柱顶温度不超过90℃。
3、 实验中,为什么要控制柱顶温度不超过90℃?
答:由于环己烯和水形成的二元共沸物(含水10%)沸点是70.8℃,而原料环己醇也能和水形成二元共沸物(沸点97.8℃,含水80%)。为了使产物以共沸物的形式蒸出反应体系,而又不夹带原料环己醇,本实验采用分馏装置,并控制柱顶温度不超过90℃。
4、 本实验用磷酸作催化剂比用硫酸作催化剂好在哪里?
答:采用硫酸作催化剂虽然反应速度较快,但由于硫酸的氧化性比磷酸强,反应时部分原料会被氧化、甚至碳化,使溶液颜色加深,产率有所降低。此外,反应时会有少量SO2气化放出。在纯化时,需要碱洗,增加了纯化步骤。
5、蒸馏时,加入沸石的目的是什么?
答:沸石就是未上釉的瓷片敲碎而成的小粒。它上面有很多毛细孔,当液体加热时,能产生细小的气泡,成为沸腾中心。这样可以防止液体加热时产生过热现象,防止暴沸,使沸腾保持平稳。
一般加热回流、蒸馏、分馏、水蒸汽发生器产生水蒸汽都需要加沸石。但减压蒸馏、水蒸气蒸馏、电动搅拌反应不需要加沸石。
在一次持续蒸馏时,沸石一直有效;一旦中途停止沸腾或蒸馏,原有沸石即失效,再次加热蒸馏时,应补加新沸石。如果事先忘了加沸石,决不能在液体加热到沸腾时补加。因为这样会引起剧烈暴沸,使液体冲出瓶外,还容易发生着火事故。故应该在冷却一段时间后再补加。
6、使用分液漏斗有哪些注意事项?
答:使用分液漏斗洗涤和萃取时,有以下注意事项:
(1)分液漏斗在长期放置时,为防止盖子的旋塞粘接在一起,一般都衬有一层纸。使用前,要先去掉衬纸,检查盖子和旋塞是否漏水。如果漏水,应涂凡士林后,再检验,直到不漏才能用。涂凡士林时,应在旋塞上涂薄薄一层,插上旋转几周;但孔的周围不能涂,以免堵塞孔洞。
(2)萃取时要充分振摇,注意正确的操作姿势和方法。
(3)振摇时,往往会有气体产生,要及时放气。
(4)分液时,下层液体应从旋塞放出,上层液体应从上口倒出。
(5)分液时,先把顶上的盖子打开,或旋转盖子,使盖子上的凹缝或小孔对准漏斗上口颈部的小孔,以便与大气相通。
(6)在萃取和分液时,上下两层液体都应该保留到实验完毕。以防止操作失误时,能够补救。
(7)分液漏斗用毕,要洗净,将盖子和旋塞分别用纸条衬好。
7、用无水氯化钙干燥有哪些注意事项?
答:(1)一般要在干燥的小锥形瓶中进行干燥。
(2)一般用块状的无水氯化钙进行干燥,便于后面的分离。
(3)用无水氯化钙干燥的时间一般要在半个小时以上,并不时摇动。但实际实验中,由于时间关系,只能干燥5-10分钟。因此,水是没有除净的,在最后蒸馏时,会有较多的前馏分(环己烯和水的共沸物)蒸出。
8、查药品物理常数的途径有哪些?
答:在进行或设计一个有机合成实验之前,必须首先弄清楚反应物料和生成物的物理常数,这样在反应、分离纯化时,才能设计出合理的工艺路线,操作时才能做到心中有数。通常查找物理常数有四个途径:
(1)在教材书中,每一章的物理性质都列出了一些常见化合物的物理常数。另外,在多数实验教材书的附表中,也列有一些常见溶剂和物料物理常数。
(2)在图书馆中,查阅相关的手册。主要查阅有机化合物手册、有机合成手册、化学手册、物理化学手册等。
(3)在网上查找,有些网站和化学品电子手册专门提供物理常数。
(4)在实验室的试剂瓶上,一般都列有主要物理性质的常数。
