 实验5:EDTA溶液的配制和标定与水的硬度分析
实验5:EDTA溶液的配制和标定与水的硬度分析
杨兰森20096842 应化三班
摘要:练习了配制EDTA,以CaCO3为基准物质标定EDTA,并以该EDTA溶液,通过络合滴定测定实验室自来水的硬度的实验操作,学习水的硬度测定的实验方法。了解该实验的实际意义,学习运用所学原理建立实验方法,并应用于生产实践。
关键词:EDTA配制和标定 水的硬度测定
前言:水的硬度最初是指钙、镁离子沉淀肥皂的能力。水的总硬度指水中钙、镁离子的总浓度,其中包括碳酸盐硬度(即通过加热能以碳酸盐形式沉淀下来的钙、镁离子,故又叫暂时硬度)和非碳酸盐硬度(即加热后不能沉淀下来的那部分钙、镁离子,又称永久硬度)。
硬度的表示方法尚未统一,我国使用较多的表示方法有两种:一种是将所测得的钙、镁折算成 CaO 的质量,即每升水中含有 CaO 的毫克数表示,单位为 mg·L-1 ;另一种以度计:1硬度单位表示10万份水中含1份CaO( 即每升水中含 10mgCaO),1° =10ppmCaO 。这种硬度的表示方法称作德国度。
根据水的用途不同对水的硬度要求也不同,各国也有各国的标准,饮用水:水的硬度的高低与人体的关系极大。高硬度的水中的钙、镁离子能与硫酸根结合,使水产生苦涩味,还会使人的胃肠功能紊乱,出现暂时的腹胀、排气多、腹泻等现象。
生活用水:水的硬度反应了水中钙、镁等离子的多少,这些离子能够影响洗涤剂等的效果
工业用水:水中钙、镁等离子能够腐蚀管道,影响溶液的作用,如石油工业的堵水剂,降凝剂,调剖剂等都受硬度的影响。
所以测定水的硬度是非常重要的,以便于做好对应的处理工作。
综述:络合滴定是实验室常见操作,常用络合剂EDTA的配制和标定是实验室基本准备实验,本实验练习EDTA的配制,以CaCO3为基准物质标定EDTA,并以标定后的EDTA测实验室自来水硬度,实验简单易行,且有重要的实际意义。在实验中总结经验由此熟练并掌握络合滴定的方法,培养实验技能及建立实验方案的能力。
实验部分:
(一)实验目的:学习EDTA标准溶液的配制和标定方法;掌握配位滴定的原理,了解配位滴定的特点;熟悉钙指示剂的使用;了解水的硬度测定意义和常用的硬度表示方法;掌握EDTA法测定水的硬度的原理和方法;掌握铬黑T和钙指示剂的应用,了解金属指示剂的特点。
(二)实验原理:(1)标定EDTA:标定EDTA常用的基准物质有Zn、ZnO、CaCO3、Bi、Cu、MgSO4·SO4、Hg等。EDTA若用于测CaO、MgO含量则宜选用CaCO3为基准物,首先加HCl溶液:CaCO3+2HCl CaCl2+CO2+H20然后把溶液转移到容量瓶中稀释,制成钙标准溶液。吸取该钙标准溶液滴定至溶液由酒红色变纯蓝色,在pH≥12溶液中HInd2-离子与Ca2+离子形成比较稳定的配离子,HInd2-(纯蓝色)+Ca2+
CaCl2+CO2+H20然后把溶液转移到容量瓶中稀释,制成钙标准溶液。吸取该钙标准溶液滴定至溶液由酒红色变纯蓝色,在pH≥12溶液中HInd2-离子与Ca2+离子形成比较稳定的配离子,HInd2-(纯蓝色)+Ca2+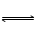 CaInd-(酒红色)+H+,EDTA能与Ca2+离子形成更稳定的配离子:CaInd2-+H2Y2-+OH-
CaInd-(酒红色)+H+,EDTA能与Ca2+离子形成更稳定的配离子:CaInd2-+H2Y2-+OH-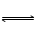 CaY2-+HInd2-+H2O终点由酒红色到纯蓝色。
CaY2-+HInd2-+H2O终点由酒红色到纯蓝色。
(2)水硬度测定:由镁离子形成的硬度称为“镁硬”,由钙离子形成的硬度称为“钙硬”,用EDTA配位滴定法测定,用铬黑T测定为总硬,用钙指示剂测为钙硬,总硬减去钙硬即为镁硬,硬度采用(°)表示,1硬度单位表示十万份水中含1份CaO即1°=10mg·L-1CaO.硬度计算式为:硬度(°)=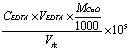
(三)仪器与试剂:酸式(或碱式)滴定管;CaCO3(固体AR);乙二胺四乙酸二钠(固体AR);钙指示剂;镉黑T指示剂;100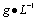 NaOH;镁溶液;1+1HCl。
NaOH;镁溶液;1+1HCl。
(四)实验方法:
(1)EDTA标定:1.配制0.015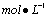 EDTA溶液:称取2.7923g左右乙二胺四乙酸二钠溶解于适量温水中,稀释至500mL转移至500mL细口瓶中。
EDTA溶液:称取2.7923g左右乙二胺四乙酸二钠溶解于适量温水中,稀释至500mL转移至500mL细口瓶中。
2.以CaCO3为基准物质标定EDTA:1标准钙溶液的配制:称取0.25~0.3g CaCO3于小烧杯中,加水润湿,在慢慢滴入1+1HCl至完全溶解,加热近沸,冷却后转移入250mL容量瓶中,稀释至刻度,摇匀。2标定:用移液管移取25mL标准钙溶液,置于锥形瓶中加入约25mL水、2mL镁溶液、5mL100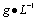 NaOH溶液及约10mg钙指示剂,摇匀后,有EDTA滴定至由红色变为蓝色,即为终点。
NaOH溶液及约10mg钙指示剂,摇匀后,有EDTA滴定至由红色变为蓝色,即为终点。
(2)水的硬度测定:1.总硬测定:量取澄清自来水100mL放入250mL锥形瓶中,加入约0.01g铬黑T指示剂,再摇匀,以配制的EDTA标准溶液滴定至纯蓝色即为终点。
2.钙硬测定:量取澄清的自来水样100mL,放入250mL锥形瓶中加4mL100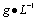 NaOH溶液,摇匀再加入0.01g钙指示剂,摇匀,此时溶液呈淡红色,用配制好的EDTA滴定至呈纯蓝色为终点。
NaOH溶液,摇匀再加入0.01g钙指示剂,摇匀,此时溶液呈淡红色,用配制好的EDTA滴定至呈纯蓝色为终点。
3.镁硬的测定:用总硬减去钙硬即得镁硬。
(五)结果与讨论:
(1)EDTA浓度的标定:
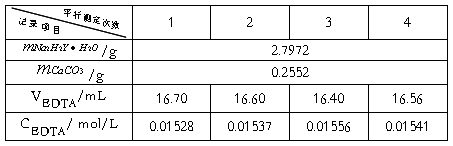
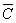 EDTA=0.01541
EDTA=0.01541 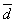 =8.0×10-5
=8.0×10-5  =
=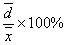 =0.519% S=1.17×10-4
=0.519% S=1.17×10-4
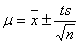 =0.01541±1.86×10-4(置信度为95%)
=0.01541±1.86×10-4(置信度为95%)
(2)水的总硬:
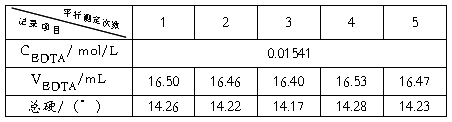
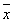 =14.23
=14.23 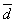 =3.04×10-2
=3.04×10-2  =
=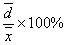 =0.214% S=4.21×10-2
=0.214% S=4.21×10-2
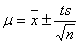 =14.23±0.0524(置信度为95%)
=14.23±0.0524(置信度为95%)
(3)水的钙硬:
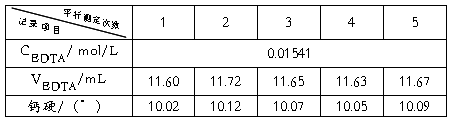
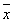 =10.07
=10.07 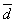 =2.80×10-2
=2.80×10-2  =
=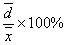 =2.78×10-3 S=3.81×10-2
=2.78×10-3 S=3.81×10-2
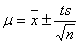 =10.07±0.0473(置信度为95%)
=10.07±0.0473(置信度为95%)
(4)水的镁硬:
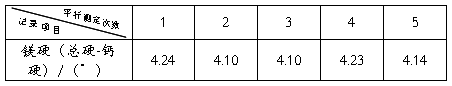
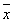 =4.16
=4.16 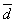 =5.84×10-2
=5.84×10-2  =
=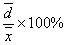 =1.40×10-2 S=6.87×10-2
=1.40×10-2 S=6.87×10-2
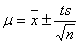 =4.16±0.0855(置信度为95%)
=4.16±0.0855(置信度为95%)
(5)EDTA配制和标定的准确度:
由于实验室蒸馏水的纯度不够,其中含Ca2+超标,致使EDTA配制和标定不能有足够准确度,实验时所配EDTA浓度比原方案稍大(0.015 mol/L),以减少实验误差。
结论
结合实验数据及结果,精密度及误差在允许范围内,满足分析实验要求,说明该实验方法可行度大,有一定重现性,是一次较成功的实验。
致谢
此次实验是在吴明君老师的精心指导下完成的,在此衷心感谢吴老师!
参考文献:
[1]:《分析化学实验》第三版(高等教育出版社)
[2]:《分析化学》.武汉大学.(高等教育出版社)
[3]:宋天佑,程鹏,王杏乔.《无机化学》.(高等教育出版社)
第二篇:EDTA标准溶液的配制和标定水的总硬度的测定
EDTA标准溶液的配制和标定水的总硬度的测定
仪器与试剂
1、仪器
电子天平(0.1mg)容量瓶(100mL)
移液管(20mL)酸式滴定管(50mL)
锥形瓶(250mL)
2、试剂
0.2mol ·L1EDTA (Na2H2Y·2H2O)MgSO4 · 7H2O基准试剂 -
NH3-NH4Cl缓冲溶液(pH=10.0)1mol·L1NaOH -
铬黑T指示剂钙指示剂
五、实验原理
乙二胺四乙酸二钠盐(习惯上称EDTA)是有机配位剂,能与大多数金属离子形成稳定的1:1 型的螯合物,计量关系简单,故常用作配位滴定的标准溶液。
通常采用间接法配制EDTA标准溶液。标定EDTA溶液的基准物有Zn、ZnO、CaCO3、Bi、Cu、MgSO4 · 7H2O、Ni、Pb 等。选用的标定条件应尽可能与测定条件一致,以免引起系统误差。如果用被测元素的纯金属或化合物作基准物质,就更为理想。本实验采用MgSO4 · 7H2O作基准物标定EDTA,以铬黑T(EBT)作指示剂,用pH ≈10 的氨性缓冲溶液控制滴定时的酸度。因为在pH ≈10 的溶液中,铬黑T 与Mg2+ 形成比较稳定的酒红色螯合物(Mg—EBT),而EDTA与Mg2+
能形成更为稳定的无色螯合物。因此,滴定至终点时,EBT 便被EDTA 从Mg—EBT中置换出来,游离的EBT 在pH = 8~11 的溶液中呈蓝色。
滴定前:M + EBTM—EBT
(酒红色)
主反应:M + EDTA M—EDTA
终点时:M—EBT + EDTA
酒红色蓝色 M—EDTA + EBT 含有钙、镁离子的水叫硬水。测定水的总硬度就是测定水中
钙、镁离子的总含量,可用EDTA配位滴定法测定。滴定时,Fe3+、Al3+等干扰离子可用三乙醇胺予以掩蔽;Cu2+、Pb2+、Zn2+等重属离子,可用KCN、Na2S或巯基乙酸予以掩蔽。
水的硬度有多种表示方法,本实验要求以每升水中所含Ca2+、Mg2+总量(折算成CaO的质量)表示,单位mg·L-1。
六、实验步骤
1、0.01mol ·L1 EDTA 标准溶液的配制: -
取30mL 0.1mol ·L1的EDTA于试剂瓶中,加水稀释至300 mL,摇匀,备用。 -
2、0.01 mol ·L-1镁标准溶液的配制:
准确称取MgSO4 · 7H2O基准试剂0.25~0.3g,置于小烧杯中,加30 mL蒸馏水溶解,定量转移到100mL 容量瓶中,加水稀释至刻度,摇匀。计算其准确浓度。
3、EDTA 标准溶液浓度的标定:
用移液管吸取镁标准溶液20.00mL 置于250mL 锥形瓶中,加5mL pH ≈10 的NH3-NH4Cl缓冲溶液,加入铬黑T指示剂少许,用EDTA 标准溶液滴定至溶液由酒红色恰变为蓝色,即达终点,平行测定三次。根据消耗的EDTA标准溶液的体积,计算其浓度。
4、水的总硬度测定:
用100mL移液管或量筒取100mL水样于250mL锥形瓶中,加氨性缓冲溶液5mL, EBT指示剂少许,用EDTA标准溶液滴定,至溶液由酒红色变为蓝色即为终点,记录所消耗EDTA的体积V1。平行测定3次。
5、钙的测定:
取与步骤4等量的水量于250mL锥形瓶中,加5mL 1mol·L1NaOH, 钙指示剂-
少许,用EDTA标准溶液滴定至溶液由酒红色变为蓝色即为终点,记录所消耗EDTA的体积V2。平行测定3次。
七、数据记录与处理
1、EDTA的标定
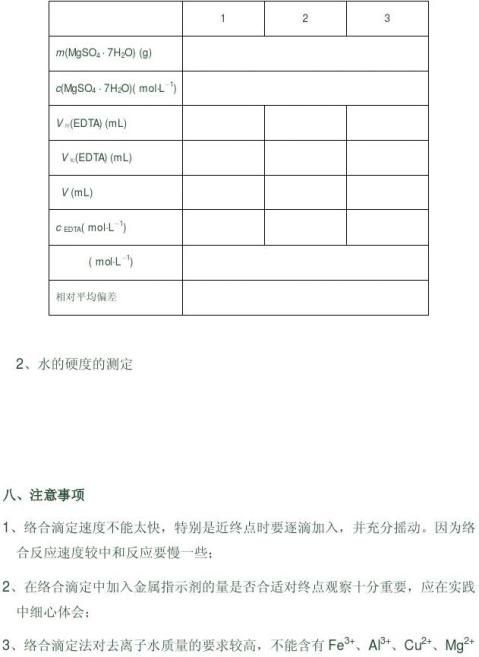
等离子。
九、思考题
1、用铬黑T 指示剂时,为什么要控制pH ≈10?
2、配位滴定法与酸碱滴定法相比,有哪些不同?操作中应注意哪些问题?
3、用EDTA滴定Ca2+、Mg2+时,为什么要加氨性缓冲溶液?
