紫罗兰酮的合成实验报告
实验目的:
1.了解和利用柠檬醛直接合成假紫罗兰酮的缩合反应的步骤及影响产率的因素,确立化学反应的条件。
2.掌握由假性紫罗兰酮合成紫罗兰酮的方法与步骤。并初步探讨在本实验的基础上用什么方法可将α-紫罗兰酮和β-紫罗兰酮分离开。
3.初步了解了紫罗兰酮在有机合成及工业上的应用。
实验原理:
紫罗兰酮是一种广泛应用于香精,香水和化妆品等产品中十分重要的香料。它是一种萜,它存在于精油中,为α-和β-紫罗兰酮的混合物,紫罗兰酮为浅黄色粘稠液体。它是配制高档香精的原料,其用量大,用途广。紫罗兰酮有三种异构体:α-紫罗兰酮,β-紫罗兰酮,γ-紫罗兰酮
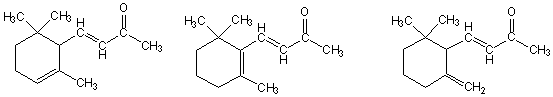 α-紫罗兰酮 β-紫罗兰酮 γ-紫罗兰酮
α-紫罗兰酮 β-紫罗兰酮 γ-紫罗兰酮
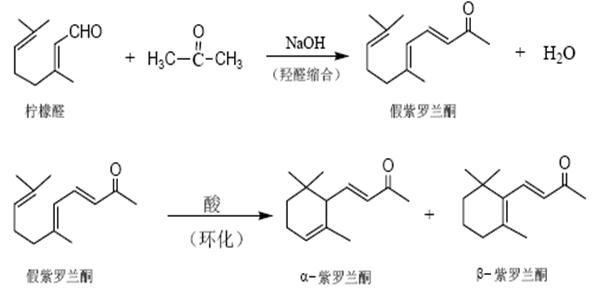
在合成在中,现在合成紫罗兰酮的方法主要有两种.一种是全合成法,即以乙炔和丙酮为起始原料的合成路线和以异戊二烯为起始原料的合成路线,对纯度要求很高的β-紫罗兰酮(医药工业用)可采用全合成路线,另一种是半合成路线,即以天然精油中所含的柠檬醛和松节油中的α-蒎烯为起始原料的合成路线,目前多采用柠檬醛来合成工业紫罗兰酮,20世纪50年代以前是从亚热带生长的柠檬草中提取柠檬醛,现在都改用中国的苍山子精油为原料提取柠檬醛.苍山子精油里面含有的柠檬醛含量很高,质量分数高达60%-90%,而且产量较高,于是本次实验也采用的是柠檬醛和丙酮来合成紫罗兰酮.
含α-H原子的醛(酮)的α-H原子具有活性,会在碱环境中脱去,而与双键氧相连的碳原子因为电子对偏离呈正电性,会与负电的碳结合,形成缩合产物,即含有一个羟基和一个羰基的化合物.其中正碳那边连接的是为羟基,此时的产物即为假性的紫罗兰酮,然后同样在碱性的条件下,加热,会促使假性紫罗兰酮脱去一分子的水生成烯,即为紫罗兰酮。
实验主要试剂及仪器:
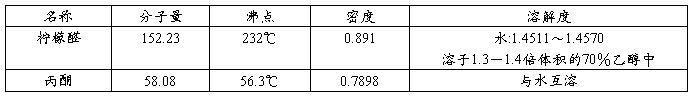
100ml三口瓶1个、磁力搅拌器1个,50ml锥形瓶2个,温度计1支(量程为100℃),水浴锅一个,冰50ml,250ml烧杯1个,分液漏斗1个,滴管1个,10ml量筒1个;
柠檬醛 10ml(0.891g/L)
丙酮 30ml(0.7898 g/L)
NaOH溶液 5ml(质量分数5%)
硫酸 5ml
甲苯 18ml
表:主要物料及其物理常数
实验步骤:

实验结果及讨论:
气相色谱图:
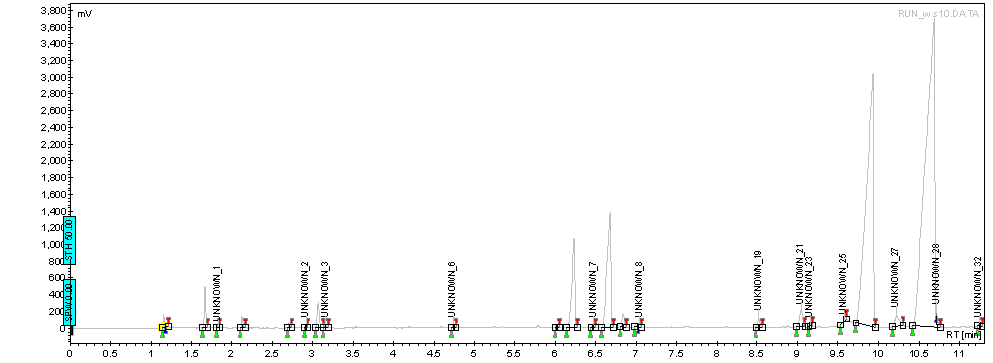
各组分含量:
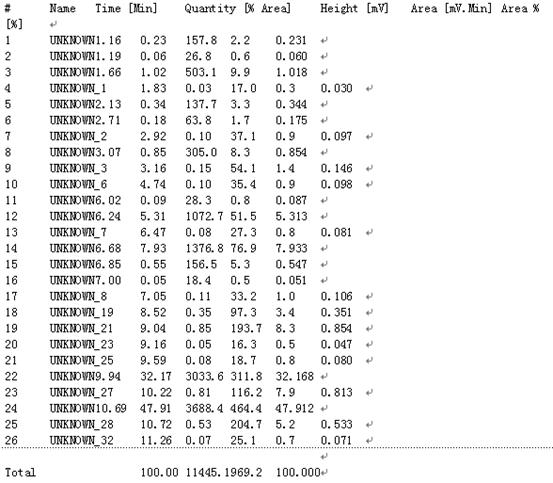
由实验数据可知纯α-紫罗兰酮的产量较高:分析原因如下:
1. 丙酮与柠檬醛配比影响,本实验配比为3;1,不适宜的配比,可加剧柠檬醛、丙酮的自身缩合,柠檬醛与假性紫罗兰酮的连串反应及柠檬醛与水的平行反应等一系列副反应的发生,使假性紫罗兰酮的合成收率偏低,最终使紫罗兰酮的合成收率偏低。
2. 在合成假紫罗兰酮时,控制适宜缩醛温度在25-30℃度
3. 在合成假紫罗兰酮时,反应时间比较充分,实验条件限制
4. 紫罗兰酮的制备用的催化剂为硫酸,对环化反应效果不是很好,查文献知用85%的磷酸催化环化时,假性紫罗兰酮制备紫罗兰酮时收率较高。
5. 环化反应控制条件很好,如温度需在低温10-15℃,强酸性介质中进行,产生许多副反应及生成较多β-紫罗兰酮,对α-紫罗兰酮产率产生影响。
6. 实验操作过程各种误差带来产率的影响
注意事项:
1. 在合成假紫罗兰酮时,要控制温度在25-30℃度
2. 环化反应宜在溶剂相对密度大、低温、强酸性介质中进行
3. 加硫酸时要剧烈搅拌
4. 柠檬醛在光、热或酸、碱以及氧气存在下能引起聚合和氧化,
这给柠橄醛的分离带来了一定的困难。而且柠檬醛有一定的
挥发性, 在水中溶解度小, 所以可以采用水蒸汽蒸馏法分离
第二篇:氧代_紫罗兰酮的合成
研究报告
香料香精化妆品?
20xx年10月第5期
FLAVOURFRAGRANCECOSMETICS?October,2009,NO?5
氧代???紫罗兰酮的合成*
作??者
1.贵州大学化学与化工学院,贵阳?550003;2.贵州中烟工业公司技术中心,贵阳?550003;
3.四川大学化学学院,成都?610045
……………………………杨?敏?董?睿?彭黔荣
1
1
2
通讯作者简介
彭黔荣(1962?),男,博士,副教授,硕士生导师,研究方向:烟草化学与工程。
E?mail:ce.myang@
杨建辉1?谢如刚3?惠建权2
摘??要
??在吡啶溴鎓和吡啶氯鎓离子液[Epy]Br、[Bpy]Br和[Bpy]Cl中,以氯化亚铜为催化剂,叔丁基过氧化氢为氧化剂,可以直接将??紫罗兰酮选择性氧化合成4?氧代???紫罗兰酮,收率可达55%。该方法使用了无毒的氧化剂和催化剂,反应介质和催化剂氯化亚铜可回收再利用,因此是一种有效和环境友好的合成氧代???紫罗兰酮的方法。
关键词
吡啶溴/氯鎓离子液?氯化亚铜?4?氧代???紫罗兰酮?合成
SynthesisofOxo???ionone*
YANGMin1?DONGRui1?PENGQianrong2?YANGJianhui1?XieRugang3?HUIJianquan2
(1.SchoolofChemistryandChemicalEngineering,GuizhouUniversity,Guiyang?550003,China;2.TechnologyCenter,ChinaTobaccoGuizhouIndustrialCompany,Guiyang?550003,China;3.DepartmentofChemistry,SichuanUniversity,Chengdu?610045,China)
Abstract?Usingcopper(I)chlorideascatalystandtert?butylhydroperoxideasoxidant,??iononecouldbeselectivelyoxidizedto4?oxo???iononewithyieldof55%inethylorbutylpyridiniumbromideorchlorideionicliquids,[Epy]Br,[Bpy]Brand[Bpy]Cl.Thisisanefficientandgreenprocedurebecauseoftheutilizationoflesstoxicoxidantandcoppersaltcatalyst,andtherecoveryandreuseofthecatalyticsystemhavebeenachieved.
Keywords?pyridiniumbromide/chlorideionicliquids?copper(I)chloride?4?oxo???ionone?synthesis
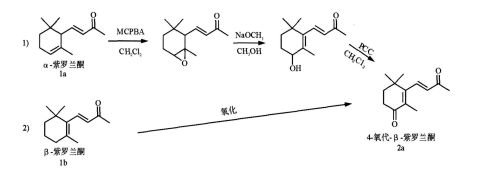
??4?氧代???紫罗兰酮(4?oxo???ionone,2a)化学名为4?(2,6,6?trimethyl?2?cyclohexene?one?1?yl)?3?buten?2?one,是合成类胡萝卜素中的角黄素(Can?thaxanthin)和虾青素(Axtaxanthin)的中间体[1?3]。近年来的研究表明:角黄素和虾青素对ER+乳腺癌细胞有较强的抑制作用。4?氧代???紫罗兰酮的合成主要有两条路线(见图1):?以??紫罗兰酮为原料,经环氧化、环氧开环、烯醇氧化获得[1,3]; 以??紫罗兰酮为原料,直接将羰基引入其分子中环己烯结构的烯丙位获得。显然,第二条合成路线从相应的烯烃一步烯丙位氧化合成4?氧代???紫
*
罗兰酮是最理想和简便的途径。然而,实现这一转移传统的方法多采用含铬试剂[2,7,8],例如吡啶氯铬酸配合物-二甲亚砜的体系、三氧化铬-乙酸体
系[7]、铬酸叔丁酯-苯的方法[8],而且这些方法产率低,后处理会产生大量危害环境的含铬废渣和废水。此外,还有氯酸钠体系;近年来,建立了以CaCl2或MgCl2作催化剂[10],以及活性铜粉和铜盐作催化剂在有机溶剂中催化紫罗兰酮烯丙位氧化[11]引入羰基的方法。这些新的双相和单相系统提高了反应的转化率和产率,但是,产物与催化剂分离以及催化剂的回收利用的问题仍然存在。
[9][2]
[4?6]
[2,7?9]
基金项目:贵州省科学技术基金项目(黔科合J字[2008]2022号)
收稿日期:2009?06?02
!12!www.ffc?journal.com
香料香精化妆品?
20xx年10月第5期
FLAVOURFRAGRANCECOSMETICS?October,2009,NO?5
研究报告
图1?4?氧代???紫罗兰酮的合成路线
??离子液是一类有机阳离子的盐,具有良好的溶解性(可溶解有机、无机以及金属有机化合物等)、有很高的热稳定性和化学稳定性、非挥发性和不燃烧性。其中咪唑鎓离子液作为环境友好和可以回
[12,13]
收的反应介质和催化剂,受到了极大的关注。许多反应在其中得以实现,取得了比有机溶剂更好或相当的结果。值得注意的是,近年来吡啶鎓离子液可由廉价的含氮杂环吡啶合成,是一类比咪唑鎓离子液更加价廉和稳定的离子液[14],探索在这类低成本离子液中的有机反应正成为研究的热点[15]。
在此,本文采用价廉的乙基或丁基吡啶溴鎓盐或氯鎓盐和氯化亚酮([Epy]Br、[Bpy]Br或[Bpy]Cl/CuCl)离子溶液作为反应介质与催化剂,以氧化后产生无毒丁醇的叔丁基过氧化氢为氧化剂,对??紫罗兰酮进行烯丙位氧化,合成了4?氧代???紫罗兰酮。该方法反应条件温和、产率可达53%~55%;并且反应介质和催化剂可循环使用,不用加入碱或其它配体,为4?氧代???紫罗兰酮这一重要中间体的合成建立了一种有效和环境友好的方法,见图2和图3

。
1?实验部分
1.1?仪器与试剂
仪器:VarianStarCP?3800GC气相色谱仪(美国Varian公司);HP6890型气相色谱/HP5973质谱联用仪(美国Agilent公司);VarianINOVA400
1
MHzSpectrometer核磁仪(HNMR)(美国Varian公司)。
试剂:溴乙烷、正溴丁烷、正氯丁烷、吡啶、氯化亚铜(AR,国药集团化学试剂有限公司),70%叔丁基过氧化氢水溶液(AR,AcrosCo.),97%??紫罗兰酮(AR,RhodiaCo.),乙酸乙酯、乙醚、二氯甲
烷、石油醚(AR,成都科龙试剂有限公司),柱层析硅
胶(200~300目)(FCP,青岛海洋化工厂),其它试剂均为分析纯。
1.2?乙基或丁基吡啶鎓溴盐或氯盐([Epy]Br、[Bpy]Br或[Bpy]Cl)离子液的制备
[14,15]
按照文献方法合成这几种离子液。在装有回流冷凝器的150mL二颈圆底烧瓶中,加入0.6mol(48mL)的吡啶,搅拌下滴加0.72mol(54mL)的溴乙烷或0.72mol(78mL)的正溴丁烷或0.72mol(65mL)正氯丁烷,滴加溴乙烷的体系反应温度不要超过60?,滴加正溴丁烷或正氯丁烷
www.ffc?journal.co
m!13!
研究报告
的体系反应温度不要超过80?,待溴乙烷和正溴丁烷滴加完毕,分别在60?和80?下反应,以TLC(展开剂为V二氯甲烷#V甲醇=9#1)跟踪,到原料吡啶点消失为止。减压蒸出过量的卤代烷烃,经乙醚洗、二氯甲烷重结晶,50?下真空干操3h,即可获得白色固体??乙基吡啶溴鎓、??丁基吡啶溴鎓和??丁基吡啶氯鎓([Epy]Br、[Bpy]Br或[Bpy]Cl)。1.3?4?氧代???紫罗兰酮的合成及离子液和催化剂的回收
在25mL圆底烧瓶中,加入0.198g(1mmol)的??紫罗兰酮,1g的离子液([Epy]Br、[Bpy]Br或[Bpy]Cl),温度保持在60?,搅拌下加入0.002g~0.02g(2%~20%,摩尔百分比)的CuCl,再加入0.68mL(5mmol)叔丁基过氧化氢(t?BuOOH),20~30h后,反应混合物经6mL乙醚萃取6~10次,萃取液经减压浓缩去溶剂,硅胶柱层析分离,即可获得4?氧代???紫罗兰酮0.1092~0.1133g(0.53~0.55mmol),产率为53%~55%。将离子液层减压蒸馏除乙醚,50?真空干燥4h,即获得第一次回收的离子液和保存在其中的催化剂,这一混合物呈咖啡色粘稠液体。在回收的离子液和催化剂中加入0.202g(1mmol)的??紫罗兰酮,60?搅拌下加入0.68mL(5mmol)的叔丁基过氧化氢(t?BuOOH),待反应结束后,再用乙醚萃取(每次萃取用5mL乙醚,剧烈搅拌下进行,萃取6~10次),乙醚层经浓缩和柱层析分离得产物,离子液层减压蒸馏除乙醚,50?真空干燥4h,即获得第二次回收
香料香精化妆品?
20xx年10月第5期
FLAVOURFRAGRANCECOSMETICS?October,2009,NO?5
的离子液和保存在其中的催化剂;如此反复进行。
2?结果与讨论2.1?4?氧代???紫罗兰酮的合成
首先,分别在乙基吡啶溴鎓盐[Epy]Br、丁基吡啶溴鎓盐[Bpy]Br和丁基吡啶氯鎓盐[Bpy]Cl离子液中,采用以往优化的反应温度(60?)和氧化剂用量(5mmol)[10],考察了不同催化剂氯化亚酮(CuCl)用量时,??紫罗兰酮(1b)烯丙位氧化合成4?氧代???紫罗兰酮(2a)反应体系的情况,结果见表1。从实验结果来看,以??紫罗兰酮(1b)为底物,氯化亚酮作催化剂,叔丁基过氧化氢作氧化剂时,在[Epy]Br、[Bpy]Br和[Bpy]Cl离子液中,反应可获得相似的转化率和产率(见表1,第1、2、8项)。当氯化亚酮用量从2%增加到20%(摩尔百分比)时,对??紫罗兰酮的转化率和4?氧代???紫罗兰酮的产率影响不大,但是对反应时间的影响较大(见表1,第2,4,6,7~11项),显然增加CuCl的用量,可缩短达到同样的底物转化水平所需要的时间。我们还注意到,分别在2%和10%(摩尔百分比)的CuCl存在下,??紫罗兰酮(1b)的烯丙位氧化进行4h,就可分别取得82%和86%的转化率,42%和45%的收率,但是要使??紫罗兰酮(1b)的转化率到96%,就分别需要30h和20h,而4?氧代???紫罗兰酮的收率可提高到54%和55%(见表1,第2,3项和5,6项)。说明这个反应前4个小时进行得较快,可以转化82%~86%的底物,而要转化余下的底物所需的时间较长,反应速率减慢。
表1?不同离子液和催化剂用量合成酮代?紫罗兰酮a
序号1234567891011??
催化剂和用量%/(摩尔百分比)
CuCl,2CuCl,2CuCl,2CuCl,5CuCl,10CuCl,10CuCl,20CuCl,2CuCl,5CuCl,10CuCl,20
离子液[Epy]Br[Bpy]Br[Bpy]Br[Bpy]Br[Bpy]Br[Bpy]Br[Bpy]Br[Bpy]Cl[Bpy]Cl[Bpy]Cl[Bpy]Cl
反应时间
/h30304274242030272420
反应物??紫罗兰酮(1b)??紫罗兰酮(1b)??紫罗兰酮(1b)??紫罗兰酮(1b)??紫罗兰酮(1b)??紫罗兰酮(1b)??紫罗兰酮(1b)??紫罗兰酮(1b)??紫罗兰酮(1b)??紫罗兰酮(1b)??紫罗兰酮(1b)
氧化主产物4?氧代???紫罗兰酮(2a)
4?氧代???紫罗兰酮(2a)4?氧代???紫罗兰酮(2a)4?氧代???紫罗兰酮4?氧代???紫罗兰酮4?氧代???紫罗兰酮4?氧代???紫罗兰酮4?氧代???紫罗兰酮4?氧代???紫罗兰酮4?氧代???紫罗兰酮4?氧代???紫罗兰酮
(2a)
(2a)(2a)(2a)(2a)(2a)(2a)(2a)
转化率/%b9696829786969796959697
产率/%c5354425545555453555453
a反应条件:??紫罗兰酮(b反应物的转化率。c
1mmol),t?BuOOH(5mmol),离子液([Epy]Br或[Bpy]Br或[Bpy]Cl)(1g),60?,
氧化主产物的分离产率。
2.2?反应介质和催化剂的回收再利用
接下来考察了催化体系CuCl?[Bpy]Br进行烯丙位氧化,合成烯酮反应的回收和重复使用性。因为使用离子液作反应介质具有两大优点,一是其本!
14!
www.ffc?journal.com
身作为反应介质的可回收性,更重要的是离子液对各种金属催化剂具有很好的保存性能,即反应完毕后,经蒸馏、溶剂萃取或过滤等简单操作,分离除去产物和未反应完毕的反应物或其它杂质后,含有催
香料香精化妆品?
20xx年10月第5期
FLAVOURFRAGRANCECOSMETICS?October,2009,NO?5
研究报告
氢(t?BuOOH),催化氧化烯烃一步合成烯酮的有关
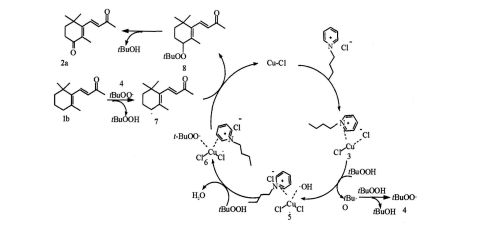
文献报道[11],推测CuCl?[Epy]Br/Cl或[Bpy]Br/Cl催化合成4?氧化???紫罗兰酮的机理如图4:
表2?离子液和催化剂的重复利用a
反应次数反应时间/h产率/%b??
a反应条件:
化剂的离子液可重复使用。以??紫罗兰酮为底物进行了3次回收利用实验,如表2所示,除了在第一次的反应中加入催化剂和离子液外,在随后的3次反应进行时,都只需在前次反应完毕、经乙醚提取、真空干燥后回收的离子液中,加入反应物??紫罗兰酮和氧化剂叔丁基过氧化氢即可;实验结果表明:催化体系CuCl?[Bpy]Br在??紫罗兰酮烯丙位氧化合成4?氧代???紫罗兰酮的反应中,至少可回收并重复使用3次,其催化活性没有明显的下降。2.3?催化机理讨论
参考过渡金属结合终端氧化剂叔丁基过氧化
12755
22753
32950
43045
1g离子液[Bpy]Br和5%CuCl用于第一次反应,
1mmol??紫罗兰酮和5mmolTBHP用于每次反应中,反应在60?下搅拌进行。
b产率是
4?氧代???紫罗兰酮的分离产率。
图4?催化机理示意图
??首先,氯化亚铜与吡啶溴或氯鎓离子液中的吡
啶环中的 电子配位,形成配合物3,此配合物可催化氧化剂叔丁基过氧化氢(t?BuOOH)的均裂,形成氢氧自由基(?OH)和叔丁氧自由基(t?BuO?),接下来,叔丁氧自由基(t?BuO?)与氧化剂叔丁基过氧化氢(t?BuOOH)作用,形成叔丁醇和叔丁基过氧自由基(t?BuOO?)4,同时配合物3与氢氧自由基(?OH)配位形成图中配合物5,配合物5携带的氢氧自由基(?OH)与氧化剂叔丁基过氧化氢(t?BuOOH)作用,生成叔丁基过氧自由基(t?BuOO?)、水(H2O)和配合物6。这时体系中形成了一定浓度的叔丁基过氧自由基(t?BuOO?)4,它将摄取底物??紫罗兰酮烯丙位的H?形成相应的烯丙位自由基7和t?BuOOH,与此同时,配合物6携带的叔丁基过氧自由基t?BuOO?与烯丙位自由基7作用,生成相应的烯丙位叔丁基过氧醚8,这种中间体不稳定,会分解形成叔丁醇和目标物烯酮,同时配合物6释放出催化剂氯化亚铜,至此,完成了一个催化氧化循环。
2.4?产品结构鉴定
由于合成的物质为已知化合物,我们对其进行
1
了GC?MS鉴定和HNMR表征,其数据与文献[7,8,9]值一致。
1
化合物2a:mp52~53?;HNMR(400MHz,CDCl3):!=7.25(d,J=16.4Hz,1H),6.19(d,J=16.4Hz,1H),2.54(t,J=6.8Hz,2H),2.36(s,3H),1.90(t,J=6.8Hz,2H),1.80(broads,3H),1.20(s,6H).GC?MS(relativeintensity):m/z=206(M+,48),191(13),177(7),163(100),149(33),135(34),121(52),107(28),93(30),81(24),69(26),55(40),43(90)。
参考文献
[1]?RosenbergerM,McDougalP,BahrJetal.Canthaxanthin:
ANewTotalSynthesis[J].J.Org.Chem.1982,47(11):2130?2134.
[2]?BecherE,AlbrechtR,BernhardK,etal.Synthesevon
Astaxanthinaus?Jonon.I.ErschliessungderenantiomerenC15?WittigsalzedurchchemischeundmikrobiologischeRace?matspaltungvon(%)?3?Acetoxy?4?oxo??jonon[J].Helv.
www.ffc?journal.com!15!
研究报告
Chim.Acta.,1981,64(7):2419?2435.
[3]?皮士卿,陈新志,胡四平,等.虾青素的合成[J].有机化学,
2007,27(9):1126?1128.
[4]?李忠,王颖明,莫宝庆,等.类胡萝卜素和维甲酸对不同雌激素
状态乳腺癌细胞增殖的影响[J].南京医科大学学报(自然科学版),2001,21(6):506?508.
[5]?李忠,王颖明,莫宝庆.类胡萝卜素对人乳腺癌细胞增殖及
bcl?2基因表达的影响[J].中华预防医学杂志,2002,36(4):254?257.
[6]?彭光华,李忠,张声华.6种类胡萝卜素对人乳腺癌细胞株细
胞间隙连接通讯功能影响的比较[J].食品科学,2008,29(6):45?48.
[7]?AasenAJ,KimlandB,EnzellCR.TobaccoChemistry18.
AbsoluteConfigurationof(9R)?9?Hydroxy?4,7E?megastima?dien?3?one(3?Oxo?a?ionol)[J].Acta.Chem.Scand.,1973,27:2107?2114.
[8]?DavisDL,StevensKL,JurdL.Chemistryoftobaccocon?
stituents.Oxidationofalpha.?iononeandtheacid?catalyzedrearrangementof5?keto?.alpha.?ionone[J].J.Agric.FoodChem.,1976,24(1):187?189
[9]?HagenJ,PaustJH.IntroductionofaCarbonylGroupIntoa
CyclohexeneRing:US,4209450[P].1980?06?24.
香料香精化妆品?
20xx年10月第5期
FLAVOURFRAGRANCECOSMETICS?October,2009,NO?5
[10]?YangM,PengQR,LanJB,etal.CaCl2?orMgCl2?cata?
lyzedallylicoxidationsofionone?likedienes[J].Synlett,2006,16:2617?2620.
[11]?PengQR,YangM,XieRG,etal.Onestepmethodfor
synthesisofketo??ionone,keto??iononeandtheirether,es?terderivatives:CN,1817842[P].2006?08?16.
[12]?SheldonR.Catalyticreactionsinionicliquids[J].Chem.
Commun.,2001,27:2399?2407.
[13]?TongKH,WongKY,ChanTH.Manganese/Bicarbonate?
CatalyzedEpoxidationofLipophilicAlkeneswithHydrogenPeroxideinIonicLiquids[J].Org.Lett.,2003,5:3423?3425.
[14]?LawMC,WongKY,ChanTH.FormationandReactions
ofAlkylzincReagentsinRoom?TemperatureIonicLiquids[J].J.Org.Chem.,2005,70(25):10434?10439.
[15]?ZhaoD,FeiZ,GeldbachTJ,etal.Nitrile?Functionalized
PyridiniumIonicLiquids:Synthesis,Characterization,andTheirApplicationinCarbon?CarbonCouplingReactions[J].J.Am.Chem.Soc.,2004,126(48):15876?15882.
[16]?CatinoAJ,ForslundRE,DoyleMP.Dirhodium(II)Cap?
rolactamate:AnExceptionalCatalystforAllylicOxidation[J].J.Am.Chem.Soc,2004,126:13622?13623.
(上接第25页)
正交实验的结果表明,影响多重乳液对维生素C的包裹率的因素主次为:第一相中Span80的质量分数>第一相的质量分数>Tween80的质量分数>第一相中石蜡油的质量分数。结果直观分析表明包裹维生素C的最佳配方为:第一相中石蜡油质量分数50%,第一相中Span80质量分数8%,第一相质量分数65%,Tween80质量分数1.5%。在该配方下包裹维生素C,得到其包裹率为0.9855。2.3.1?多重乳液包裹维生素C的稳定性
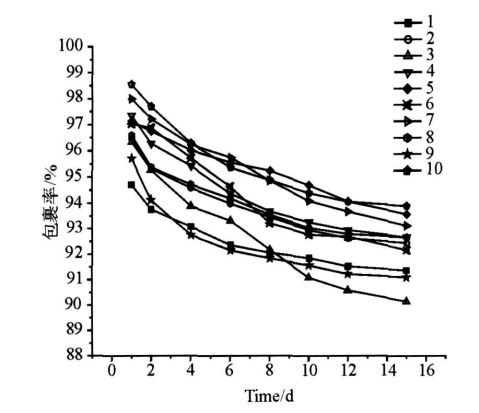
取不同时间点样品,测定其对维生素包裹率的变化如图6
所示。
??图6中曲线1~9为正交实验中各组样品对维生素C的包裹率随时间的变化曲线,曲线10为在最佳包裹工艺下的样品对维生素C的包裹率变化曲线。结果可知,多重乳液对维生素C具有长效缓释作用,且在包裹维生素C的最佳配方下,其缓释作用最明显。
参考文献
[1]?裘炳毅.乳化作用及其在化妆品工业的应用[J].日用化学工
业,1996,(6):50?56.
[2]?杜亚威,杨文玲,刘红梅.维生素C磷酸酯衍生物的制备及其
在化妆品中的应用[J].香料香精化妆品,2007,(1):6?9.[3]?李冰冰,梁文平.多乳状液!!!一种新型化妆品体系[J].日
用化学工业,2000,(1):25?28.
[4]?C.Laugel,P.Chaminade,A.Baillet.Moisturizingsubstances
entrappedinW/O/Wemulsions:analyticalmethodologyforformulation,stabilityandreleasestudies[J].JournalofCon?trolledRelease,1996,38:59?67.
[5]?李光水,邵国泉,雍国平,等.提高W/O/W多重乳状液的稳
定性研究[J].食品科学,2002,23(1):51?53.
[6]?刘华杰,柳松.白油W/O/W型多重乳状液的稳定性研究
[J].日用化学工业,2007,37(2):88?91.
[7]?MohammedLeadiCole,TonyL.Whateley.Releaseratepro?
filesoftheophyllineandinsulinfromstablemultiplew/o/we?mulsions[J].JournalofControlledRelease,1997,49:51?58.[8]?王少敏.紫外分光光度法测定维生素C片中维生素C含量
[J].TianjinPharmacy,2007,19(5):21?22.
图6?多重乳液对维生素C的包裹率变化!
16!
www.ffc?journal.com
