一、元素周期表
★熟记等式:原子序数=核电荷数=质子数=核外电子数
1、元素周期表的编排原则:
①按照原子序数递增的顺序从左到右排列;
②将电子层数相同的元素排成一个横行——周期;
③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行——族
2、如何精确表示元素在周期表中的位置:
周期序数=电子层数;主族序数=最外层电子数
口诀:三短三长一不全;七主七副零八族
熟记:三个短周期,第一和第七主族和零族的元素符号和名称
3、元素金属性和非金属性判断依据:
①元素金属性强弱的判断依据:
单质跟水或酸起反应置换出氢的难易;
元素最高价氧化物的水化物——氢氧化物的碱性强弱; 置换反应。
②元素非金属性强弱的判断依据:
单质与氢气生成气态氢化物的难易及气态氢化物的稳定性;
最高价氧化物对应的水化物的酸性强弱; 置换反应。
4、核素:具有一定数目的质子和一定数目的中子的一种原子。
①质量数==质子数+中子数:A == Z + N
②同位素:质子数相同而中子数不同的同一元素的不同原子,互称同位素。(同一元素的各种同位素物理性质不同,化学性质相同)
二、 元素周期律
1、影响原子半径大小的因素:①电子层数:电子层数越多,原子半径越大(最主要因素) ②核电荷数:核电荷数增多,吸引力增大,使原子半径有减小的趋向(次要因素) ③核外电子数:电子数增多,增加了相互排斥,使原子半径有增大的倾向
2、元素的化合价与最外层电子数的关系:最高正价等于最外层电子数(氟氧元素无正价) 负化合价数 = 8—最外层电子数(金属元素无负化合价)
3、同主族、同周期元素的结构、性质递变规律:
同主族:从上到下,随电子层数的递增,原子半径增大,核对外层电子吸引能力减弱,失电子能力增强,还原性(金属性)逐渐增强,其离子的氧化性减弱。
同周期:左→右,核电荷数——→逐渐增多,最外层电子数——→逐渐增多
原子半径——→逐渐减小,得电子能力——→逐渐增强,失电子能力——→逐渐减弱
氧化性——→逐渐增强,还原性——→逐渐减弱,气态氢化物稳定性——→逐渐增强
最高价氧化物对应水化物酸性——→逐渐增强,碱性 ——→ 逐渐减弱
三、 化学键
含有离子键的化合物就是离子化合物;只含有共价键的化合物才是共价化合物。
用电子式表示出下列物质:
CO2、N2、H2S、CH4、Ca(OH)2、Na2O2 、H2O2等 如: NaOH中含极性共价键与离子键,NH4Cl中含极性共价键与离子键,Na2O2中含非极性共价键与
离子键,H2O2中含极性和非极性共价键
一、化学能与热能
1、在任何的化学反应中总伴有能量的变化。
原因:当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。化学键的断裂和形成是化学反应中能量变化的主要原因。一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。E反应物总能量>E生成物总能量,为放热反应。E反应物总能量<E生成物总能量,为吸热反应。
2、常见的放热反应和吸热反应
常见的放热反应:①所有的燃烧与缓慢氧化。②酸碱中和反应。③金属与酸、水反应制氢气。 ④大多数化合反应(特殊:C+CO2 2CO是吸热反应)。
常见的吸热反应:①以C、H2、CO为还原剂的氧化还原反应如:C(s)+H2O(g) CO(g)+H2(g)。
②铵盐和碱的反应如Ba(OH)2?8H2O+NH4Cl=BaCl2+2NH3↑+10H2O
③大多数分解反应如KClO3、KMnO4、CaCO3的分解等。
[练习]1、下列反应中,即属于氧化还原反应同时又是吸热反应的是( B )
A.Ba(OH)2.8H2O与NH4Cl反应 B.灼热的炭与CO2反应
C.铝与稀盐酸 D.H2与O2的燃烧反应
2、已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( C )
A. X的能量一定高于M B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因该反应为放热反应,故不必加热就可发生
二、化学能与电能
1、化学能转化为电能的方式:
电能
(电力) 火电(火力发电) 化学能→热能→机械能→电能 缺点:环境污染、低效 原电池 将化学能直接转化为电能 优点:清洁、高效
2、原电池原理(1)概念:把化学能直接转化为电能的装置叫做原电池。
(2)原电池的工作原理:通过氧化还原反应(有电子的转移)把化学能转变为电能。
(3)构成原电池的条件:(1)有活泼性不同的两个电极;(2)电解质溶液(3)闭合回路
(4)自发的氧化还原反应
(4)电极名称及发生的反应:
负极:较活泼的金属作负极,负极发生氧化反应,
电极反应式:较活泼金属-ne-=金属阳离子
负极现象:负极溶解,负极质量减少。
正极:较不活泼的金属或石墨作正极,正极发生还原反应,
电极反应式:溶液中阳离子+ne-=单质
正极的现象:一般有气体放出或正极质量增加。
(5)原电池正负极的判断方法:
①依据原电池两极的材料:
较活泼的金属作负极(K、Ca、Na太活泼,不能作电极);
较不活泼金属或可导电非金属(石墨)、氧化物(MnO2)等作正极。
②根据电流方向或电子流向:(外电路)的电流由正极流向负极;电子则由负极经外电路流向原电池的正极。
③根据内电路离子的迁移方向:阳离子流向原电池正极,阴离子流向原电池负极。 ④根据原电池中的反应类型:
负极:失电子,发生氧化反应,现象通常是电极本身消耗,质量减小。
正极:得电子,发生还原反应,现象是常伴随金属的析出或H2的放出。
(6)原电池电极反应的书写方法:
(i)原电池反应所依托的化学反应原理是氧化还原反应,负极反应是氧化反应,正极反应是还原反应。因此书写电极反应的方法归纳如下:
①写出总反应方程式。 ②把总反应根据电子得失情况,分成氧化反应、还原反应。
③氧化反应在负极发生,还原反应在正极发生,反应物和生成物对号入座,注意酸碱介质和水等参与反应。
(ii)原电池的总反应式一般把正极和负极反应式相加而得。
(7)原电池的应用:①加快化学反应速率,如粗锌制氢气速率比纯锌制氢气快。②比较金属活动性强弱。③设计原电池。④金属的防腐。
三、化学反应的速率和限度
1、化学反应的速率
(1)概念:化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。
计算公式:v(B)= =
①单位:mol/(L?s)或mol/(L?min)
②B为溶液或气体,若B为固体或纯液体不计算速率。
③重要规律:速率比=方程式系数比
(2)影响化学反应速率的因素:
内因:由参加反应的物质的结构和性质决定的(主要因素)。
外因:①温度:升高温度,增大速率
②催化剂:一般加快反应速率(正催化剂)
③浓度:增加C反应物的浓度,增大速率(溶液或气体才有浓度可言)
④压强:增大压强,增大速率(适用于有气体参加的反应)
⑤其它因素:如光(射线)、固体的表面积(颗粒大小)、反应物的状态(溶剂)、原电池等也会改变化学反应速率。
2、化学反应的限度——化学平衡
(1)化学平衡状态的特征:逆、动、等、定、变。
①逆:化学平衡研究的对象是可逆反应。
②动:动态平衡,达到平衡状态时,正逆反应仍在不断进行。
③等:达到平衡状态时,正方应速率和逆反应速率相等,但不等于0。即v正=v逆≠0。 ④定:达到平衡状态时,各组分的浓度保持不变,各组成成分的含量保持一定。 ⑤变:当条件变化时,原平衡被破坏,在新的条件下会重新建立新的平衡。
(3)判断化学平衡状态的标志:
① VA(正方向)=VA(逆方向)或nA(消耗)=nA(生成)(不同方向同一物质比较)
②各组分浓度保持不变或百分含量不变
③借助颜色不变判断(有一种物质是有颜色的)
④总物质的量或总体积或总压强或平均相对分子质量不变(前提:反应前后气体的总物质的量不相等的反应适用,即如对于反应xA+yB zC,x+y≠z )
[练习]1、用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是( A )
A.不用稀硫酸,改用98%浓硫酸 B.加热
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
2、下列四种X溶液,均能跟盐酸反应,其中反应最快的是( C )
A.10℃ 20 mL 3mol/L的X溶液 B.20℃ 30 mL 2molL的X溶液
C.20℃ 10 mL 4mol/L的X溶液 D.10℃ 10 mL 2mol/L的X溶液
3、对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子( D )
A.只存在于O2中 B.只存在于O2和SO3中
C. 只存在于O2和SO2中 D. 存在于O2、SO2和SO3中
4、对化学反应限度的叙述,错误的是( D )
A.任何可逆反应都有一定的限度 B.化学反应达到限度时,正逆反应速率相等
C.化学反应的限度与时间的长短无关 D.化学反应的限度是不可改变的
5、在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是( A )
A.C生成的速率与C分解的速率相等 B. A、B、C的浓度相等
C. A、B、C的分子数比为1:3:2 D.单位时间生成n mol A,同时生成3n mol B
第二篇:高一化学《必修一》化学方程式(按章节归纳)
高一化学《必修一》方程式(按章节归纳)
第一、二章:
1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl
2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
3、银离子的检验: Cl - + Ag + = AgCl ↓
4、木炭还原氧化铜: 2CuO + C  2Cu + CO2↑
2Cu + CO2↑
5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu
6. 镁在二氧化碳中燃烧 : 2Mg + CO2 2MgO + C
2MgO + C
第三章:
一、钠
1、钠在空气中燃烧(黄色的火焰):2Na + O2 Na2O2
Na2O2
2、 钠块在空气中变暗 :4Na+O2=2Na2O
3、Na2O在空气中加热(变黄):2Na2O+O2 2Na2O2
2Na2O2
4、金属锂在空气中燃烧 :4Li + O2 2Li2O
2Li2O
5、钠与水反应(浮、熔、游、响、红)
2Na + 2H2O = 2NaOH+ H2 ↑
2Na + 2H2O = 2Na+ + 2OH - + H2 ↑
二、Na2O 、Na2O2的相关反应:
1、碱性氧化物Na2O与水的反应 :Na2O+H2O=2NaOH
2、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,可用于漂白)
2Na2O2 + 2H2O = 4NaOH + O2 ↑
2Na2O2 + 2H2O = 4Na++4OH -+O2↑
3、碱性氧化物Na2O与CO2的反应Na2O + CO2 = Na2CO3
4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是: 2Na2O2 + 2CO2 = 2Na2CO3 + O2
5、 Na2O + SO2 = Na2SO3 Na2O2 + SO2 = Na2SO4
6、Na2O +2HCl = 2NaCl + H2O
7、2Na2O2 +4 HCl = 4 NaCl + 2 H2O + O2 ↑
三、NaHCO3与Na2CO3
1、小苏打受热分解: 2NaHCO3 Na2CO3 + H2O +CO2 ↑
Na2CO3 + H2O +CO2 ↑
2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热
NaHCO3 + NaOH  Na2CO3 + H2O
Na2CO3 + H2O
3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:
NaHCO3 + NaOH = Na2CO3 + H2O HCO3-+ OH - = H2O + CO32-
4、向NaOH溶液中通入少量CO2 :2NaOH + CO2 = Na2CO3 + H2O
5、继续通入过量CO2 :Na2CO3 + CO2 + H2O = 2 NaHCO3
总反应方程式:NaOH + CO2 = NaHCO3
6、苏打(纯碱)与盐酸反应:
①盐酸中滴加纯碱溶液
Na2CO3 + 2HCl = 2NaCl + H2O +CO2↑ CO32- + 2H+ = H2O + CO2↑
②纯碱溶液中滴加盐酸,至过量
Na2CO3 + HCl =NaHCO3 + NaCl CO32- + H+ = HCO3-
NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+= H2O +CO2↑
7、(1)Na2CO3溶液、NaHCO3溶液与Ca(OH)2反应:
Na2CO3 +Ca(OH)2 = CaCO3↓+2 NaOH
NaHCO3 +Ca(OH)2(多)= CaCO3↓+ NaOH +H2O
2NaHCO3 +Ca(OH)2(少)= CaCO3↓+ Na2CO3 +2H2O
8、 Na2CO3溶液、NaHCO3溶液与CaCl2反应:
Na2CO3 +CaCl2 = CaCO3↓+2 Na Cl
NaHCO3溶液与CaCl2 不反应;

四、铝
1、铝与氯气反应:2Al + 3Cl2 2AlCl3
2AlCl3
2、铝片与稀盐酸反应
2Al + 6HCl = 2AlCl3 + 3H2↑ 2Al + 6H+ = 2Al3+ +3H2↑
3、铝与氢氧化钠溶液反应
2Al+2NaOH +2H2O = 2NaAlO2 +3H2↑
2Al + 2OH - +2H2O = 2AlO2- + 3H2↑
4、4Al + 3O2 2Al2O3 电解熔融的氧化铝:2Al2O3
2Al2O3 电解熔融的氧化铝:2Al2O3  4Al + 3O2↑
4Al + 3O2↑
5、铝与三氧化二铁高温下反应【铝热反应】:2Al + Fe2O3 2Fe + Al2O3
2Fe + Al2O3
6、不稳定性:2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
7、硫酸铝溶液中滴过量氨水【实验室制备Al(OH)3】
Al2(SO4)3 +6NH3·H2O=2Al(OH)3↓+(NH4)2SO4
Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+
8、向NaAlO2 溶液中通入CO2
2NaAlO2 +CO2 +3H2O = 2Al(OH)3↓+ Na2CO3
2AlO2-+CO2 +3H2O = 2Al(OH)3↓+ CO32-
9、氧化铝溶于氢氧化钠溶液
Al2O3 + 2NaOH  2NaAlO2 +H2O Al2O3 + 2OH - = 2AlO2- + H2O
2NaAlO2 +H2O Al2O3 + 2OH - = 2AlO2- + H2O
10、氧化铝溶于盐酸:
Al2O3 + 6HCl = 2AlCl3 + 3 H2O Al2O3 + 6H+ = 2Al3+ +3 H2O
11、Al(OH)3溶液中加盐酸:
Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O
12、Al(OH)3与NaOH溶液反应:
Al(OH)3 + NaOH  NaAlO2 +2 H2O Al(OH)3 + OH- = AlO2- +2 H2O
NaAlO2 +2 H2O Al(OH)3 + OH- = AlO2- +2 H2O
13、铝盐、偏铝酸盐反应生成Al(OH)3 3AlO2- +Al3+ + 6H2O = 4 Al(OH)3↓
五、铁
1、铁与硫加热反应 Fe + S  FeS
FeS
2、铁与氧气加热反应 3Fe+2O2 Fe3O4
Fe3O4
3. 铁在氯气中加热反应 2Fe+3Cl2 2FeCl3
2FeCl3
4、高温下铁与水蒸气反应 : 3Fe + 4H2O(g) Fe3O4 + 4H2
Fe3O4 + 4H2
5、铁与盐酸反应:
Fe + 2HCl = FeCl2 + H2↑ Fe + 2H+ = Fe2+ + H2↑
6.铁的氧化物FeO 、Fe2O3 、Fe3O4溶于盐酸中:
1)FeO + 2HCl = FeCl2 + H2O FeO + 2H+ = Fe2+ + H2O
2)Fe2O3 + 6HCl = 2FeCl3 + 3H2O Fe2O3 + 6H+ = 2Fe3+ + 3H2O
3) Fe3O4 + 8HCl = FeCl2 +2FeCl3 +4H2O Fe3O4 + 8H+ =Fe2+ +2Fe3+ +4 H2O
7.Fe(OH)2、Fe(OH)3 的制备:
1) FeSO4 + 2NaOH = Fe(OH)2 ↓+Na2SO4 Fe2+ + 2OH - = Fe(OH)2 ↓
氯化铁中滴入氢氧化钠溶液(红褐色沉淀)
2)FeCl3 + 3NaOH = Fe(OH)3 ↓+3NaCl Fe3+ + 3OH - = Fe(OH)3 ↓
氢氧化亚铁在空气中被氧化(白色絮状沉淀迅速变成灰绿色,最后变为红褐色沉淀)
3)4Fe (OH)2 + O2 + 2H2O = 4Fe (OH)3
4)不稳定性:2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
8.Fe2+ 、Fe3+ 之间的转化:
1)氯化亚铁溶液中通入氯气(或者加氯水)
2FeCl2 + Cl2 = 2FeCl3 2 Fe2+ + Cl2 = 2 Fe3+ + 2Cl-
2)氯化铁溶液中加入铁粉:
2FeCl3 + Fe = 3FeCl2 2Fe3+ + Fe = 3Fe2+
3)用KSCN检验Fe3+的存在:离子方程式:Fe3++3SCN-= Fe (SCN)3 (血红色)
4)印刷电路板:2FeCl3 + Cu = 2FeCl2 +CuCl2
第四章:
一、硅
(1)工业制单质硅(碳在高温下还原二氧化硅):
SiO2 + 2C  Si + 2CO↑(硅单质的实验室制法,粗硅的制取)
Si + 2CO↑(硅单质的实验室制法,粗硅的制取)
(2)硅单质与氢氟酸、Si +4HF = SiF4 ↑+ 2H2↑
(3)硅单质与NaOH溶液反应:
Si + 2NaOH + H2O = Na2SiO3 +2H2↑
Si及其化合物:
二、二氧化硅
(1)二氧化硅与氢氧化钠反应
SiO2 + 2NaOH = Na2SiO3 + H2O SiO2 + 2OH - = SiO32- + H2O
(2)二氧化硅与氧化钙高温反应:SiO2 + CaO 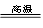 CaSiO3
CaSiO3
(3)二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4↑+ 2 H2O
三、硅酸(H2SiO3)
(1)往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓
(2)硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3(胶体)
(3)硅酸受热分解:H2SiO3  SiO2 + H2O
SiO2 + H2O
(4)工业制玻璃原理:SiO2 + Na2CO3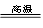 Na2SiO3 + CO2↑
Na2SiO3 + CO2↑
SiO2 + Ca CO3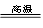 Ca SiO3 + CO2↑
Ca SiO3 + CO2↑
四、氯气
(1)氯气实验室制法:(仪器:分液漏斗,圆底烧瓶)
MnO2 +4HCl(浓)  MnCl2+Cl2↑+2H2O MnO2 +4H++2Cl-
MnCl2+Cl2↑+2H2O MnO2 +4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
2、氯气性质:
A、金属和氯气的反应:
(1)铜丝在氯气中剧烈燃烧(棕色烟):Cu + Cl2  CuCl2
CuCl2
之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)
(2)氯气和金属钠反应:2Na + Cl2  2NaCl
2NaCl
(3)铁在氯气中剧烈燃烧 :2Fe + 3Cl2 3FeCl3
3FeCl3
(4)氢气在氯气中燃烧(苍白色火焰):H2 + Cl2 2HCl
2HCl
(5)氟气与氢气反应(黑暗处即可爆炸):H2+F2=2HF
B、氯气与水反应
(6)氯气溶于水(新制氯水中含H+ 、Cl -、ClO -、OH-、Cl2、HClO、H2O)
Cl2 + H2O = HCl + HClO Cl2 + H2O = H+ + Cl - + HClO
新制氯水注入盛溴化钠溶液的试管中
(7)Cl2 + 2NaBr = Br2 + 2NaCl Cl2 + 2Br- = Br2 + 2Cl-
(8)Cl2 + 2NaI = 2NaCl + I2 Cl2 +2I- =I2 + 2Cl-
 (9)次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):2HClO 2HCl + O2↑
(9)次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):2HClO 2HCl + O2↑
C、氯气和碱和的反应:
(10)工业制漂白粉的原理:
2Ca(OH)2 + 2Cl2 =Ca(ClO)2 + CaCl2 + 2H2O
2Ca(OH)2 +2Cl2 =2Ca2++2ClO-+2Cl -+2H2O
 (11)漂白粉长期置露在空气中失效的原理:
(11)漂白粉长期置露在空气中失效的原理:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 2HClO HCl + O2↑
Ca2++2ClO- + CO2 + H2O =CaCO3↓+ 2HClO
(12)制漂白液(或氯气尾气处理): Cl2 +2NaOH = NaCl + NaClO + H2O
五、硫和氮的化合物:
(1)硫与非金属:S + O2  SO2 H2+ S
SO2 H2+ S  H2S
H2S
(2)硫与金属: Fe + S  FeS 2Cu + S
FeS 2Cu + S  Cu2S
Cu2S
 (3)二氧化硫与水反应:SO2 + H2O H2SO3
(3)二氧化硫与水反应:SO2 + H2O H2SO3
(4)二氧化硫与碱性氧化物反应:SO2 + CaO = CaSO3
(5)二氧化硫与碱反应:SO2 + 2NaOH = Na2SO3 + H2O SO2 + Ca(OH)2 = CaSO3↓ + H2O
(6)二氧化硫与硫化氢气体反应:2H2S +SO2 = 3S↓ + 2H2O
 (7)二氧化硫通入氯水中:SO2 + Cl2 + 2H2O = 2HCl + H2SO4(Cl2可换作Br2、I2) (8)二氧化硫被O2氧化:2SO2 + O2
(7)二氧化硫通入氯水中:SO2 + Cl2 + 2H2O = 2HCl + H2SO4(Cl2可换作Br2、I2) (8)二氧化硫被O2氧化:2SO2 + O2
 2SO3
2SO3
(9)三氧化硫与水反应:SO3 + H2O = H2SO4
(10)三氧化硫与碱反应:SO3 + Ca(OH)2 = CaSO4↓ + H2O
(12)工业合成氨:N2 + 3H2 2NH3
2NH3
(13)氨的催化氧化 :4NH3 +5O2 4NO + 6H2O
4NO + 6H2O

 (14)NH3在水中的反应:NH3 + H2O NH3? H2O NH4+ + OH-
(14)NH3在水中的反应:NH3 + H2O NH3? H2O NH4+ + OH-
(15)氨水受热分解:NH3?H2O  NH3↑ + H2O
NH3↑ + H2O
(16)实验室制取氨气:2NH4Cl + Ca(OH)2  CaCl2 + 2NH3↑+ 2H2O
CaCl2 + 2NH3↑+ 2H2O
(17)碳酸氢铵受热分解 :NH4HCO3 NH3 ↑+ H2O↑ + CO2↑
NH3 ↑+ H2O↑ + CO2↑
(18)用浓盐酸检验氨气(白烟生成): HCl + NH3 = NH4Cl
(19)氯化铵受热分解:NH4Cl  NH3↑ + HCl↑
NH3↑ + HCl↑
(20)硫酸铵溶液与氢氧化钠溶液混合加
(NH4)2SO4 +2NaOH 2NH3↑+Na2SO4 +2H2O NH4+ + OH -
2NH3↑+Na2SO4 +2H2O NH4+ + OH - NH3 ↑+ H2O
NH3 ↑+ H2O
(21)硝酸铵溶液与氢氧化钠溶液混合(不加热)(检验NH4+的方法)
NH4NO3 + NaOH = NH3↑+H2O + NaNO3 NH4+ + OH- = NH3↑+H2O
 (22)氮气和氧气放电下反应(雷雨发庄稼)
(22)氮气和氧气放电下反应(雷雨发庄稼)
N2 + O2 2NO 2NO + O2 2NO2
2NO2
(23)二氧化氮溶于水 :3NO2 + H2O  2HNO3 + NO
2HNO3 + NO
3NO2 + H2O  2H++ 2NO3-+NO
2H++ 2NO3-+NO
(24)NO2 、O2 的混合气通入水中无剩余气体 : 4NO2 + O2 + 2H2O = 4 HNO3
(25)NO 、O2 的混合气通入水中无剩余气体 : 4NO+ 3O2 + 2H2O = 4 HNO3
(26)NO、NO2的回收:NO2 + NO + 2NaOH = 2Na NO2+ H2O
5、浓硫酸、HNO3与Cu反应:
Al、Fe遇浓HNO3、浓硫酸钝化(常温)
(27)Cu与浓HNO3加热 :Cu+4HNO3 (浓)= Cu(NO3)2 +2NO2↑+ 2H2O
(28)Cu与稀HNO3反应 :3Cu+8HNO3 (稀)= 3Cu(NO3)2 +2NO↑+ 4H2O
(29)铜与浓硫酸反应:Cu+2H2SO4 (浓) CuSO4 +2H2O+SO2 ↑
CuSO4 +2H2O+SO2 ↑
(30)浓硫酸与木炭反应:C+2H2SO4(浓) 2H2O+CO2↑+2SO2↑
2H2O+CO2↑+2SO2↑
(31)浓硝酸与木炭反应:C+4HNO3(浓) 2H2O+CO2↑+4NO2↑
2H2O+CO2↑+4NO2↑
