有机化学知识总结
一、知识归纳:
1、 常温常压下为气态的有机物: 1~4个碳原子的烃,一氯甲烷、新戊烷、甲醛。
2、 碳原子较少的醛、醇、羧酸(如甘油、乙醇、乙醛、乙酸)易溶于水;液态烃(如苯、汽油)、卤代烃(溴苯)、硝基化合物(硝基苯)、酯(乙酸乙酯)都难溶于水;苯酚在常温微溶于水,但高于65℃时,与水以任意比互溶。
3、 所有烃、酯、一氯烷烃的密度都小于水;溴苯、溴代烷烃、卤代烃、硝基化合物的密度一般都大于水。
4、 能使溴水反应褪色的有机物有:烯烃、炔烃、苯酚、醛、含不饱和碳碳键(碳碳双键、碳碳叁键)的有机物。能使溴水萃取褪色的有:苯、苯的同系物(甲苯)、CCl4、氯仿、液态烷烃等。
5、 能使酸性高锰酸钾溶液褪色的有机物:烯烃、炔烃、苯的同系物、醇类、醛类、含不饱和碳碳键的有机物、酚类(苯酚)。
6、 碳原子个数相同时互为同分异构体的不同类物质:烯烃和环烷烃、炔烃和二烯烃、饱和一元醇和醚、饱和一元醛和酮、饱和一元羧酸和酯、芳香醇和酚、硝基化合物和氨基酸。
7、 无同分异构体的有机物是:烷烃:CH4、C2H6、C3H8;烯烃:C2H4;炔烃:C2H2;氯代烃:CH3Cl、CH2Cl2、CHCl3、CCl4、C2H5Cl;醇:CH4O;醛:CH2O、C2H4O;酸:CH2O2。
8、 属于取代反应范畴的有:卤代、硝化、酯化、水解、分子间脱水(如:乙醇分子间脱水)等。
9、 能与氢气发生加成反应的物质:烯烃、炔烃、苯及其同系物、醛、酮、不饱和羧酸(CH2=CHCOOH)及其酯(CH3CH=CHCOOCH3)、油酸甘油酯等。
10、能发生水解的物质:卤代烃(CH3CH2Br)、羧酸盐(CH3COONa)、酯类(CH3COOCH2CH3)、二糖(C12H22O11)(蔗糖、麦芽糖)、多糖(淀粉、纤维素)、蛋白质(酶)、油脂(硬脂酸甘油酯、油酸甘油酯)等。
11、能与活泼金属反应置换出氢气的物质:醇、酚、羧酸。
12、能发生缩聚反应:苯酚(C6H5OH)与醛(RCHO)、二元羧酸(COOH—COOH)与二元醇(HOCH2CH2OH)、二元羧酸与二元胺(H2NCH2CH2NH2)、羟基酸(HOCH2COOH)、氨基酸(NH2CH2COOH)等。
13、需要水浴加热的实验:制硝基苯( —NO2,60℃)、制酚醛树脂(沸水浴)、银镜反应、醛与新制的Cu(OH)2悬浊液反应、酯的水解、二糖水解(如蔗糖水解)、淀粉水解(沸水浴)。
—NO2,60℃)、制酚醛树脂(沸水浴)、银镜反应、醛与新制的Cu(OH)2悬浊液反应、酯的水解、二糖水解(如蔗糖水解)、淀粉水解(沸水浴)。
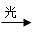 14、光照条件下能发生反应的:烷烃与卤素的取代反应、苯环的侧链上烷烃基与卤素。
14、光照条件下能发生反应的:烷烃与卤素的取代反应、苯环的侧链上烷烃基与卤素。
 —CH3+Cl2
—CH3+Cl2  —CH2Cl(注意在FeBr3催化作用下取代到苯环上)。
—CH2Cl(注意在FeBr3催化作用下取代到苯环上)。
15、常用有机鉴别试剂:新制Cu(OH)2悬浊液、溴水、酸性高锰酸钾溶液、银氨溶液、FeCl3溶液。
16、最简式为CH的有机物:乙炔、苯、苯乙烯( —CH=CH2);最简式为CH2O的有机物:甲醛、乙酸(CH3COOH)、甲酸甲酯(HCOOCH3)、葡萄糖(C6H12O6)、果糖(C6H12O6)。
—CH=CH2);最简式为CH2O的有机物:甲醛、乙酸(CH3COOH)、甲酸甲酯(HCOOCH3)、葡萄糖(C6H12O6)、果糖(C6H12O6)。
17、能发生银镜反应的物质(或与新制的Cu(OH)2悬浊液共热产生红色沉淀):醛类(RCHO)、葡萄糖、麦芽糖、甲酸(HCOOH)、甲酸盐(HCOONa)、甲酸某酯(HCOOR)。
18、常见的官能团及名称:—X(卤原子:氯原子等)、—OH(羟基)、—CHO(醛基)、—COOH(羧基)、—COO—(酯基)、—CO—(羰基)、—O—(醚键)、 C=C (碳碳双键)、—C≡C—(碳碳叁键)、—NH2(氨基)、—NH—CO—(肽键)、—NO2(硝基)
 19、常见有机物的通式:烷烃:CnH2n+2;烯烃与环烷烃:CnH2n;炔烃与二烯烃:CnH2n-2;苯的同系物:CnH2n-6;饱和一元卤代烃:CnH2n+1X;饱和一元醇:CnH2n+2O或CnH2n+1OH;苯酚及同系物:CnH2n-6O或CnH2n-7OH;醛:CnH2nO或CnH2n+1CHO;酸:CnH2nO2或CnH2n+1COOH;酯:CnH2nO2或CnH2n+1COOCmH2m+1
19、常见有机物的通式:烷烃:CnH2n+2;烯烃与环烷烃:CnH2n;炔烃与二烯烃:CnH2n-2;苯的同系物:CnH2n-6;饱和一元卤代烃:CnH2n+1X;饱和一元醇:CnH2n+2O或CnH2n+1OH;苯酚及同系物:CnH2n-6O或CnH2n-7OH;醛:CnH2nO或CnH2n+1CHO;酸:CnH2nO2或CnH2n+1COOH;酯:CnH2nO2或CnH2n+1COOCmH2m+1
20、检验酒精中是否含水:用无水CuSO4 → 变蓝
21、 发生加聚反应的:含C=C双键的有机物(如烯)
22、 能发生消去反应的条件是:乙醇(浓硫酸,170℃),其他醇(浓硫酸、加热);卤代烃(NaOH醇溶液、加热)。
23、能发生酯化反应的是:醇和酸 (羧酸和无机含氧酸,如磷酸、硝酸)
24、燃烧产生大量黑烟的是:C2H2、C6H6
25、属于天然高分子:淀粉、纤维素、蛋白质、天然橡胶(油脂、麦芽糖、蔗糖不是)
26、属于三大合成材料的是:塑料、合成橡胶、合成纤维
27、常用来造纸的原料:纤维素
28、常用来制葡萄糖的是:淀粉
29、能发生皂化反应的是:油脂
30、水解生成氨基酸的是:蛋白质
31、水解的最终产物是葡萄糖的是:淀粉、纤维素、麦芽糖
32、能与Na2CO3或NaHCO3溶液反应的有机物是:含有—COOH:如乙酸
33、能与Na2CO3反应而不能跟NaHCO3反应的有机物是:苯酚
34、有毒的物质是:甲醇(含在工业酒精中);NaNO2(亚硝酸钠,工业用盐,致癌物质)
35、能与Na反应产生H2的是:含羟基的物质(如乙醇、苯酚)、与含羧基的物质(如乙酸)
36、能还原成醇的是:醛或酮
37、能氧化成醛的醇是:R—CH2OH
38、能作植物生长调节剂、水果催熟剂的是:乙烯
39、能作为衡量一个国家石油化工水平的标志的是:乙烯的产量
40、通入过量的CO2溶液变浑浊的是:C6H5ONa溶液
41、不能水解的糖:单糖(如葡萄糖)
42、可用于环境消毒的:苯酚
43、皮肤上沾上苯酚用什么清洗:酒精;沾有油脂是试管用热碱液清洗;沾有银镜的试管用稀硝酸洗涤。
44、医用酒精的浓度是:75%
45、加入浓溴水产生白色沉淀的是:苯酚 46、 加入FeCl3溶液显紫色的:苯酚
47、能使蛋白质发生盐析的两种盐:Na2SO4、(NH4)2SO4
二、有机物的推断
1、根据反应物性质推断官能团 :

2.从有机反应的特征条件突破
有机反应的条件往往是有机推断的突破口。
(1)“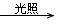 ”这是烷烃和苯环侧链烷烃基的氢被取代的反应条件,如:①烷烃的取代;②芳香烃及其它芳香族化合物侧链烷基的取代;③不饱和烃中烷基的取代。
”这是烷烃和苯环侧链烷烃基的氢被取代的反应条件,如:①烷烃的取代;②芳香烃及其它芳香族化合物侧链烷基的取代;③不饱和烃中烷基的取代。
(2)“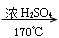
 ”是乙醇分子内脱水生成乙烯的反应条件
”是乙醇分子内脱水生成乙烯的反应条件
(3)“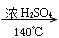
 ”是乙醇分子间脱水生成乙醚的反应条件。
”是乙醇分子间脱水生成乙醚的反应条件。
(4)“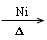
 ”为不饱和键加氢反应的条件,包括:碳碳双键、碳碳叁键、羰基的加成。
”为不饱和键加氢反应的条件,包括:碳碳双键、碳碳叁键、羰基的加成。
(5)“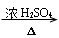
 ” 是①醇消去H2O生成烯烃或炔烃;②酯化反应;③纤维素的水解反应;
” 是①醇消去H2O生成烯烃或炔烃;②酯化反应;③纤维素的水解反应;
(6)“
 ”是卤代烃消去HX生成不饱和烃的反应条件。
”是卤代烃消去HX生成不饱和烃的反应条件。
(7)“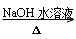
 ”是①卤代烃水解生成醇;②酯类碱性水解反应的条件。
”是①卤代烃水解生成醇;②酯类碱性水解反应的条件。
(8)“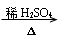
 ”是①酯类水解;②糖类水解;③油脂的酸性水解;④淀粉水解的反应条件。
”是①酯类水解;②糖类水解;③油脂的酸性水解;④淀粉水解的反应条件。
(9)“
 ”是烯烃与水反应生成醇
”是烯烃与水反应生成醇
(10)“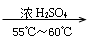
 ”是苯的硝化反应条件。、
”是苯的硝化反应条件。、
(11)“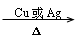
 ”为醇催化氧化的条件。
”为醇催化氧化的条件。
(12)“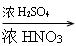
 ”为硝化反应的条件。
”为硝化反应的条件。
(13)“无条件”,为不饱和烃与X2、HX(乙炔除外)加成的条件;酚类和浓溴水取代反应的条件。
(14)“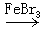 ”为苯及其同系物苯环上的氢被卤素取代的反应条件。
”为苯及其同系物苯环上的氢被卤素取代的反应条件。
(15)“溴水或 Br2的CCl4溶液”,是不饱和烃加成反应的条件。
(16)“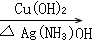 ”是醛氧化的条件。
”是醛氧化的条件。
(17)“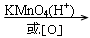 ”是苯的同系物氧化成苯甲酸的条件。
”是苯的同系物氧化成苯甲酸的条件。
(18)“甲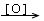 乙
乙  丙”,连续两次氧化,必为醇氧化成醛,醛再氧化成酸的反应条件。
丙”,连续两次氧化,必为醇氧化成醛,醛再氧化成酸的反应条件。
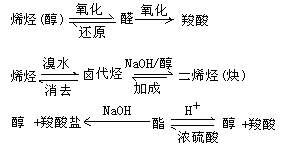
3.从物质的转化关系突破
在有机框图题中,有机物烯、卤代烃、醇、羧酸、酯,在一定条件下,存在如下重要转化关系:
三、有机合成
1、官能团的引入:

其中苯环上引入基团的方法:

2、官能团的消除
(1)通过加成清除不饱和键;
(2)通过消去、氧化、酯化等消除醇羟基;
(3)通过加成或氧化清除醛基。
3、官能团的保护
在有机合成中,当某步反应发生时,原有需要保留的官能团可能也发生反应(官能团遭到破坏),从而达不到预期的合成目标,因此必须采取措施,保护官能团,待反应完成后再复原。官能团保护必须符合下列要求:
a 只有被保护基团发生反应(保护),而其它基团不反应;
b 被保护的基团易复原,复原的反应过程中不影响其它官能团。
例如:防止醇羟基(或羧基)被氧化(碱性条件下反应),可利用酯化反应生成酯,从而达到保护羟基(或羧基)的目的。
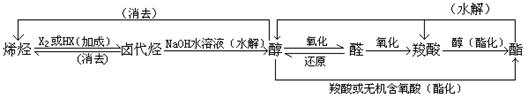
4、有机合成路线:
四、有机物的鉴别
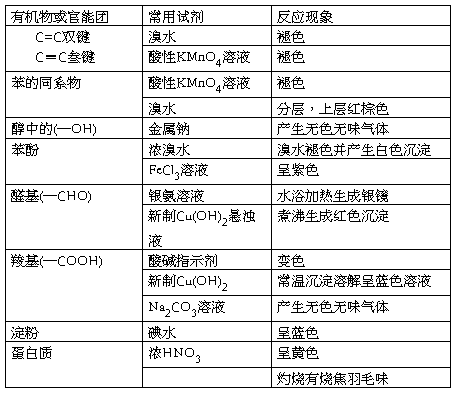
1、常见物质的特征反应列表如下:
2.鉴别、鉴定、分离、提纯的区别
鉴别是指在给定的几种物质中,根据这几种物质性质上的差别,用物理方法或化学方法,通过必要的化学实验,根据产生的现象的现象把它们一一区别开。鉴定是对组成物质的每种成分进行全面的检测,确定它是不是这种物质。分离是将混合物中各组成成分分开,它要求各组成成分不能改变,在分离过程中若使用了化学方法使其成分发生了变化,但最终必须恢复原混合物中各个物质。提纯是将混在某物质中的几种或一种杂质除去。至于杂质转化成什么物质,是否需要回收及如何处理,若没有要求,一般不予考虑。
3.常用试剂及应用原理
1、 溴水:应用原理:(1)物理性质中溶解性(萃取):直馏汽油、苯及同系物、液态烷烃、四氯化碳等有机物分别与溴水混合,振荡、静置后,溴进入有机层而使水层接近无色。(2)化学性质中加成反应(与烯烃、炔烃、二烯烃等不饱和烃发生加成反应而使溴水褪色)、氧化反应(与含有醛基的物质发生氧化反应而使溴水褪色、用于鉴别葡萄糖和果糖时,用稀溴水)和取代反应(与苯酚等发生取代反应而使溴水褪色且生成白色沉淀)。
2、 酸性高锰酸钾溶液:应用原理:它的强氧化性。(1)分子结构中含碳碳双键或碳碳三键的有机物,可使其褪色。(2)含有羟基、醛基的有机物(醇、醛、葡萄糖、麦芽糖等还原物质)可使其褪色。(3)苯的同系物能使其褪色。
3、 新制制氢氧化铜悬浊液:应用原理:(1)它的氧化性使含有醛基的物质(醛、甲酸、甲酸某酯、葡萄糖、麦芽糖等)在碱性环境中加热后生成红色沉淀。
4、 新制银氨溶液:应用原理:它的氧化性使含有醛基的物质(醛、甲酸、甲酸某酯、葡萄糖、麦芽糖等)在碱性环境中水浴加热后生成银镜。
5、 水:应用原理:应用于密度不同,不溶于水的有机物的鉴别。
6、 硝酸银溶液及稀硝酸:应用原理:用于检验卤代烃中的卤素原子。
7、 含铁离子的溶液(常用三氯化铁溶液)。应用原理:与苯酚反应使溶液变为紫色。
8、 碘水:应用原理:碘单质与淀粉结合后显蓝色。
9、 石蕊:应用原理:酸性较强的有机物质(低级羟酸)使紫色石蕊试液或湿润的蓝色石蕊试液变红。
10、钠:应用原理:分子结构中含羟基、羧基的有机物一般可与其反应产生氢气。
11、碳酸钠溶液:应用原理:酸性较强有机物(低级羧酸、苯磺酸)一般可与其反应产生二氧化碳。
12、氢氧化钠溶液:应用原理:在水中溶解度小的酚、羧酸类物质与氢氧化钠反应生成易溶的钠盐。
4.注意事项
1.选择试剂原理:操作简单、现象明显。
2.操作过程要客观、全面,表述要正确。有机物中加入试剂后,一般要求“振荡”。如:将酸性高锰酸钾溶液滴入甲苯时,不振荡,就不会褪色,或褪色极慢。故叙述操作时,“振荡”不能丢。
3.卤代烃中卤原子的检验实验,先用过量的硝酸中和碱,再加硝酸银溶液。
4.在银镜反应配制银氨溶液时,稀氨水与稀硝酸银溶液的滴加顺序,相对量的控制,描述时必须注意。
五、有机物除杂常见错误及原因分析
依据有机物的水溶性、互溶性以及酸碱性等,可选择不同的分离方法达到分离、提纯的目的。在进行分离操作时,通常根据有机物的沸点不同进行蒸馏或分馏;根据物质的溶解性不同,采取萃取、结晶或过滤的方法。有时也可以用水洗、酸洗或碱洗的方法进行提纯操作。下面就有机物提纯中常见的错误操作进行分析。(括号中物质为杂质)
1.乙烷(乙烯)
错例A:通入氢气,使乙烯反应生成乙烷。
错因:①无法确定加入氢气的量;②反应需要加热,并用镍催化,不符合“操作简单”原则。
错例B:通入酸性高锰酸钾溶液,使乙烯被氧化而除去。
错因:乙烯被酸性高锰酸钾溶液氧化可生成二氧化碳气体,导致新的气体杂质混入。
正解:将混合气体通入溴水洗气,使乙烯转化成1,2-二溴乙烷液体留在洗气瓶中而除去。
2.乙醇(水)
错例A:蒸馏,收集78℃时的馏分。
错因:在78℃时,一定浓度(95.57%)的乙醇和水会发生“共沸”现象,即以恒定组成共同气化,少量水无法被蒸馏除去。
错例B:加生石灰,过滤。
错因:生石灰和水生成的氢氧化钙能溶于乙醇,使过滤所得的乙醇混有新的杂质。
正解:加生石灰,蒸馏。(这样可得到99.8%的无水酒精)。
3.乙醇(乙酸)
错例A:蒸馏。(乙醇沸点78.5℃,乙酸沸点117.9℃)。
错因:乙醇、乙酸均易挥发,且能形成恒沸混合物。
错例B:加入碳酸钠溶液,使乙酸转化为乙酸钠后,蒸馏。
错因:乙醇和水能形成恒沸混合物。
正解:加入适量生石灰,使乙酸转化为乙酸钙后,蒸馏分离出乙醇。
4.溴乙烷(乙醇)
错例:蒸馏。
错因:溴乙烷和乙醇都易挥发,能形成恒沸混合物。
正解:加适量蒸馏水振荡,使乙醇溶于水层后,分液。
5.苯(甲苯)[或苯(乙苯)]
错例:加酸性高锰酸钾溶液,将甲苯氧化为苯甲酸后,分液。
错因:苯甲酸微溶于水易溶于苯。
正解:加酸性高锰酸钾溶液后,再加氢氧化钠溶液充分振荡,将甲苯转化为易溶于水的苯甲酸钠,分液。
6.苯(溴)[或溴苯(溴)]
错例:加碘化钾溶液。
错因:溴和碘化钾生成的单质碘又会溶于苯。
正解:加氢氧化钠溶液充分振荡,使溴转化为易溶于水的盐,分液。
7.苯(苯酚)
错例A:加FeCl3溶液充分振荡,然后过滤。
错因:苯酚能和FeCl3溶液反应,但生成物不是沉淀,故无法过滤除去。
错例B:加水充分振荡,分液。
错因:常温下,苯酚在苯中的溶解度要比在水中的大得多。
错例C:加浓溴水充分振荡,将苯酚转化为三溴苯酚白色沉淀,然后过滤。
错因:三溴苯酚在水中是沉淀,但易溶解于苯等有机溶剂。因此也不会产生沉淀,无法过滤除去;
正解:加适量氢氧化钠溶液充分振荡,将苯酚转化为易溶于水的苯酚钠,分液。这是因为苯酚与NaOH溶液反应后生成的苯酚钠是钠盐,易溶于水而难溶于甲苯(盐类一般难溶于有机物),从而可用分液法除去。
8.乙酸乙酯(乙酸)
错例A:加水充分振荡,分液。
错因:乙酸虽溶于水,但其在乙酸乙酯中的溶解度也很大,水洗后仍有大量的乙酸残留在乙酸乙酯中。
错例B:加乙醇和浓硫酸,加热,使乙酸和乙醇发生酯化反应转化为乙酸乙酯。
错因:①无法确定加入乙醇的量;②酯化反应可逆,无法彻底除去乙酸。
错例C:加氢氧化钠溶液充分振荡,使乙酸转化为易溶于水的乙酸钠,分液。
错因:乙酸乙酯在氢氧化钠溶液中容易水解。
正解:加饱和碳酸钠溶液(乙酸乙酯在饱和碳酸钠溶液中的溶解度较小),使乙酸转化为钠盐溶于水层后,分液。
第二篇:有机物知识点总结
乙烯:
1、 乙烯的物理性质:无色,稍有气味,不溶于水,易溶于有机溶剂,在标准状况下的密度是1.25g/L,与空气的密度很接近。
2、 来源于用途:乙烯是石油化工的重要产品之一,它的 产量作为一个国家石油化工发展水平的标志。乙烯还是植物的生长调节剂和水果的催熟剂。
3、 乙烯分子的组成与结构:
4、 化学性质:(1)乙烯的燃烧 :
(2)乙烯被其他氧化剂氧化:乙烯是酸性高锰酸钾溶液褪色的实质是乙烯呗高锰酸钾氧化。利用这个反应我们可以鉴别甲烷和乙烯。乙烯被高锰酸钾氧化说明乙烯比甲烷易被氧化。
(3)加成反应:乙烯使溴的四氯化碳溶液褪色,实质是乙烯与溴单质反应生成了无色的1,2-二溴乙烷液体。
●加成反应:有机物分子中不饱和的原子与其他原子(或原子团)直接结合省成新的化合物的分子的反应叫做加成反应。
●在一定条件下和乙烯加成的物质:
乙烯与水加成反应生成乙醇
乙烯与氢气发生反应生成乙烷
乙烯与氯化氢反应生成氯乙烷
▲ 注意:1将乙烯通入溴水中,也发生褪色现象,也是加成反应生成了1,2-二溴乙烷。 ▲ 2实验室中用溴的四氯化碳溶液鉴别乙烯和甲烷乙烷,也可以用溴的四氯化碳溶液火溴水出去甲烷乙烷中的乙烯。
▲ 3乙烷与氯气发生取代反应也生成氯乙烷,单产物是若干种氯代烷的混合物,分离起来难度大,用乙烯跟氯化氢通过加成反应能制得觉纯净的氯乙烷。
烯烃
1、 乙烯属于烯烃类物质,乙烯是最简单的烯烃。
2、 烯烃的分子里都有一个碳碳双键 ,在分子组成上臂乙烯分子多n个CH2 。CH2也是乙烯分子的最简式。乙烯分子的通式。烯烃是分子里含有一碳碳双键 的链烃
3、 碳碳双键中有一个不稳定所以化学性质比较活泼,能氧化反应,能被高锰酸钾溶液氧化,能加成反应,
4、 ●烯烃的加成由于分子的对称性变化,加成产物可能个有多种同分异构体。
苯
1、 分子结构 :苯分子中不存在一般的碳碳双键和单键,而是一种介于之间的六个一样的键,苯分子中6个谈6个氢全在一个平面中,键角120°。
2、 是不饱和烃,化学性质 (1)剧烈燃烧,橙红色火焰,黑烟。反应方程式:
但是苯很难被高猛酸钾氧化,不能使高锰酸钾溶液褪色
(2)取代反应::
①在催化剂的作用下,苯与溴(Br2)发生取代反应生成溴苯和溴化氢。
注意:a、苯只能与液溴发生取代反应,不与溴水反应。溴水中的溴只能被苯萃取。
B、反应中加入的催化剂是Fe,实际其催化作用的是FeBr3 ,
C、生成的溴苯是无色液体,密度比水大。
D、苯与 Br2 之发生一元取代反应,
E、用苯和溴制成的溴苯往往因溶解着一定量的溴二显褐色,用氢氧化钠稀溶液反复洗涤并分页,可将溴苯纯化。
②在浓硫酸作用下,苯在50~60°C还可以与硝酸发生取代反应生成硝基苯和水。 反应方程式:
属于取代反应, 一个氢被硝基取代 ,生成硝基苯 。又叫硝化反应,(从属于取代反应) 苯跟浓硫酸和浓硝酸的混合物制取的硝基苯一般为淡黄色,原因是硝基苯中混杂着硝酸。用氢氧化钠稀溶液反复洗涤并分液,可将硝基苯纯化。
A、 浓硝酸的作用:反应物、起硝化作用。浓硫酸作用:催化剂、吸水作用。
B、 硝基苯是一种带有苦杏仁味、无色油状密度比水大,且有毒。
C、 硝基( ) 、二氧化氮( )、亚硝酸根离子( )不同
D、 硝化反应的产物是硝基化合物,其中碳原子与氢原子直接相连。此反应温度 ,
且为放热反应
E、 配置一定的浓硫酸和浓硝酸的混合物,先将浓硝酸注入容器中,在慢慢加入浓硫酸。 ③将甲苯跟浓硫酸和浓硝酸的混合物加以微热,即可发生下列反应:
2,4,6-三硝基甲苯简称三硝基甲苯,又叫TNT,通常是一种淡黄色的晶体,不溶于水。是烈性炸药。甲苯的苯环性质比苯的活泼。
(3)加成反应
在有镍催化剂的存在和180°C~250°C的条件下,苯可以与氢气发生加成反应,生成环己烷。
注意:1mol苯与3molH2 加成。苯与H2加成反应后,有平面结构改变为空间结构。环己烷的分子式 ,属于环烷烃(通式 )。环己烷与烯烃C6H12互为不同类别的同分异构体。
苯的用途来源:
乙醇
1乙醇分子的结构和组成,可以看做是乙烷分子中的一个氢原子被羟基(-OH)所取代二成的。结构式结构简式
3、 官能团:概念:决定有机化合物的化学特性的原子或原子团叫做官能团。
常见的官能团:①卤原子(-X)②羟基(-OH)③硝基(-NO2)④碳碳双键⑤
醛基(-CHO)⑥羧基(-COOH)
4、 乙醇的化学性质:A、实验:乙醇跟单质那反应生成了氢气
B、乙醇的氧化反应——乙醇的燃烧
——乙醇的催化氧化(实验)
乙醇催化氧化生成乙醛时,乙醇分子应为得氧,而是失去两个氢原子生成乙醛分子。因此,乙醇变为乙醛的反应实质是去氢反应,属于有机反应类型的氧化反应。乙醛分子的结构简式CH3CHO乙醛分子中的官能团是-CHO醛基,醛基可以被氧化,也可以加氢被还原。乙醛
是工业制乙酸的中间产物:方程式
乙醇具有还原性,可以被重铬酸钾或硫酸酸化的高锰酸钾等氧化剂氧化
乙酸
1、 乙酸俗称醋酸。易挥发,有强烈的刺激性气味,易溶于水和乙醇。
2、 结构与组成
3、 化学性质:A、酸性弱酸(酸性比和H2CO3和HClO强)
水垢,苏打,小苏打,鸡蛋壳
B、乙酸的酯化反应:(实验)在有浓硫酸存在病假热的条件下,乙酸和乙醇发生化学反应生成了乙酸乙酯和水、
这种醇和酸反应生成脂和水的反应叫酯化反应,其实也是取代反应CH3CH2O-原子团取代了
CH3COOH分子里的-OH二生成乙酸乙酯和水。
① 乙酸乙酯通常为无色油状液体有香味,比水密度大 ,难容与水,在强碱中发生水解反
应生成乙醇和乙酸钠
② 包和碳酸钠溶液在收集中的作用,通过碳酸钠与乙酸的反应出去乙酸,通过水的溶解
出去乙醇,降低乙酸乙酯的溶解°,提高乙酸乙酯的收集率。
③ C、乙烯的氧化反应:点燃生成二氧化碳和水
