金属的化学性质
1、将甲、乙两种金属片分别放入硫酸铜溶液中,甲表面析出金属铜,乙没有明显现象.据此判断,三种金属的金属活动性顺序是( )
2、A.甲>铜>乙 B.乙>铜>甲 C.铜>甲>乙 D.甲>乙>铜
3、公元2世纪,我国古代炼丹家魏伯阳著有《周易参同契》,这是世界上现存最早的一部炼丹专著.书中描写道:“金入于猛火,色不夺精光.”这句话是指黄金的性质在强热条件下( )
A.易氧化 B.易还原 C.很稳定 D.很活泼
3、下列化学方程式书写正确的是( )
A.氧化汞加热分2 HgO △ Hg+O2↑
B.镁在空气中燃烧:2Mg+O2 点燃2MgO
C.铝和氧气反应:Al+O2=AlO2
D.碳在氧气中燃烧:C+O2=CO2
4、小兰家中收藏了一件清末的铝制佛像,该佛像至今仍保存完好.该佛像仍未锈蚀的主要原因是 ( )
A.铝不易发生化学反应
B.铝的氧化物容易发生还原反应
C.铝不易被氧化
D.铝易被氧化,但氧化铝具有保护内部铝的作用
5、下列能由盐酸与金属直接反应制得的物质是( )
A.FeCl3 B.CuCl2 C.AlCl3 D.AgCl
6、下列关于锌、铁、铜的说法错误的是( )
A.均可以导电 B.均可以和氧气反应
C.均可以和稀盐酸反应 D.铁能与硫酸铜溶液的溶质发生置换反应
7、将洁净的铁丝浸入含有Ag(NO3)2和Zn(NO3)2和电镀废水中,一段时间后取出,铁丝表面覆盖了一层物质,这层物质是( )
A.Ag、Zn B.Ag C.Zn D.Ag、Fe
8、在下图所示的实验中,依据实验事实与现象,判断实验中相关金属的活动性由强到弱的顺序为( )
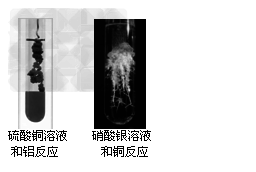
A.Ag、Cu、Al
B.Al、Cu、Ag
C.Cu、Al、Ag
D.Al、Ag、Cu
9、常见金属活动性顺序如图,下列各组物质间能发生反应的是 ( )
A.铜和硝酸钠溶液 B.铁和稀盐酸 C.锌和氯化钾溶液 D.银和稀硫酸
10、 锰和镍(Ni)都是金属元素,将镍丝插入MnSO4溶液中无变化,插入CuSO4溶液中,镍丝上有红色固体析出。Mn、Ni、Cu三种金属的活动性由强到弱的顺序是 ( )
A.Cu、Mn、Ni B.Mn、Ni、Cu C.Ni、Cu、Mn D.Mn、Cu 、Ni
11、下列各组内的两种物质不会发生化学反应的是( )
A.铁和硫酸铜溶液 B.铜和硫酸锌溶液
C.稀盐酸和纯碱D.碳酸钠溶液和石灰水
12、金属单质家族四兄弟W 、X 、Y 、Z ,不小心掉入稀盐酸池,神情如下图所示,则W、X、Y、Z的金属活动性顺序为( )
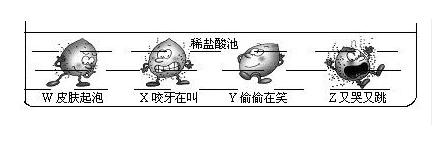
A.X>W>Z>Y B.Z>X>W>Y C.W>X>Y>Z D.Y>Z>X>W
13、在以下四种金属中,有一种金属的盐溶液与其他三种金属都能发生置换反应,这种金属是( )
A. Fe B. Cu C. Zn D. Ag
14、有X、Y、Z三种金属,X在常温下就能与氧气反应,Y、Z在常温下几乎不与氧气反应;如果把Y和Z分别放入稀硫酸中,Y溶解并产生氢气,Z不反应。根据以上实验事实判断,X、Y、Z三种金属的活动性由弱至强的顺序正确的是( )
A.X Z Y B.X Y Z C.Y Z X D.Z Y X
15、先取甲、乙、丙、丁四种金属粉末,分别投入相同浓度的稀盐酸中,只有甲、乙能产生气体,乙反应更剧烈;再取一小块丁投入丙的硝酸盐溶液中,丁的表面有丙析出.则甲、乙、丙、丁四种金属的活动性顺序为( )
A.甲>乙>丙>丁 B.乙>甲>丙>丁
C.丁>丙>乙>甲 D.乙>甲>丁>丙
16、将X、Y、Z三块大小相同的金属片分别投入到稀盐酸中,X表面无明显现象,Y表面缓慢地产生气泡,Z表面迅速产生大量气泡。则X、Y、Z的金属活动性顺序为
A.X>Z>Y B.Z>Y>X C.X>Y>Z D.Z>X>Y
17、废旧手机的某些部件含有Mg、Al、Cu、Ag等金属.为了回收重金属,将旧手机部件浸入足量稀盐酸中充分反应后,过滤,所得固体中含有的金属是( )
A.Cu、Ag B.Mg、Ag C.Al、Cu D.Mg、Al
18、在含有H2SO4的CuSO4溶液中加入一定量的铁粉,充分反应后,发现有固体剩余.则下面的叙述正确的是( )
A.反应后溶液中一定含有FeSO4 B.反应后溶液中一定没有CuSO4
C.剩余固体物质中一定不含Fe D.剩余固体的质量一定增加
19、现有M、N、X、Y四种金属,将它们分别投入盐酸中,只有X、Y发生反应产生气泡;将Y投入X的硝酸盐溶液中,有金属X析出;将M投入N的硝酸盐溶液中,有金属N析出.则四种金属的活动性顺序为
A.N>M>X>Y B.X>Y>M>N C.Y>X>M>N D.Y>X>N>M
20、已知置换反应:A+B→C+D能够发生.
(1)若D为H2,B为稀硫酸,则A的选择应满足的条件是 ;写出一个符合该条件的化学方程式 .
(2)若D为Cu,则化合物B可能为 (填化学式),写出一个符合该条件的化学方程式 .
21、已知A、B是两种常见的单质,甲、乙是两种常见的化合物。它们之间在一定条件下存在下列转化关系:A+甲→B+乙。请判断并回答下列问题。
(1)若A、B都是金属单质,写出一个符合上述条件的化学方程式: .
(2)若A是金属单质,B是非金属单质,写出一个符合上述条件的化学方程式: .
(3)若A是非金属单质,B是金属单质,写出一个符合上述条件的化学方程式: .
(4)根据反应形式,上述化学反应的基本类型均为________________,这类反应的主要特征是 。
第二篇:金属的化学性质习题(含答案)
第三章 金属及其化合物
1.下列关于金属的叙述中正确的是( )。
A.所有的金属都是固态的
B.金属具有导电性、导热性和延展性
C.活泼的金属、或较活泼的金属能与酸反应,但不能与碱反应
D.金属元素在自然界中都是以化合态存在的
2.地壳里含量最多的金属元素是( )。
A.氧 B.铝 C.硅 D.铁
3.铝在人体中积累可使人慢性中毒,世界卫生组织将铝确定为食品污染源之一而加以控制。铝在下列使用场合中,必须加以控制的是 ( ) 。
A.制造炊具 B.制防锈油漆 C.制铝合金窗 D.炼铝厂制造铝
4.少量钠应保存在( )。
A.密闭容器中 B.水中 C.煤油中 D.汽油中
5.下列关于金属Na的叙述中,说法正确的是( )。
A.Na在空气中燃烧,发出黄色火焰 B.Na在空气中燃烧,产物是Na2O
C.Na是银白色金属,硬度大,熔点高 D.Na常温和加热时反应,产物一样
6.钠着火时,可用来灭火的物质或器材是 ( )。
A. 自来水 B. 沙土 C. 泡沫灭火器 D. 干粉灭火器
7.铝在空气中能够稳定存在的原因是( )。
A.铝的活泼性强 B.铝的还原性差
C.铝与氧气不反应 D.铝表面有氧化膜
8.为了除去铁粉中的少量铝粉,可以选取下列哪种溶液( ) 。
A.浓盐酸 B.硝酸 C.硫酸 D.浓氢氧化钠溶液
9.钠与水反应时的现象与钠的下列性质无关的是 ( )。
A. 钠熔点低 B. 钠的密度小 C. 钠的硬度小 D. 有强还原性
10.金属钠分别与下列溶液反应时,既有气体又有沉淀产生的是 ( )。
A. (NH4)2SO4 B. NaHCO3 C. BaCl2 D. CuSO4
11.下列叙述中,不正确的是 ( )。
A. 钠原子有强还原性,钠离子有弱氧化性
+ B. Na离子浓度大的溶液可能显碱性
C. 由于钠很活泼,所以定能从溶液中置换出金属活动性顺序表中钠后面的金属
D. 钠是电和热的良导体
12.将2.3 g钠放入100 g水中,生成溶液中溶质的质量分数是 ( )。
A. 等于2.3% B. 等于4% C. 大于2.3% D. 大于4%
13.足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为( )。
A 1︰2 B 3︰2 C 3︰1 D 6︰1
14若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能共存的是
A. Fe3+、NO3?、Cl?、Na+ B.Ba2+、Mg2+、HCO3?、AlO2?
C.NO3?、Na+、K+、CO32? D.NO3?、K+、AlO2?、OH?
15下列物质中,有一种物质的颜色与其它三种的颜色不同,这种物质是 ( )
A.NaOH B.Na2O C.Na2O2 D.NaHCO3
16.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是 ( )
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.木炭(C)和O2
17.把少量的金属钠分别放入钠放入CuSO4溶液中,现象是______________________________ ___________,离子方程式是__________________________________________。
-18.碱金属能形成离子型氢化物。如氢化钠的化学式为NaH,其中H具有较强的还原性。
⑴NaH能与水剧烈反应生成对应的碱和氢气,反应的化学方程式为_________________ 第 1 页 共 1 页
___________________, 氧化剂是 ,还原剂是 。 ⑵常用

NaH在高温下将TiCl4还原成Ti,反应的化学方程式为_____________________ __________________________,氧化剂是 ,还原剂是 。
19.钠与水反应时产生的各种现象如下: ①钠浮在 原因是 ②钠熔化
原因是 ③小球 游动逐渐减小,最后 ;原因是
④发出 声音,原在是 ⑤滴入酚酞后溶
液 ,原因是 。
20.写出下列各步的化学方程式,是离子反应的写出离子方程式。
(1)
(2)
(3)
(4)
(5)
(6)
(7)
21. 写出下列各化学方程式(是离子反应的写出离子反程式)
(1)铁和水蒸气的反应
(2)铝和氧气的反应
(3)铝和盐酸的反应
(4)铝和氢氧化钠的反应
22.(7分)在铝质易拉罐中收集满CO2气体,然后在其中倒入10mL浓NaOH溶液,并迅速用胶带将易拉罐口封住,能够观察到的实验现象是易拉罐突然变瘪了,可经过一段时间之后,又可以观察到的现象是 。试解释易拉罐变瘪的原因 ;并解释后一现象的原因 。写出反应过程中的两个离子方程式 ; 。
23.(6分)运用比较方法是化学科学中研究物质性质的基本方法之一,请运用比较法解答题 过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:2Na2O2+2CO2=2Na2CO3+O2↑,Na2O2+2CO=Na2CO3。
?1? 试分别写出Na2O2与SO2、SO3反应的化学方程式:
。
。
?2? 通过比较可知,当非金属元素处于其氧化物与过氧化钠反应有O2生成。
24.(15分) 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
请回答该实验中的问题。
(1)写出该反应的反应方程式: ;并指明该氧化还原反应的还原剂是 ,氧化剂是 。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(3)酒精灯和酒精喷灯点燃的顺序是 ,为什么
25.将质量为1.15g钠用刺了孔的铝箔包裹后放入水中,共收集到1.232L(标准状况)气体。请回答下列问题:(1)1.15g钠与水反应,理论上生成气体的体积(标准状况)为____________L。(2)反应后溶液的体积为100mL,则溶液中NaOH的物质的量浓度为多少?
26.把5.1g镁铝合金粉末放入500mL 1mol/L盐酸中,恰好完全反应。试计算:
(1)该合金中镁和铝的物质的量各为多少mol。
(2)将等质量的该合金投入足量的氢氧化钠溶液中,求标况下放出气体的体积。

参 考 答 案
一、选择题1.B 2. B 3. A 4.C 5.A 6.B 7. D 8.D 9.C 10.D 11.C
12.C 13.B 14.B 15.C16 C(
17.(每空2分)①钠浮在液面上,很快熔化成小球,钠球在水面上四处游动,并发出嘶嘶的响声;2Na+2H2O=2NaOH+H2↑ ②溶液中有蓝色沉淀产生;2NaOH+CuSO4=Na2 SO4+Cu(OH)2↓(蓝色)
18.(每空分,化学方程式2分)易拉罐又鼓起来;易拉罐中的CO2与浓NaOH反应,致使易拉罐内气压降低,从而使易拉罐被大气压压瘪;浓NaOH与易拉罐(Al)反应产生H2,随着易拉罐内H2量的增多,易拉罐内气压增大;CO2+2OH? =CO32?+H2O;2Al+2OH?+2H2O=2AlO?2+3H2?
19.(每空2分)?1? SO2+Na2O2=Na2SO4;SO3+Na2O2=Na2SO4+O2;?2? 最高
20.(每空1分,化学方程式2分)(1);Fe;H2O
(2)在玻璃管口A处接一断乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则标明该套装置气密性良好。
(3)为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;防止爆沸事故的发生。
25 .1.15gNa物质的量为0.05mol 可产生氢气的量 0.025mol 体积0.56L<1.232L
说明铝箔参加了反应 产生H2 1.232-0.56 = 0.672L 物质的量0.03mol
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
产生0.03molH2 消耗NaOH 0.02mol
溶液中NaOH的物质的量 0.05 - 0.02 = 0.03mol
溶液中NaOH的物质的量浓度为 0.03/0.1L = 0.3mol/L
氧化的金属钠中Na及Na2O2物质的量0.03mol和0.01mol
26设Al为x mol,Mg为 y mol,
那么27x+24y=5.1………………①
因为1mol Al能与3mol HCL反应,1 mol Mg能与 2 mol HCl反应
那么3x+2y=0.5………………②
可解得x=0.1,y=0.2
该合金中镁和铝的物质的量都是0.1 mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
1 mol Al 可与NaOH反应放出1.5 mol H2
0.1 mol Al可放出0.15 mol H2
V= 22.4*0.1*3/2=3.36L
