第一节 金属的化学性质(1)
【学习目标】
1.运用钠和铝的化学性质解决实际问题。
2. 透过现象看本质,分析发生反应的内在原因,以提高自身观察能力和分析问题的能力。
3 培养科学分析问题的能力和方法。
【学习重点】钠的氧化和钠与水的反应
【自主学习、探究新知】
1. 金属的存在及通性
绝大多数金属元素都以 形式存在。这是因为金属化学性质活泼,易与其他物质发生反应。
地壳中含量最多的金属元素是 ,含量在前三位的元素分别是 。
金属的物理性质 。
2.金属活动性顺序表
3. 举例说明金属能发生哪些化学反应
【基础知识、加强记忆】
一、 金属与非金属的反应
1. 钠与氧气的反应
钠的物理性质:银白色,密度小,熔、沸点低,硬度小。

钠的保存条件:
2. 科学探究
(1) 加热铝箔
现象:铝箔熔化,表面失去光泽,熔化的铝并不滴落,好象有一层膜兜着
原 因:因为铝表面有一层氧化膜保护了铝。构有膜的氧化铝(Al2O3)的熔点很高,没有熔化,包在外面使熔化的液态铝不会滴落下来。
(2)用砂纸打磨铝箔,除去氧化膜后,再加热至熔化
现象:铝箔熔化,失去光泽,熔化的铝仍然不滴落
原因:铝很活泼,除去原来的氧化膜后,在空气中很快生有一层新的氧化膜。
结论:铝很活泼,常温下能与空气中的氧气反应,生成一层致密的氧化膜,起保护的作用。化学方程式:
3. 总结:活泼的金属在空气中易与氧气反应,生有一层氧化物。有的氧化膜疏松,不能保护内层金属,如铁和钠等。有的氧化物致密,可以保护内层金属不被继续氧化,如铝等。
二、 金属与酸和水的反应
1. 金属和水的反应
实验操作:把一块钠投入滴有酚酞溶液的水中
实验现象及解释:
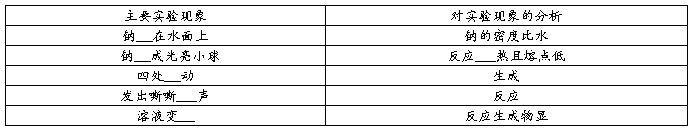
化学方程式:
 记忆顺口溜:钠浮于水,熔成球。球儿闪亮,四处游。有“嘶”声儿,溶液红。
记忆顺口溜:钠浮于水,熔成球。球儿闪亮,四处游。有“嘶”声儿,溶液红。
科学探究:
实验现象:
化学方程式:
【运用新知、比比谁强】:
一、金属的通性
1. 下列关于金属性质的叙述正确的是 ( )
A.金属一般都容易导电、导热,具有延展性 B.金属都具有较高的硬度和密度
C.所有金属都呈固态 D.金属单质都能和稀硫酸反应产生氢气
2. 下列关于金属元素特征的叙述正确的是 ( )
A.金属元素的原子只有还原性,离子只有氧化性 B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价均不同 D.金属单质在常温下均是固体
3. 对于金属的下列叙述正确的是 ( )
A.在点燃Mg、Al之前,应先用砂纸打磨,除去表面的氧化膜
B.用砂纸打磨的铝条,放在酒精灯上加热至熔化,铝会滴落下来
C.铁在氧气中燃烧生成的氧化物的主要成分是Fe2O3
D.金属单质在自然界中多以游离态存在
二、钠与氧气反应
4. 下列关于钠的叙述中,正确的是 ( )
A.钠在自然界中存在游离态 B.钠是一种灰色的固体
C.钠可以保存在煤油或CCl4中 D.钠着火时可以用沙土扑灭
5. 下列说法中错误的是 ( )
A.钠在常温下就容易被氧化 B.钠受热后能够着火燃烧
C.钠在空气中缓慢氧化能自燃 D.钠在氧气中燃烧比在空气中更为剧烈
6. 等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是 ( )
A.第一块钠失去电子多 B.两块钠失去电子一样多
C.第二块钠的反应产物质量最大 D.两块钠的反应产物质量一样大
7. 镁、铝能够在空气中稳定存在的原因是 ( )
A.性质不活泼,不与空气中的成分反应 B.镁、铝与氧气的反应速率极慢
C.经过了特殊工艺处理 D.与氧气反应形成了氧化物保护膜
8.铝是重要的金属材料之一,下列关于铝的叙述中,不正确的是 ( )
A.铝原子最外层有3个电子 B.铝是地壳中含量最多的金属元素
C.在常温下,铝不能与氧气反应 D.铝易被氧化,而Al3+则很难被还原
三、钠与水的反应
9. 将一小块金属钠投入到滴有紫色石蕊试液的盛冷水的烧杯中,甲同学认为可以观察到下列实验现象,其中正确的有 ( )
①钠投入水中,先沉入水底,后浮出水面 ②钠立即与水反应,并有气体产生 ③反应后溶液变红 ④钠熔化成闪亮的小球 ⑤小球在水面上四处游动 ⑥有“嘶嘶”的响声发出
A.①②③④ B.②③④⑤
C.②④⑤⑥ D.③④⑥
10. 在烧杯中加入水和苯(苯的密度为0.88 g·cm-3,与水互不相溶,且不与钠反应)各50 mL,将一小粒金属钠(密度为0.97 g·cm-3)投入烧杯中,观察到的现象可能为 ( )
A.钠在水层中反应并四处游动 B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动 D.钠在苯与水的界面处与水反应并可能上下跳动
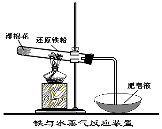
四、铁与水蒸气、酸的反应
11. 有关铁与水反应的说法中,正确的是 ( )
A.在任何条件下,铁与水均不发生反应
B.在高温时,铁与水蒸气反应生成氢氧化铁和氢气
C.在高温时,铁与水蒸气反应生成氧化铁和氢气
D.在高温时,铁与水蒸气反应生成四氧化三铁和氢气
12. 下列说法不正确的是 ( )
A.铁在一定条件下与纯氧气、水蒸气反应的共同产物是Fe3O4
B.铁在高温下与水蒸气的反应是置换反应
C.铁与盐酸反应生成氯化铁和氢气
D.铁与盐酸、水蒸气反应,作还原剂
13.常温下,金属钠在空气中就会发生反应,生成________,反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
因此,在实验室中,要把钠保存在________________或________中。钠受热与氧气剧烈反应,产生______火焰,生成____________,反应的化学方程式为_____________________
___________________________________________________________________________________________________________________________。
14.钠与H2在一定温度下可反应生成一种叫氢化钠(NaH)的白色化合物,该化合物在熔融状态下可导电,取少量NaH放入水中,剧烈反应放出一种无色、无味的气体,并形成一种碱性溶液。
(1)Na与H2反应的化学方程式为_____________________________________________,
H2作____________剂。
(2)NaH与水反应的化学方程式为___________________________________________,
NaH作____________剂。
【思考与收获】
第二篇:金属的化学性质 教案
第三章 金属及其化合物
第一节 金属的化学性质
(第一课时)
一、教材分析
初中化学中介绍的金属主要是铝、铁和铜,金属的性质以物理性质为主,化学性质只提及铝与氧、铁和氧、镁和氧的反应,同时介绍了金属活动性顺序,让学生初步了解金属与酸或盐溶液反应的规律。
“金属的化学性质”是在初中介绍的金属的基础上,进一步加深和提高。金属种类选了钠、铝、铁,具有代表性:一种非常活泼的金属,两种较活泼金属;除钠外,其他两种金属都是常见金属,学生有感性的认识,能与日常生活中金属的应用相结合。
第三章是在学习了物质的量、分类法、氧化还原反应和离子反应等知识之后,开始具体地学习元素化合物的知识,改变了以往以“族”为单位的纵向编排顺序,采取 “钠、铝、铁”横向对比,希望通过对比让学生体会同是金属,其活泼性存在差异。学习利用金属活动性顺序进行一些初步的预测,学习比较的方法,为将来学习周期律做铺垫。
二、教学目标
1、用实验的方法探索和认识钠的性质。
2、通过实验了解活泼金属钠、铝与氧气的反应,归纳出活泼金属易与氧气发生反应的知识,了解金属氧化膜在生活生产中的运用,培养学生习惯用化学的视角去观察身边的物质。
三、教学重点
钠与氧气反应
四、教学难点
对实验现象的观察和分析
五、教学过程
【导入】用多媒体导入图片,说明在人类社会的发展过程中,金属起着重要的作用,并通过学生举出生活中所常见的一些金属材料,引导学生归纳金属单质的物理性质。
【学生】举例,归纳。
【过渡】金属具有一些物理通性,那么化学性质是否有相同点呢?今天我们一起来学习金属的化学性质。
【板书】第三章 金属及其化合物
第一节 金属的化学性质
【设问】通过金属元素在地壳中的含量的图片提出问题:地球上的绝大多数金属元素是以化合态存在还是以游离态存在于自然界中?为什么?
【思考与交流】教材P46
金属有哪些共同的化学性质?
1.举例说明金属能发生哪些化学反应?
2. 根据金属发生化学反应的照片,请分析这些反应,并写出化学方程式。
3. 画出Na、Mg、Al的原子结构示意图,分析它们的原子结构有什么特点,与金属的化学性质有什么联系。
【学生】分析,探究。
【设问】金属都能与氧气反应吗?金属与氧气反应是否一定要加热或点燃?
【学生】讨论
【引入】今天我们学习一种常见的活泼金属——钠
【实验】教材P47实验3-1
【学生】观察,得出钠的物理性质:银白色、有金属光泽的固体,热、电的良导体,质软,密度小,熔点低。
【问题】刚才切开钠时看到银白色,但很快就失去光泽,为什么?
【学生】观察,得出钠与氧气发生了反应
【板书】一、金属与非金属的反应:
1.与氧气的反应
①钠和氧气的反应
常温:4Na + O2 = 2Na2O (白色固体)
【设问】如果加热,钠又会发生什么变化呢?
【实验】教材P47实验3-2(让学生描述出反应的实验现象)
现象:钠先熔成小球,然后燃烧,发出黄色火焰,生成一种淡黄色固体——过氧化钠(Na2O2)
【板书】加热:2Na + O2==Na2O2 (淡黄色固体)
【分析】钠的保存:石蜡油或煤油中,以隔绝空气
【小结】Na与O2反应条件不同,现象不同,产物不同
【设问】铝能否与氧气反应呢?
【学生】教材P48科学探究
现象:打磨前及打磨后的两块铝箔都熔化,且失去光泽,但熔化的铝并不滴落,好像有一层膜在兜着。
结论:常温下,铝能很快与空气中的氧气反应,生成一层致密氧化膜,氧化膜熔点高,加热时氧化膜包裹着的内层铝熔化而不会滴落。

【板书】②铝和氧气的反应
4Al+3O22Al2O3
【学生自学】教材P49资料卡片:铝的氧化膜
【探究总结】钠、镁、铝与氧气反应的现象及产物比较,得出:大部分金属在常温和加热(或点燃)条件都能与氧气反应,与氧气反应的情况与金属的活泼性有关,金属越活泼就越容易与氧气反应。
【探究】金属除了能和前面所述的非金属单质O2反应外,还能和其他非金
属单质反应。
【板书】2.与其他非金属单质的反应
2Na+Cl2
板书设计
第三章 金属及其化合物
第一节 金属的化学性质(第一课时)
一、金属与非金属的反应
1.与氧气的反应
①钠和氧气的反应
常温:4Na+O2====2Na2O (白色固体)
加热:2Na+O
2
②铝和氧气的反应
4Al+3O2
2Na+Cl2
2NaCl 2Na+S====Na2S 【小结】金属与非金属的反应 Na2O2(淡黄色固体) 钠的保存:石蜡油或煤油中,以隔绝空气 2Al2O3 2NaCl 2Na+S====Na2S 2.与其他非金属单质的反应
